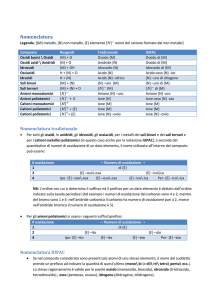
Nomenclatura Chimica
Numero di ossidazione
Il numero di ossidazione consiste nella carica elettrica formale che l’elemento
assume in un composto se si pensa di associare gli elettroni di ciascun legame
all’atomo considerato più elettronegativo. Il numero di ossidazione può quindi
assumere valori sia positivi che negativi. Quando gli elettroni di legame vengono
assegnati all’elemento più elettronegativo, esso si carica di tante cariche negative
quanti sono gli elettroni acquistati.
NON SEMPRE IL NUMERO DI OSSIDAZIONE COINCIDE
CON LA VALENZA
Valenza
N. ossidaz.
CH4
4
-4
C2H6 C2H4 C2H2 C3H8
4
4
4
4
-3
-2
-1
-8/3
2
Determinazione del numero di ossidazione
degli elementi nei loro composti
Il n.o. di un atomo in una molecola può essere determinato in
base alle seguenti semplici regole
Il n.o. di un atomo allo stato elementare è sempre = zero.
Il n.o. dell’ossigeno O è sempre –2, tranne in OF2 (n.o. +2) nei perossidi (O-O-, n.o. –1) e nei superossidi (n.o. –1/2).
Il n.o. dell’ H è sempre n.o. +1, tranne che negli idruri (composti binari con i
metalli) in cui presenta n.o. –1.
Nei composti ionici (catione / anione) il n.o. è uguale alla valenzaionica
preceduta da +/- (corrisponde alla propria carica).
La somma algebrica dei n.o. deve essere =0 per le specie neutre o = alla
sua carica per gli ioni molecolari
Stati di ossidazione
I metalli hanno stati di ossidazione pari al numero del gruppo
e corrispondenti alla perdita degli elettroni di valenza.
Sn4+
Pb4+ Bi5+
+1 +2
+3 +4 +5
Stati di ossidazione
I metalli più pesanti (periodo 5 o 6) possono mantenere i
due elettroni s di valenza e dare stati di ossidazione pari
al numero del gruppo meno due.
In+
Tl+
+1 +2 +3
I non-metalli (eccetto gli elementi più elettronegativi, come F
e O) possono avere molti numeri di ossidazione, compresi tra:
- il numero del gruppo
(n° d’ossidazione più alto)
tutti gli elettroni di
valenza persi
VII A
da +7
a
-1
VI A
da +6
a
-2
V A
da +5
a
-3
Terzo Gruppo
Quarto Gruppo
(terre)
(sottogr. A del carbonio)
B. Boro
+3 (non metallo)
C. Carbonio (+2), +4 (non metallo)
Al. Alluminio +3 (anfotero)
Si. Silicio (+2), +4 (non metallo)
Ce. Cerio
+3, + 4 (metallo) Sn. Stagno (+2), +4 (anfotero)
Pb. Piombo (+2), +4 (metallo)
Quinto Gruppo
Sottogruppo A dell’azoto
N. Azoto
-3, (+1), (+2), (+3), (+4), + 5 (non metallo)
P. Fosforo
-3, (+1),
(+3),
+ 5 (non metallo)
As. Arsenico -3, (+1),
(+3),
+ 5 (non metallo)
Sb. Antimonio -3,
(+3) (anf.) , + 5 (non metallo)
Bi. Bismuto
-3,
(+3) (met.) , + 5 (non metallo)
Sesto Gruppo
Sottogruppo A
Sottogruppo B
(non-metalli, calcogeni)
O. Ossigeno
-2, (-1)
Cr. Cromo
+2 (metallo)
S. Zolfo
+2, +4, +6
+3 (anfotero)
+6 (non metallo)7
Settimo Gruppo
Sottogruppo B
Sottogruppo A
(Non metalli, alogeni)
F. Fluoro
-1
Mn. Manganese +2 (metallo)
Cl. Cloro
-1,+1, +3, +5, +7
+3 (anfotero)
Br. Bromo
-1,+1, +3, +5, +7
+6,+7 (non metallo)
I. Iodio
-1,+1, +3, +5, +7
Ottavo Gruppo
(metalli)
Fe. Ferro
+2, +3
Co. Cobalto
+2, +3
Ni. Nichel
+2, +3
Note
Carbonio: solo composti inorganici
Ossigeno: -1 nei perossocomposti
Idrogeno: -1 negli idruri
Tutti gli elementi, come sostanze semplici, hanno n. o. zero
8
Da ricordare ……
• Il fluoro F ha sempre n.o. –1.
• Il cloro Cl ha sempre n.o. –1, tranne nei legami con F e con
O n.o. positivi.
•Il Br ha sempre n.o. –1 tranne nei legami con F, O e Cl
n.o. positivi.
• l’ H ha sempre n.o. positivo nei legami con i non metalli
(che sono più elettronegativi di lui) e sempre negativo con i
metalli (che sono meno elettronegativi di lui)
• I metalli hanno sempre n.o. positivi; i metalli alcalini: n.o.+1
• I metalli alcalino terrosi, Zn e Cd: n. o. + 2.
• Il B e l’Al: n.o. +3
• In una molecola la somma algebrica dei n.o. di tutti gli
atomi deve essere zero.
•In uno ione (positivo o negativo) la somma algebrica dei n.o.
9
deve essere uguale alla carica dello ione stesso.
Sia i metalli che i non metalli formano, nei loro numeri di ossidazione
positivi, composti binari con l’ossigeno
OSSIDI
METALLO
+
OSSIGENO
OSSIDO BASICO
(OSSIDO)
NON METALLO
+
OSSIGENO
OSSIDO ACIDO
(ANIDRIDE)
Nomenclatura IUPAC: Alla parola OSSIDO si aggiunge il nome
dell’elemento. Entrambi vanno preceduti da prefissi indicanti il
numero di atomi di ossigeno e di atomi metallici presenti nella
10
formula (mono, di, tri, tetra, penta, esa…)
OSSIDI BASICI (M + O): MxOy
Gli indici x e y dipendono dai rispettivi numeri di ossidazione:
M+ + O2- M2O
M2+ + O2- MO
M3+ + O2- M2O3
M4+ + O2- MO2
OSSIDI ACIDI (NM + O): ExOy
Gli indici x e y dipendono dai rispettivi numeri di ossidazione:
E1+ + O2- E2O
E2+ + O2- EO
E3+ + O2- E2O3
E4+ + O2- EO2
E5+ + O2- E2O5
E7+ + O2- E2O7
Esempi di ossidi metallici
•
•
•
•
•
•
Na2O:
Fe2O3:
BaO:
Li2O:
SnO2:
Al2O3:
Monossido di disodio
Triossido di diferro
Monossido di bario
Monossido di dilitio
Diossido di stagno
Triossido di dialluminio
Esempi di ossidi di non metalli
•
•
•
•
•
•
•
•
Cl2O: Monossido di dicloro
Cl2O3: Triossido di dicloro
Cl2O5: Pentossido di dicloro
Cl2O7: Eptossido di dicloro
CO: Monossido di carbonio
CO2: Diossido di carbonio
SO2: Diossido di zolfo
SO3: Triossido di zolfo
Nomenclatura Tradizionale per ossidi
metallici
Se l’elemento ha un solo numero di ossidazione: Alla parola
OSSIDO si fa seguire il nome dell’elemento; si può anche usare la
proposizione di, seguita dal nome dell’elemento
Se l’elemento ha due numeri di ossidazione: Alla parola
OSSIDO si aggiunge un attributo costituito dalla radice del nome
dell’elemento e da un suffisso:
-OSO riferito al n.o. più basso
-ICO riferito al n.o. più alto (anche usato per composti
derivati da elementi con n.o. unico)
Nomenclatura Tradizionale per ossidi
non metallici o anidridi
Alcuni non metalli (soprattutto gli alogeni) presentano più di
due n.o. positivi. Il loro nome si indica con la parola anidride
seguita da un attributo al femminile con gli stessi suffissi OSA
e ICA.
+2
+4
CO anidride carboniosa
CO2 anidride carbonica
Si utilizzano, oltre ai suffissi, anche i prefissi IPO- e PER- per
distinguere i possibili composti:
+1
+3
+5
+7
Cl2O
Cl2O3
Cl2O5
Cl2O7
anidride ipoclorosa
anidride clorosa
anidride clorica
anidride perclorica
IDROSSIDI (M+O+H)
Derivano formalmente dalla reazione di ossidi basici (ossidi
metallici) con acqua:
K2O + H2O 2 KOH
Sono costituiti dallo ione METALLICO positivo Mn+ e da n
IONI OSSIDRILI OH-. Valgono le stesse regole per la
nomenclatura:
NaOH
(Mono)Idrossido di sodio
Fe(OH)2
Diidrossido di ferro
Fe(OH)3
Triidrossido di ferro
Ca(OH)2
Diidrossido di calcio
Se l’elemento ha un solo numero di ossidazione si può utilizzare la
sola preposizione di:
Mg(OH)2:
Idrossido di magnesio
16
Acidi ossigenati o acidi ternari
• Derivano dalle anidridi per formale addizione di H2O.
• Nella formula si scrive dapprima l’H, quindi il simbolo
dell’elemento, ed infine l’ossigeno.
• Al nome dell’acido si associano gli stessi prefissi e suffissi
dell’anidride da cui deriva.
(anidride solforosa) SO2 + H2O H2SO3 (acido solforoso)
(anidride solforica) SO3 + H2O H2SO4 (acido solforico)
(anidride nitrica) N2O5 + H2O H2N2O6 HNO3 (acido nitrico)
(anidride carbonica) CO2 + H2O H2CO3 (acido carbonico)
Acidi Ossigenati
(Anidride ipoclorosa) Cl2O + H2O H2Cl2O2 2HClO
(acido ipocloroso)
(Anidride clorosa) Cl2O3 + H2O H2Cl2O4 2HClO2
(acido cloroso)
(Anidride clorica) Cl2O5 + H2O H2Cl2O6 2HClO3
(acido clorico)
(Anidride perclorica) Cl2O7 + H2O H2Cl2O8 2HClO4
(acido perclorico)
(Anidride bromica) Br2O5 + H2O H2Br2O6 2HBrO3
(acido bromico)
(Anidride bromosa) Br2O3 + H2O H2Br2O4 2HBrO2
(acido bromoso)
Acidi Ossigenati
Alcuni non metalli, soprattutto del IV e del V gruppo formano acidi con
formula corrispondente all’addizione di una quantità variabile di
molecole di H2O all’anidride. Così per uno stesso numero di ossidazione
possono esistere diversi acidi, distinguibili con appropriati prefissi,
fermo restando il suffisso associato a quel n.o. All’aumentare del numero
di molecole d’acqua si usano i seguenti suffissi: META-, PIRO- (o DI-),
ORTO.
P2O5 + H2O HPO3
P2O5 + 2 H2O H2P2O7
P2O5 + 3 H2O H3PO4
(acido metafosforico)
(acido pirofosforico o difosforico)
(acido ortofosforico)
IDROGENO
+
+
METALLO
NON METALLO
IDRURI
IDRACIDI
ACIDI BINARI
IDRACIDI (NM+H)
Gli alogeni e lo zolfo formano nei loro n.o. negativi, acidi binari con
l’H. Si indicano col suffisso –IDRICO (essi fanno comunque parte
di una classe più vasta, detta dei composti binari, il cui nome
sistematico IUPAC si ottiene ponendo dapprima la radice del nome
dell’alogeno, più elettronegativo dell’idrogeno, a cui va aggiunta la
desinenza –URO, seguito dalla preposizione di e dal nome del
primo costituente)
HF
HCl
H2S
HBr
HI
HCN
acido fluoridrico (fluoruro di idrogeno)
acido cloridrico (cloruro di idrogeno)
acido solfidrico (solfuro di idrogeno)
acido bromidrico (bromuro di idrogeno)
acido iodidrico (ioduro di idrogeno)
acido cianidrico (cianuro di idrogeno)
ACIDI
IDRACIDI
ACIDI
OSSIGENATI
OSSIDI ACIDI
Composti binari con l’idrogeno
Oltre agli IDRACIDI, esistono altri composti binari con l’idrogeno
I metalli si combinano con l’idrogeno avente n.o. –1 formando
composti comunemente detti IDRURI METALLICI:
AlH3
idruro di alluminio
LiH
idruro di litio
FeH3
idruro ferrico
L’ossigeno, come lo zolfo in H2S, forma l’acqua H2O
Gli elementi del Vo gruppo si legano ad H nei loro n.o. negativi
(-3):
NH3
ammoniaca
PH3
fosfina
AsH3
arsina
SbH3
stibina
Il carbonio, il silicio e il boro formano i seguenti composti:
CH4
metano
SiH4
silano
BH
borano
Composti binari tra Metalli e Non
Metalli (M+NM): “SALI BINARI”
I non metalli danno frequentemente tra loro composti binari
covalenti. All’elemento più elettronegativo si dà il suffisso –URO:
ICl
Si3N4
OF2
SiC
P2S3
cloruro di iodio
nitruro di silicio
fluoruro di ossigeno*
carburo di silicio
solfuro fosforoso
* ATTENZIONE: OF2 è l’unico composto in cui O ha n.o. +2
Ioni metallici positivi (cationi)
nomenclatura IUPAC
1. Per uno ione monoatomico positivo, cioè un catione
metallico, il nome del metallo è preceduto dalla parola
“ione”. Esempio: Na+, ione sodio, Ca++ ione calcio.
2. Per i metalli di transizione, i quali possono avere più di
uno ione positivo, si usa un numero romano per indicare la
carica dello ione. Esempio: Fe2+, ione ferro (II), Fe3+,
ione ferro (III), Hg2+ ione mercurio (II), Hg22+ ione
mercurio (I).
Ioni negativi
HC4N3Ione
Ione
Ione
idruro carburo nitruro
O2FIone
Ione
ossido fluoruro
P3S2ClIone
Ione
Ione
fosfuro solfuro cloruro
Gli ioni monoatomici (costituiti da un solo atomo)
fanno seguire alla radice dell’elemento la
desinenza uro. Lo ione O2- fa eccezione e viene
indicato con la parola ossido.
Gli ioni F-, Cl-, Br-, I-, S2- possono essere
considerati derivati dall’acido alogenidrico per
perdita di uno ione H+ (residuo alogenico)
BrIone
bromuro
IIone
ioduro
Ioni Poliatomici, ossoanioni
Quello che resta di un acido
ossigenato per perdita di atomi di
idrogeno si chiama radicale
acido. Per ogni idrogeno tolto si
aggiunge una carica negativa.
Il numero delle cariche
costituisce la valenza del radicale
Si usano suffissi diversi da
quelli dei corrispondenti
acidi:
-OSO -ITO
-ICO -ATO
CO32Ione
carbonato
NO2Ione
nitrito
NO3Ione
nitrato
SO32Ione
solfito
SO42Ione
solfato
ClOIone
ClO2Ione
ClO3Ione
ipoclorito
clorito
clorato perclorato
BrOIone
BrO2Ione
BrO3Ione
ClO4Ione
BrO4Ione
ipobromito bromito bromato perbromato
Ioni Poliatomici, ossoanioni
HClO acido ipocloroso
HClO2 acido cloroso
HClO3 acido clorico
HClO4 acido perclorico
HBrO acido ipobromoso
HClO2 acido bromoso
HClO3 acido bromico
HClO4 acido perbromico
HNO2 acido nitroso
HNO3 acido nitrico
H2SO3 acido solforoso
H2SO4 acido solforico
H3PO4 acido fosforico
ClOClO2ClO3ClO4BrOClO2ClO3ClO4NO2NO3SO32SO42PO43-
ione ipoclorito
ione clorito
ione clorato
ione perclorato
ione ipobromito
ione bromito
ione bromato
ione perbromato
ione nitrito
ione nitrato
ione solfito
ione solfato
ione fosfato
Ossoanioni contenenti ancora uno o
più atomi di idrogeno
La perdita parziale di ioni H+ dà luogo a radicali ionici
negativi indicati col prefisso IDROGENO-:
HSO4-
ione idrogenosolfato
E, se necessario, anche i prefissi mono-, di-, tri- per indicare
il numero di ioni H+:
H2PO4-
ione diidrogenofosfato
HPO42H2PO4HCO3HSO4HSO3Ione
Ione
Ione
Ione
Ione
Idrogeno Diidrogeno Idrogeno Idrogeno Idrogeno
-fosfato -fosfato -carbonato -solfato
-solfito
Bicarbonato, bisolfato, bisolfito
Nomenclatura corrente: prefisso “bi”
Sali
I sali si originano per reazione tra un composto derivato da
un metallo (ossido basico, idrossido o il metallo stesso) e
un composto derivato da un non metallo (anidride, acido o
lo stesso non metallo)
Un sale è costituito da una parte metallica (ione del metallo o altro
catione tra quelli descritti) e da una parte non metallica (un
radicale acido o altri anioni).
Il NOME del sale è dato
dall’attributo del corrispondente
Radicale acido completo
di suffissi e prefissi,
seguito dal nome dello ione positivo
con i suffissi –OSO e –ICO
a seconda del n.o.
La FORMULA di un sale si
compone del simbolo del metallo
(o dello ione positivo) seguito dal
simbolo del radicale acido. Al primo
diamo come indice la valenza del
secondo e viceversa, poi, se è possibile,
si semplificano gli indici
dividendoli per uno stesso numero.
Esempi….
SOLFATO FERROSO:
CARBONATO SODICO:
• S (zolfo), non metallo, n.o. +6
(suffisso –ATO)
•S O
SO3: anidride solforica
• SO3+ H2O H2SO4 acido solforico
• H2SO4 2H+ + SO42- : radicale
solfato (valenza 2)
• Fe (ferro), metallo, n.o. +2 (suffisso –
OSO)
• Fe2+ ione ferroso (valenza 2)
• C (carbonio), non metallo, n.o. +4
(suffisso –ATO)
•C O
CO2: anidride carbonica
• CO2 + H2O H2CO3 : acido carbonico
• H2CO3
2H+ + CO32-: radicale
carbonato (valenza 2)
• Na (sodio), metallo, n.o. +1 (suffisso –
ICO)
• Na+: ione sodico (valenza 1)
Fe2(SO4)2
semplificando
FeSO4
Na2CO3
Esempi….
Perclorato di rame
(Perclorato rameico):
Ipoiodito di potassio
( ipoiodito potassico):
•Cl (cloro), non metallo, n.o. +7
•I (iodio), non metallo, n.o. +1
(prefisso –PER e suffisso –ATO)
(prefisso –IPO e suffisso –ITO)
•Cl O
•I O
Cl2O7: anidride perclorica
•Cl2O7 + H2O
H2Cl2O8
HClO4
acido perclorico
I2O: anidride ipoiodosa
•I2O + H2O
HIO: acido ipoiodoso
•IO- : radicale ipoiodito (valenza 1)
•ClO4-: ione perclorato (valenza 1)
•K (potassio), metallo, n.o. +1
•Cu (rame), metallo, n.o. +2 (suffisso
(suffisso –ICO)
–ICO)
•K+ : ione potassico (valenza 1)
•Cu2+ : ione rameico (valenza 2)
Cu(ClO4)2
KIO
Esempi
•
•
•
•
•
•
•
•
•
•
•
•
•
K2CO3:
Cu(NO3)2:
CuCl:
FeCl3:
Fe2(SO3)3:
Na2SO4:
BaSO4:
Na3PO4:
Al2S3:
AlPO4:
MnCl2:
KMnO4:
NH4Cl:
carbonato potassico
nitrato rameico
cloruro rameoso
cloruro ferrico
solfito ferrico
solfato sodico
solfato di bario
fosfato sodico
solfuro di alluminio
fosfato di alluminio
cloruro di manganese
permanganato di potassio
cloruro di ammonio
Sali acidi (derivanti da ossoanioni acidi)
I sali formati dai derivati dagli acidi per parziale perdita di ioni H+ sono detti
SALI ACIDI. Ad esempio da H2SO4 si possono formare sia SO42- (valenza 2)
sia HSO4- (valenza 1). I sali che derivano da questi nuovi acidi sono
genericamente indicati come sali acidi oppure vengono chiamati col prefisso
IDROGENO-. Quindi lo ione HSO4- verrà denominato solfato acido oppure
idrogenosolfato.
•Nel caso di acidi con più di due H, i radicali acidi
che si possono formare sono più di due. Si
useranno allora appropriati prefissi.
S (zolfo), non metallo, n.o. +6 (suffisso – ESEMPIO: H3PO4 acido ortofosforico da cui
derivano i seguenti radicali acidi:
ATO)
•H2PO4- ione fosfato biacido o diidrogenofosfato
SO3: anidride solforica
Ca(H2PO4)2 diidrogenofosfato calcico (o di calcio)
H2SO4: acido solforico
(anche fosfato monocalcico)
2HSO4 : radicale idrogenosolfato (valenza •HPO 2- ione fosfato monoacido oppure ione
4
1)
monoidrogenofosfato
Mn (manganese), metallo, n.o. +2 (suffisso CaHPO4 monoidrogenofosfato calcico (o di calcio)
–OSO)
(anche fosfato bicalcico)
•PO43- ione fosfato
Mn2+ :ione manganoso (valenza 2)
Ca3(PO4)2 fosfato calcico (o di calcio)
34
Mn(HSO4)2
(anche fosfato tricalcico)
SOLFATO ACIDO
MANGANOSO
•
•
•
•
•
•
ELEMENTI
METALLI
I, II, III, Sn, Pb, Bi
blocco d e blocco f
SEMIMETALLI
Zn, Al, Si, Ge, As. Sb
NON METALLI
B, C, N, P, VI, VII
+ ossigeno
OSSIDI
+ ossigeno
OSSIDI ANFOTERI
+ ossigeno
ANIDRIDI
+ acqua
IDROSSIDI
+ acqua
IDROSSIDI
+ acqua
ACIDI OSSIGENATI
idrossidi + acidi ossigenati
SALI
++acqua
acqua
ACIDI
OSSIGNATI
ACIDI OSSIGENATI
Tipi di reazioni chimiche
Le reazioni chimiche si possono suddividere in due grandi
gruppi
Reazioni in cui nessun elemento cambia il suo grado di
ossidazione durante la trasformazione
reazione di decomposizione del carbonato di calcio
CaCO3 ↔ CaO + CO2
Reazioni in cui alcuni atomi cambiano il loro grado di ossidazione
durante la trasformazione
reazione di combustione dello zolfo
S + O2 ↔ SO2
Le reazioni che appartengono a quest’ultimo gruppo vengono
chiamate reazioni di ossidoriduzione o reazioni redox
Reazioni redox
In una reazione di ossido-riduzione avviene un trasferimento reale
o formale di elettroni da un atomo all’altro. In seguito a questo
trasferimento un atomo perde elettroni (si ossida), mentre l’altro li
acquista (si riduce)
- Ossidazione è la trasformazione che porta ad un aumento del
grado di ossidazione; la specie che si ossida aumenta il suo n.o.
perdendo elettroni
Na ↔ Na+ + e–
- Riduzione è la trasformazione che porta ad una diminuzione del
grado di ossidazione; la specie che si riduce diminuisce il suo n.o.
acquistando elettroni
Cl2 + 2e– ↔ 2Cl–
Reazioni di ossido-riduzione
Reazioni in cui almeno una coppia di atomi
cambia numero di ossidazione
OSSIDARSI significa perdere elettroni
RIDURSI significa acquistare elettroni
Quando un atomo si ossida, gli elettroni
ceduti non possono rimanere in forma
libera, ma devono essere acquistati da un
altro atomo che così facendo si riduce
Ossidanti e riducenti
Poiché in una reazione chimica non si possono né creare né
distruggere elettroni, non può esistere un processo di ossidazione
senza un simultaneo processo di riduzione; inoltre il numero di
elettroni acquistati dall’agente ossidante deve essere uguale al numero
di elettroni ceduti dall’agente riducente
2Na + Cl2 ↔ 2Na+ + 2Cl–
Ciascuna molecola di Cl2 (agente ossidante) acquista due elettroni,
mentre ciascun atomo di Na (agente riducente) cede un elettrone
Reazioni di Ossido-riduzione
Una specie che si ossida è un riducente
Una specie che si riduce è un ossidante
Agente ossidante è una molecola, un atomo o uno ione
capace di acquistare elettroni (provoca l’ossidazione di
un’altra specie, riducendosi)
Agente riducente è una molecola, un atomo o uno ione
capace di cedere elettroni (provoca la riduzione di
un’altra specie, ossidandosi)
Reazioni di ossido-riduzione
C + O2 CO2
C: da 0 a +4
O: da 0 a -2
La sostanza che acquista elettroni (O) si riduce, ed è detta
ossidante.
La sostanza che perde elettroni (C) si ossida, ed è detta
riducente.
Reazioni di dismutazione
Un particolare tipo di reazione di ossidoriduzione è rappresentato
dalle reazioni di dismutazione (o disproporzione), nelle quali una
stessa specie chimica si comporta da ossidante e da riducente
Il perossido di idrogeno si decompone lentamente secondo la
reazione
2H2O2 ↔ 2H2O + O2
In questo caso l’ossigeno presente nel perossido in parte si ossida
(n.o. –1, 0) e in parte si riduce (n.o. –1, –2)
Danno questo tipo di reazione le specie chimiche che contengono
un elemento in uno stato di ossidazione intermedio
Bilanciamento delle reazioni redox
1. Bilanciamento del numero di elettroni
2. Bilanciamento delle cariche
3. Bilanciamento degli atomi
La differenza tra una reazione di ossido riduzione ed una qualsiasi
altra reazione è che non solo le masse e le cariche dovranno essere
bilanciate, ma anche il numero degli elettroni ceduto nella
ossidazione deve essere uguale a quello acquisito nella riduzione
Criteri per il bilanciamento dell’equazione chimica di una
reazione redox in soluzione acquosa:
Ambiente acido ioni H+ in eccesso
nell’equazione chimica aggiungere H+ fra i reagenti o fra i
prodotti
Ambiente basico ioni OH– in eccesso
nell’equazione chimica aggiungere OH– fra i reagenti o fra i
prodotti
Ambiente neutro
nell’equazione chimica aggiungere H2O fra i reagenti (H+ o OH–
fra i prodotti)
45
Bilanciamento: metodo della variazione dello
stato di ossidazione
-1e+6
Cr2O72- + I- I2 + Cr3+
+3e- x 2 = +6e-
Cr2O72- + 6I- I2 + Cr3+
Cr2O72- + 6I- 3I2 + 2Cr3+
Cr2O72- + 6I- + 14H+ 3I2 + 2Cr3+
Cr2O72- + 6I- + 14H+ 3I2 + 2Cr3+ + 7H2O
Bilanciamento: metodo della variazione dello
stato di ossidazione
1. Assegnare i numeri di ossidazione a tutti gli atomi;
2. decidere quali atomi cambiano numero di ossidazione e come;
3. calcolare gli elettroni scambiati nel processo redox;
4. Fare il minimo comune multiplo e iniziare il bilanciamento
Al termine della prima fase:
1. bilanciare prima i metalli
2. bilanciare i non metalli
3. bilanciare le cariche
4. bilanciare gli idrogeni
5. bilanciare gli ossigeni (per controllo)
Bilanciamento: metodo delle semireazioni
Cr2O72- + I- I2 + Cr3+
1) Cr2O72- Cr3+ riduzione
2) I- I2
ossidazione
1) Cr2O72- 2Cr3+ + 7 H2O
2) 2I- I2
1) Cr2O72- + 14 H+ + 6e- 2Cr3+ + 7 H2O
X1
2) 2I- I2 + 2e-
X3
1) Cr2O72- + 14 H+ + 6e- 2Cr3+ + 7 H2O
X1
2) 2I- I2 + 2e-
X3
1) Cr2O72- + 14 H+ + 6e- 2Cr3+ + 7 H2O
2) 6I- 3I2 + 6e-
1) Cr2O72- + 14 H+ + 6I- 2Cr3+ + 7 H2O + 3I2
Bilanciamento: metodo delle semireazioni
1. Scrivere la reazione non bilanciata con le specie che realmente
partecipano
2. Decidere chi si ossida e chi si riduce, e scrivere le due semireazioni
non bilanciate
3. Bilanciare le due semireazioni tutto tranne O e H
4. Bilanciare l’O aggiungendo acqua al lato con meno O, e poi
bilanciare l’H aggiungendo H+ dal lato con meno H
5. Bilanciare la carica in ciascuna semireazione, aggiungendo elettroni
e poi moltiplicare per opportuni fattori per rendere il numero di
elettroni uguali da entrambi i lati
6. Sommare le due semireazioni ed eliminare le specie che compaiono
da entrambi i lati
7. Controllare che la reazione sia bilanciata