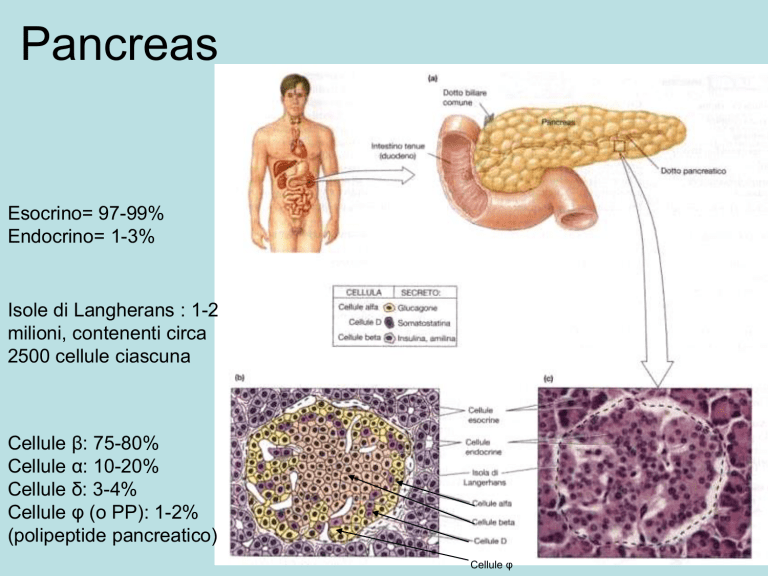
Pancreas
Esocrino= 97-99%
Endocrino= 1-3%
Isole di Langherans : 1-2
milioni, contenenti circa
2500 cellule ciascuna
Cellule β: 75-80%
Cellule α: 10-20%
Cellule δ: 3-4%
Cellule φ (o PP): 1-2%
(polipeptide pancreatico)
Cellule φ
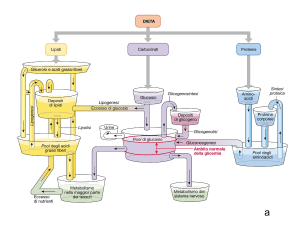
Insulina e
glucagone
sono coinvolti
nell’omeostasi
glicemica
↑ Glucosio
nel sangue
↓ Glucosio
nel sangue
Cellule
α
Cellule
β
↑ Glucosio
nel sangue
↓ Glucosio
nel sangue
Glucagone
1) Fegato: il glicogeno viene
trasformato in glucosio (glicogenolisi)
2) Fegato: vari nutrienti vengono
trasformati in glucosio
(gluconeogenesi)
3) Il glucosio passa nel sangue
Insulina
1) ↑ il trasporto del glucosio nelle
cellule
2) ↑ la conversione di glucosio in
glicogeno (glicogenesi)
3) ↓glicogenolisi e gluconeogenesi, ↑ la
lipogenesi
4) ↑ il trasporto di aminoacidi dal
sangue alle cellule e la sintesi
proteica nelle cellule
Insulina e glucagone
assicurano continuità di
rifornimento di substrati
e di energia
I due ormoni sono sempre
presenti nel sangue: ciò che
varia è il loro rapporto.
Nello stato di sazietà, quando
l’organismo assorbe i nutrienti,
l’insulina è dominante e
prevalgono i processi
anabolici.
Nel digiuno, grazie al
glucagone, il fegato utilizza
glicogeno ed intermedi non
glucidici per sintetizzare
glucosio da rilasciare in circolo
La secrezione degli ormoni pancreatici è
coordinata con la secrezione esocrina degli
enzimi pancreatici
• Gli enzimi pancreatici raggiungono il lume intestinale attraverso il
dotto pancreatico. I prodotti di digestione raggiungono il fegato
attraverso la vena porta.
• Gli ormoni insulari vengono riversati nella vena porta e raggiungono
il fegato con i prodotti di digestione dei substrati nutritivi.
• Nel fegato, insulina e glucagone regolano il metabolismo,dei
prodotti di digestione delle sostanze ingerite.
• Analogamente gli ormoni insulari regolano il metabolismo degli
stessi substrati nei tessuti periferici.
Il glucagone
(ormone polipeptidico – 29 amminoacidi)
Il glucagone è prodotto sia dalle cellule α pancreatiche, sia dalle cellule L intestinali
a partire da un precursore: il preproglucagone (179 amminoacidi).
Le cellule L, però, a partire dallo stesso precursore, producono soprattutto
glicentina (con effetti simili al glucagone), oxintomodulina (che inibisce la
secrezione acida gastrica), GLP-1 ( che stimola la produzione di insulina, inibisce
quella di glucagone, inibisce l’assunzione di cibo agendo a livello del SNC) e GLP2 (che inibisce la motilità e la secrezione acida dello stomaco oltre ad avere effetti
trofici su intestino tenue e colon)
Caratteristiche
• Biosintesi: tipica dei peptidi
• Trasporto nella circolazione: disciolto nel plasma
• Emivita: 4-10 minuti. Viene catabolizzato prevalentemente a livello
epatico
• Recettore bersaglio: recettore di membrana
• Meccanismo d’azione: 1) il recettore è connesso ad una proteina G; 2)
viene attivata l’adenilatociclasi con formazione di cAMP (II messaggero
intracellulare); 3) a livello epatico viene attivata la proteinchinasi A che
attiva la fosforilasi; 4) vengono modificati enzimi già esistenti e viene
stimolata la sintesi di nuovi enzimi
• Tessuti bersaglio: principalmente il fegato, ma anche il tessuto adiposo
Effetti biologici
• Il glucagone è un ormone iperglicemizzante
• A livello epatico stimola la glicogenolisi e la
neoglucogenesi a partire dagli aminoacidi
disponibili
• A livello di tessuto adiposo, stimola la lipolisi, con
conseguente aumento degli ac. grassi liberi e
formazione dei corpi chetonici a livello epatico
• La somministrazione di dosi farmacologiche di
glucagone determina un aumento della forza di
contrazione miocardica
Effetti sul metabolismo dei
carboidrati nel fegato
= aumento
= diminuzione
Effetti sul metabolismo proteico nel fegato
(In particolare, alanina, arginina, glutamina)
= aumento
= diminuzione
Effetti sul metabolismo lipidico nel fegato
= aumento
= diminuzione
(dal tessuto
adiposo per ↓
di insulina e
↑di glucagone)
lipolisi
(Alla gluconeogenesi)
Al muscolo,
al cuore, al
cervello
Regolazione della secrezione:
stimolazione
• Ipoglicemia < 200 mg/dL
• Attivazione del simpatico mediata dai recettori βadrenergici che stimolano la formazione di
cAMP dentro le cellule α
• Attivazione vagale
• Aminoacidi derivanti da un pasto proteico
• Digiuno
• Esercizio fisico
• Colecistochinina e gastrina
Regolazione della secrezione:
inibizione
• Iperglicemia (meccanismo a feedback)
• Ac.grassi liberi e corpi chetonici
• Secretina
• Somatostatina
Insulina
(ormone polipeptidico – 51 aminoacidi)
Biosintesi
Dalla preproinsulina si stacca un peptide di 23 aminoacidi quando la molecola va al
reticolo endoplasmatico e si forma la proinsulina.
La proinsulina, per effetto di convertasi (PC1, PC2, PC3) e di carbossipeptidasi H
(CPE), dà luogo all’insulina e al peptide C che rappresenta il reale indice di
secrezione dell’insulina
Caratteristiche I
• Biosintesi: tipica dei peptidi
• Trasporto nella circolazione: disciolto nel plasma
• Emivita: 5 minuti circa. Viene catabolizzata a livello epatico e renale
•
•
•
•
Recettore bersaglio: recettore di
membrana formato da 4 subunità,
2 catene α extracellulari e 2 β
intracellulari con attività tirosin-chinasica
• Tessuti bersaglio: soprattutto muscolo,
• tessuto adiposo e fegato; cervello, reni,
• intestino, non sono insulino-dipendenti
Caratteristiche II
• Meccanismo d’azione: 1) il legame dell’insulina
con il recettore stimola l’attività chinasica della
catena β, dando luogo all’autofosforilazione della
catena);
• 2) viene attivata una serie di reazioni a cascata
intracellulari che portano ad attivare proteine che
regolano la sintesi dei lipidi, del glicogeno e delle
proteine;
• 3) in particolare,nelle cellule muscolari e adipose,
vengono attivate le vescicole che contengono il
trasportatore Glut4 che viene inserito nella
membrana cellulare permettendo l’assorbimento
del glucosio
La proteina-chinasi
La proteina chinasi è il sistema recettoriale più semplice
perché agisce contemporaneamente da recettore e da enzima
amplificatore
Azione della proteina-chinasi per
l’insulina
L’insulina modifica il trasporto di glucosio nel
tessuto adiposo e nel muscolo scheletrico
Meccanismo d’azione dell’insulina
sulle cellule epatiche
A) Nello stato assimilativo la
cellula epatica assorbe glucosio
B) Nello stato post-assimilativo la cellula
epatica produce glucosio e lo rilascia nel
sangue
Azione sul metabolismo dei
carboidrati
Frecce grosse = aumento di flusso
Azione sul
metabolismo
proteico
Frecce grosse = aumento di flusso
Azione sul metabolismo della cellula adiposa
Effetto complessivo: immagazzinamento di trigliceridi
Frecce grosse =
aumento di flusso
La lipasi delle lipoproteine (LPL) si trova sulla membrana delle cellule
endoteliali, nei vasi del tessuto adiposo
Effetti biologici
• L’insulina è l’unico ormone ipoglicemizzante: infatti a livello plasmatico
riduce la concentrazione del glucosio per aumento del metabolismo e del
trasporto del glucosio dentro le cellule
• A livello epatico stimola la glicogenosintetasi e la sintesi proteica e lipidica.
Riduce la chetogenesi e inibisce la gluconeogenesi
• A livello di tessuto muscolare, stimola la captazione di glucosio, con
conseguente aumento della sintesi di glicogeno, e la captazione degli
aminoacidi con conseguente aumento della sintesi proteica. Inoltre
aumenta la captazione dei corpi chetonici e del K+
• A livello di tessuto adiposo, stimola la captazione di glucosio e la
captazione e la sintesi degli ac. grassi che vengono depositati sotto forma
di trigliceridi.
• L’insulina, stimolando la sintesi proteica e l’utilizzazione del glucosio,
favorisce la crescita dell’organismo
La secrezione dell’insulina segue
un ritmo circadiano
La secrezione di insulina è caratterizzata da
picchi postprandiali ed altri indipendenti dai
pasti
Il picco postprandiale raggiunge il massimo
dopo circa 60 min. e poi declina
Circa il 50% dell’insulina viene secreto dal
pancreas in condizioni basali, mentre l’altro
50% è prodotto dalla stimolazione dei pasti
ingeriti
La risposta secretoria delle celluleβ ha un
andamento bifasico: un picco rapido (dovuto
alla presenza di insulina rapidamente
liberabile), seguito da uno ritardato (dovuto
ad insulina sintetizzata ex novo)
*
* Pasti consumati alle ore 9.00, 13.00, 18.00
Regolazione della secrezione:
stimolazione
• Iperglicemia > 100 mg/dL
• Attivazione del parasimpatico
• Aumento aminoacidi ematici (soprattutto arginina e
lisina)
• Corpi chetonici e ac. grassi
• Ormoni gastrointestinali (*GLP-1, *GIP, gastrina,
secretina, *CCK solo a dosi farmacologiche) per
un meccanismo detto riflesso anticipativo. Questo
riflesso anticipativo fa sì che il glucosio assorbito
per via intestinale aumenti la secrezione di insulina
più che il glucosio somministrato per via
endovenosa
•*GLP-1 = peptide glucagone-simile 1; GIP = peptide insulinotropico glucosiodipendente; CCK = colecistochinina)
Come avviene la stimolazione delle cellule β da parte
del Glucosio?
GLUT-2
Regolazione della secrezione:
inibizione
• Ipoglicemia (meccanismo a feedback)
• Attività del simpatico (mediata dai recettori
adrenergici α)
• Somatostatina
Interazione tra
insulina e
glucagone dopo
un pasto
(sazietà)
I processi accelerati da alta
concentrazione di insulina e
bassa concentrazione di
glucagone sono indicati con +
Interazione tra
insulina e
glucagone
durante il
digiuno
I processi accelerati da bassa
concentrazione di insulina e
alta concentrazione di
glucagone sono indicati con +
(LP= lipoproteine)
Sintesi del
metabolismo
nello stato
assimilativo
Sintesi della risposta endocrina al
digiuno
Iperinsulinemia
• Conseguenza principale è una forte
ipoglicemia
• Poiché il SNC utilizza il glucosio come
fonte energetica, la sua carenza porterà a
gravi alterazioni del SNC
• Sarà quindi indispensabile aumentare
l’introduzione di carboidrati
Ipoinsulinemia
• Iperglicemia
• Glicosuria e poliuria
• Disidratazione e sete
• Lipolisi con aumento di ac. grassi liberi
• Calo ponderale per perdita dei depositi adiposi e
della massa corporea magra
• Acidosi metabolica per diminuzione di
bicarbonato e pH plasmatico
• Polifagia
Diabete Mellito
• Termine che indica un gruppo di disordini
metabolici che hanno in comune la iperglicemia
• I fattori che determinano la iperglicemia possono
essere di varia natura:
• ridotta secrezione di insulina,
• resistenza all’azione dell’insulina,
• aumentata produzione di glucosio,
• intolleranza al glucosio in gravidanza,
• difetti genetici
Diabete mellito insulino-dipendente
(di tipo 1 o giovanile)
• Cause possibili:
• mutazione del gene precursore
dell’insulina
• malattia autoimmune, in cui le cellule β
sono distrutte dal sistema immunitario
Diabete mellito non insulino-dipendente
(tipo 2)
• I recettori non riconoscono l’insulina
• Il pancreas cerca di sopperire alla
mancata azione insulinica secernendo più
ormone (iperinsulinemia)
• le cellule β “si sfiancano” e riducono la loro
capacità di secernere l’ormone
• alla fine cessano del tutto la produzione di
insulina
Fattori predisponenti al diabete di
tipo 2
• Alcuni fattori riducono la sensibilità
periferica all’insulina:
• Diete ipercaloriche e iperlipidiche
• Obesità
• Sedentarietà
Dieta per il diabete di tipo 2
• Diminuzione dell’apporto energetico
• Diminuzione del contenuto di grassi soprattutto
saturi
• Riduzione dell’introduzione di carboidrati ad
elevato indice glicemico (cioè capaci di
aumentare di molto e in tempi brevi i livelli di
glucosio circolanti)
• Riduzione dell’introduzione di bevande
alcooliche che favoriscono la ipertrigliceridemia
Indice glicemico
Indice glicemico = rapporto percentuale tra l’area incrementale della risposta glicemica
postprandiale ad un determinato alimento e quella di un alimento standard (pane). E’
inferiore nei carboidrati complessi
L’IG è un importante
indicatore della qualità
nutrizionale dei
carboidrati disponibili
IUAC = area incrementale sotto la curva
Per carico glicemico si
intende un valore espresso
dal prodotto della quantità di
carboidrati consumati per il
loro indice glicemico, ed è
approssimativamente
proporzionale al fabbisogno
di insulina necessario al
controllo della glicemia
postprandiale
Curva da carico
orale di glucosio
Si utilizza per accertare la predisposizione
al diabete o la sua presenza non
conclamata. E’ controindicata in soggetti a
diabete conclamato
Il soggetto deve essere digiuno da 12-16 h
massimo, non deve avere malattie virali,
non stressato, non deve fumare e deve
restare seduto o sdraiato per tutto il tempo
della prova (3h circa)
I prelievi sono effettuati dopo 30, 60,
90, 120 min dopo l’ingestione di 75 gr
di glucosio
A = soggetto normale; B = soggetto
diabetico di tipo 1; C soggetto diabetico di
tipo 2