Programma
•
FARMACI ATTIVI SULLA NEUROTRASMISSIONE (SNP)
– Farmaci attivi sulla neurotrasmissione COLINERGICA
– Farmaci attivi sulla neurotrasmissione ADRENERGICA
•
FARMACI ATTIVI SUL SISTEMA NERVOSO CENTRALE (SNC)
–
–
–
–
–
–
•
•
Anestetici
Ipnotici ed ansiolitici
Anticonvulsivanti
Antipsicotici
Antidepressivi
Analgesici oppioidi
FARMACI ANTIINFIAMMATORI NON STEROIDEI
FARMACI ATTIVI SUL SISTEMA ORMONALE
– Corticosteroidi
– Estrogeni, progestinici e androgeni
•
•
FARMACI ANTISTAMINICI H1
FARMACI ATTIVI SUL SISTEMA CARDIOVASCOLARE
–
–
–
–
–
Farmaci cardiaci
Diuretici
ACE-inibitori
Simpaticolitici centrali e periferici
Antilipoproteinemici ed inibitori della sintesi del colesterolo
Testi consigliati
•
Gasco, Gualtieri, Melchiorre: «Chimica Farmaceutica», Casa Editrice Ambrosiana (2015)
•
Graham L. Patrick: «Chimica Farmaceutica» III Ed., EdiSES (2015)
•
Williams, Lemke: "Foye's Principi di Chimica Farmaceutica" VI Ed., Piccin (2014)
•
Wilson and Gisvold’s “Chimica Farmaceutica” XII Ed (2014), Lippincott Williams & Wilkins
•
Silverman: "The Organic Chemistry of Drug Design and Drug Action", III Ed. (2014), Elsevier
Academic Press
di consultazione:
•
A. Kleemann, J. Engel: “Sostanze Farmaceutiche. Sintesi, Brevetti, Applicazioni” Oemf
•
Burger's: "Medicinal Chemistry and Drug Discovery", VII Ed. (2010), Wiley Interscience
CHIMICA FARMACEUTICA
(secondo la definizione IUPAC)
La Chimica Farmaceutica si interessa
– della scoperta, progettazione, identificazione e
preparazione delle sostanze biologicamente attive
(FARMACI)
– delle loro proprietà, metabolismo e meccanismo a
livello molecolare
– della costruzione delle relazioni struttura-attività
(SAR)
Le caratteristiche strutturali sono alla base
dell’attività farmacologica
interazioni con l’ambiente
interazioni con le macromolecole
biologiche (proteine, acidi nucleici…)
proprietà chimico-fisiche
proprietà biologiche
(solubilità, permeabilità,
stabilità chimica…)
(legame con il recettore, metabolismo,
affinità di legame, trasporto…)
farmacodinamica/farmacocinetica/tossicità
(attività biologica, biodisponibilità, emivita, clearance, LD50…)
Caratteristiche strutturali di una molecola
di interesse in un farmaco
– peso molecolare
– pKa
– possibilità di stabilire legami idrogeno
– lipofilicità
– polarizzabilità
– reattività chimica
La regola del 5 di Lipinski
assorbimento e permeabilità insoddisfacenti se:
1. n° di donatori di legami-H ≥ 5;
2. peso molecolare > 500;
3. logP > 5;
4. n° di accettori di legami-H > 10;
(l‘eventuale trasporto attivo determina eccezioni alla regola)
Esempi di calcolo del legame-H per
le regole di Lepinski
Gruppo funzionale donatore di legame-H accettore di legame-H
-OH (ossidrile)
1 (OH)
1 (O)
-COOH (ac carbossilico)
1 (OH)
2 (O)
0
2 (N,O)
-NH2 (ammina Ia)
2 (NH2)
1 (N)
-NHR (ammina IIa)
1 (NH)
1 (N)
-NR2 (ammina IIIa)
0
1 (N)
-CHO (aldeide)
0
1 (O)
-COOR (estere)
0
2 (O)
-C-O-C (etere)
0
1 (O)
-CN (nitrile)
0
1 (N)
-CONR2 (amide IIIa)
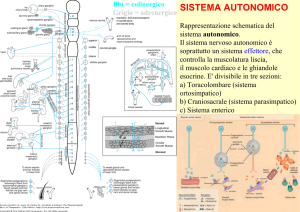
SISTEMA NERVOSO
• sistema nervoso centrale (SNC)
(encefalo e midollo spinale)
• sistema nervoso periferico (SNP)
(nervi cranici, nervi spinali e gangli)
• sistema nervoso somatico
– somatomotore (porzione efferente - nervi motori)
– somatosensoriale (porzione afferente - nervi sensitivi)
• sistema nervoso autonomo (SNA)
– simpatico
– parasimpatico
– enterico
Sistema nervoso autonomo (SNA)
Il sistema nervoso
autonomo (SNA) è
costituito dal sistema:
• simpatico
• parasimpatico
• enterico
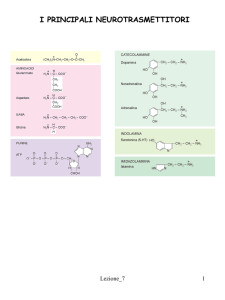
Neurotrasmettitori del sistema nervoso
periferico efferente e loro localizzazione
OH
HO
NH2
HO
NA
O
N+
O
ACh
Farmaci attivi sulla
neurotrasmissione colinergica
NEUROTRASMISSIONE COLINERGICA
• Il neurotrasmettitore è l’acetilcolina (ACh)
O
O
N+
• essa è rilasciata:
• SNA
– neuroni pre-gangliari simpatici e parasimpatici
– neuroni post-gangliari parasimpatici (alcuni simpatici – ghiandole sudoripare e
salivari)
• placche motrici del muscolo scheletrico
• SNC (corteccia cerebrale, corpo striato, ippocampo)
Biosintesi e degradazione dell’ACh
NEL FEGATO
HO
Serina
Decarbossilasi
CO2 H
Colina N-metiltransferasi
HO
NH2
Serina
- CO2
NH 2
S-adenosilmetionina
Etanolammina
HO
N+
Colina
NEL CITOPLASMA DEI NEURONI COLINERGICI
Colina Acetiltransferasi (ChAT)
HO
O
N+
N+
Acetil-S-CoA
Colina
O
Acetilcolina (ACh)
NELLA FESSURA SINAPTICA
Acetilcolinesterasi
(AChE)
O
N+
O
HO
N+
+
OH
O
Acetilcolina (ACh)
Colina
Ac. acetico
Schema generale di una giunzione colinergica
O
OH
N+
2 Cl-
N+
HO
EMICOLINIO CLORURO
HO
N
VESAMICOLO
O
Farmaci attivi sul sistema colinergico
•
•
F. ad azione diretta (sui recettori colinergici)
agonista
antagonista
F. ad azione indiretta:
agiscono su
biosintesi (R-colina alfoscerato)
captazione (emicolinio)
immagazzinamento (vesamicolo)
rilascio (neurotossina botulinica)
idrolisi (AChEI)
F. ad azione indiretta
OH
O-
• Precursore della colina per
la biosintesi della ACh
HO
O
O
N+
P
O
R-COLINA ALFOSCERATO
(Brezal, Delecit)
O
OH
N+
2 Cl-
• blocco captazione
N+
HO
EMICOLINIO CLORURO
HO
• blocco immagazzinamento
N
VESAMICOLO
• blocco rilascio
TOSSINA BOTULINICA
• blocco idrolisi
INIBITORI DELLA AChE
O
Farmaci ad azione diretta
I recettori colinergici
• Recettori nicotinici
H
N
N
S (-) Nicotina
Nicotiana tabacum
• Recettori muscarinici
Dale, Sir Henry
The Nobel Prize in
Physiology or Medicine 1936
HO
3
4
5
2
1
O
N+
Cl -
2S,4R,5S (+) Muscarina cloruro
Amanita muscaria
Recettori colinergici
Recettori nicotinici
Torpedo californica
Electrophorus electricus
Recettore nicotinico (RN)
O-
O
OO
N
H
N
H
O
Leu
N
H
O
Asp
O
Glu
Siti di legame della ACh
Sottotipi dei RN
denominazione
NM
NN
NSNC
tipologia
localizzazione
antagonisti
(1)21de
•tubocurarina
giunzione
•succinilcolina
neuromuscolare
•decametonio
(3)24
sinapsi gangliari
(principalmente
post-sinaptici)
(4)2 (2)3
(7)5
SNC (in molte
regioni)
•esametonio
•dimetil-4fenilpiperazina
(DMPP)
agonisti
feniltrimetilammono
Impieghi terapeutici dei farmaci che
agiscono sui rec. nicotinici
Possono avere un’azione agonista o antagonista
ed agire a livello
– placca neuromuscolare
• miastenia grave
• bloccanti neuromuscolari (chirurgia)
– gangli SNA
• ganglioplegici
Recettori muscarinici (RM)
• Mediano l’effetto della ACh a livello
– sinapsi parasimpatiche postgangliari
– varie aree del SNC
• Appartengono a un gruppo di recettori
accoppiati a proteine G [recettori
metabotropici o GPCRs (G-Protein-CoupledReceptors)]
RECETTORI METABOTROPICI
Recettori accoppiati alle proteine G
O
HN
O
O
O H2N
N
N
N
O
-
O
P
O
O-
P
O
O-
P
O
OOH
GTP = guanina
OH
O
HN
O
O H2N
N
N
N
O
-
O
P
O-
O
P
O
OOH
OH
GDP = guanosina difosf ato
RECETTORI METABOTROPICI
Recettori accoppiati alle proteine G (GPCR)
Proteine G trasduttrici e secondo
messaggero associato
Famiglia di proteine G
trasduttrici
Sistema di secondo
messaggero
Gs
Incrementa l’attività della
adenilato ciclasi (AC)
Gi
Inibisce l’attività della AC
Gq
Stimola l’attività della
fosfolipasi C
G12
Modula lo scambio
sodio/idrogeno
O
O
O
O
-O
P
O
P
O-
O
P
O-
Adenina
O
O
AC
O-
O
adenilato ciclasi
P
O
ATP
OH
Adenina
OH
OH
O
AMP ciclico
NH 2
Adenina =
N
N
N
H
N
O
O
O O
O
O O
P
OH
P
PLC
OH
OH
Attiva la
pr oteino-chinasi C
O
Diacilglicerolo
(DAG)
Fosfolipasi C
OH
P
P
P
Fosfatidilinositolo
4,5-bifosfato
(PIP2 )
OH
OH
OH
P
P = PO4
--
Inositolo 1,4,5trifosfato
(IP 3)
apr e i canali
del Ca++
Famiglia dei RM
Localizzazione dei RM
• I tre tipi principali (M1, M2, M3) sono detti:
– M1 “neuronali”:
• SNC (corteccia cerebrale, ippocampo, striato)
• ghiandole esocrine (secrezione)
– M2 “cardiaci” :
• cuore (atri) (riduzione forza di contrazione e frequenza)
• muscolo liscio gastrointestinale (contrazione muscolatura)
• SNC
– M3 “ghiandolari”:
• ghiandole esocrine
• musc. liscia tratto G.I. e vescicale e muscoli oculari ciliare e dell’iride (miosi)
– M4
– M5
SNC (vie striatali e nucleo basale cerebrale)
SNC (determina il rilascio di dopamina nel SNC)
Effetti della stimolazione dei RM
• Muscolatura liscia
– tratto gastro-intestinale e vescicale (stimolaz. contrazione)
– tratto urinario (rilascio sfinteri)
– occhio (contrazione muscolo ciliare e miosi)
• Cuore
– diminuzione frequenza (cronotropo -) e della forza
contrazione atriale (inotropo -)
• Ghiandole esocrine
– salivari, lacrimali, gastriche (aumento secrezione)
Impieghi terapeutici dei farmaci
colinomimetici muscarinici
• Per ripristinare tono muscolatura liscia tratto
gastro-intestinale dopo intervento chirurgico
• Facilitare svuotamento vescica
• Glaucoma, per diminuire pressione
intraoculare
Impieghi terapeutici dei
farmaci anti-muscarinici
– Spasmolitici del tratto gastro-intestinale ed
urinario
– Antisecretori gastrici
– Midriatici
– Morbo di Parkinson e nella prevenzione delle
cinetosi (scopolamina)
– Prevenzione effetti vagali sul cuore (bradicardia,
inotropia negativa)
Agenti colinomimetici
O
O
N+
• L’ACh è un agente terapeutico insoddisfacente:
– non è selettiva
– è scarsamente assorbita attraverso le membrane
– è chimicamente ed enzimaticamente LABILE
HO
H
N
N
3
4
5
1
O
S (-) Nicotina
Nicotiana tabacum
2
N+
Cl-
2S,4R,5S (+) Muscarina cloruro
Amanita muscaria
Agenti colinomimetici
O
O
N+
• L’ACh è un agente terapeutico insoddisfacente:
– non è selettiva
– è scarsamente assorbita attraverso le membrane
– è chimicamente ed enzimaticamente LABILE
HO
H
N
N
3
4
5
1
O
S (-) Nicotina
Nicotiana tabacum
2
N+
Cl-
2S,4R,5S (+) Muscarina cloruro
Amanita muscaria
Richiami di stereochimica
Stereoisomeri sono isomeri di identica costituzione chimica che
differiscono per la disposizione nello spazio degli atomi che li
compongono
Gli stereoisomeri possono essere distinti in base a criteri di:
• simmetria
– enantiomeri
– diasteroisomeri
• interconvertibilità
criteri di interconvertibilità
C asimmetrico
(C-sp3 con 4 sostituenti
diversi)
H
H2N
CH 3
H 3C
H
CO 2H
H2 N
CO 2H
L-(+)-Alanina
(S)-Alanina
D-(-)-Alanina
(R)-Alanina
CH3
isomeri geometrici
H3 C
trans-2-butene
(E)-2-butene
H3 C
CH3
cis-2-butene
(Z)-2-butene
criteri di interconvertibilità
rotazione attorno a legami s
Aa
Be
Ae
A
B
Ba
Isomeri conformazionali
(proiezioni di Newman)
B
H
H
H
H
H
H
H
H
H
A
H
Sfalsata
B
H
A
H
H
H
Antiperiplanare
Sinclinale
= 60 °
= 180 °
H3C
CH3
AH2C
H
CH2B
H
H
H
B
H
H
Eclissata
A
H
H
B
H
H
Sinperiplanare
=0°
H
H
H
H
A
Anticlinale
= 120 °
Conformazione farmacofora della ACh
O
1
O
2
N+(CH3)3
2
CH2
AcO
3
CH2
N+
Conformazione della ACh
O
1
O
3
N+
2
Conformazione della ACh favorita
TERMODINAMICAMENTE
•raggi X
•studi NMR
•calcoli di orbitali molecolari
N+Me 3
OAc
H
H
H
H
Sinclinale
(+77-84°)
Conformazione farmacofora
della ACh al recettore Muscarinico
N+Me 3
AcO
H
N +Me3 I-
OAc
H
H 2C
(1R,2S)-(+)cis-2-acetossiciclopropil-1-trimetilammonio ioduro
H
H
Sinclinale
N+Me3
H
H
AcO
N +Me3 IH
(1S,2S)-(+)tr ans-ACTM
H 2C
H
OAc
Anticlinale
(137°)
Conformazione farmacofora della
ACh al recettore Muscarinico (M1)
Studi modellistica molecolare
Conformero della
ACh al RM
(anti-clinale
2110-117°)
Modello d’interazione della ACh
con il recettore M1
H
N
O
O
O
H
O
Asp 105
O
O-
N+
O
H
O
N
H
O
Tyr 381
NH
Thr 189
Conformazione farmacofora della
ACh al recettore Nicotinico
Studi NMR
Conformero della
ACh in soluzione
(sin-clinale)
Conformero della
ACh al RN
(anti-clinale)
2 ≤ 150°
OAc
4,4 A
OAc
5,9 A
N+
N+
Recettore Muscarinico
Recettore Nicotinico
Relazioni attività-struttura (SAR)
per gli agenti colinergici
gruppo
acilossi
gruppo
ammonico
quaternario
O
O
gruppo
etilenico
N+
Modificazioni al gruppo
ammonico quaternario
• Sostituzione del N
R
P+
R
As+
R
S+
– con As, P, S -> minore attività
solfonio
arsonio
fosfonio
• Sostituenti all’azoto (CH3):
– tutti e tre più grandi
-> inattivi
R1
R
N+
R2
R3
– sostit. di un solo metile con
gruppi via via più grandi
-> diminuz. attività
R1
R
N+
CH3
CH3
– sostit. progressiva dei metili
con H
-> graduale diminuz. attività
CH3
R
N
R
CH3
NH
R
CH3
NH2
Modificazione del ponte etilenico
• Regola di ING: max potenza muscarinica se tra N e H
terminale vi sono 5 atomi
O
H
N+
H
4
5
2
O
1
3
H
HO
H
4
H
5
3
2
1
O
H
Muscarina
N+
Cl-
Introduzione di sostituenti
sul ponte etilenco
• Metile in : inattivo su
RM, poco attivo su RN
(non in uso)
• Metile in
(metacolina): agonista
muscarinico selettivo
O
O
N+
O
O
N+
Stereochimica della metacolina
• S (+)
– equipotente ACh (RM)
– idrolizzata da AChE a ½
velocità
• R (-)
– 1/20 potenza ACh (RM)
– non idrolizzata da AChE
(debole inibitore competitivo)
HO
O
3
4
5
N+
O
O
N+
O
1
O
2
N+
Cl-
2S,4R,5S (+) Muscarina cloruro
Amanita muscaria
Modificazioni del gruppo acilossi
• Esteri alifatici omologhi superiori sono meno potenti
ACh
• Esteri aromatici sono antagonisti
• Esteri carbammici (carbammati): più stabili all’idrolisi
O
O
N+
H2 N
O
Car bacolo
N+
H2 N
O
Betanecolo
Derivati eterei e chetonici
O
N+
O
HO
N+
O
Muscarina
N+
SAR per agonisti muscarinici
• Atomo di N in grado di portare una carica positiva
(preferibilmente un sale ammonico IV)
• Sostituenti alchilici all’azoto non più grandi del
metile
• Gruppo metilico in
• Atomo di ossigeno di tipo estereo in grado di
partecipare a legami idrogeno
• Spaziatore di due atomi di C tra N e O
Eccezioni alla SAR
N
O
N
O
PILOCARPINA
Pilocarpus jabor andi
Glaucoma
Colinomimetici indiretti
Inibitori della Acetilcolinesterasi (AChEI)
O
N+
O
AChE
+
O
N+
+
H2O
OH
HO
Acetilcolinesterasi (AChE)
E
+
k1
ACh
E-ACh
k -1
k2
k3
E-A
+
H2O
Colina
OH
O
N+
AChE-Ser-OH
E
O
O
O
N+
Ser-AChE
O
k2
k3
OH
H2O
AChE-Ser-O-CO-CH3
HO
N+
CH3COOH
Siti di legame della ACh sulla AChE
Sito esterasico
(catalitico)
Sito anionico
(riconoscimento)
NH
N
H
O
• Sito anionico: residuo di triptofano84
O
Idrolisi di un estere
OH
+
R
OR'
O-
O
+
R
H2O
R
+
H 2O
R
OH
OR'
R
OR'
+
OH2
R'OH
O
OH
OH
+
OR'
OH +
R
OH
+
R'O-
R
R'OH
O
CATALISI BASICA
O-
O
+
R
OH-
R
O-
OH
OR'
+
OR'
R
OH
+
R'O-
O
R
R'OH
O
CATALISI ACIDA
OH+
OH
+
R
H2 O
R
OH
OR'
OR'
+
OH2
R
OH
OH
+
OR'
H+
OH
R
OH+
+
R'OH
R
O
R'OH
Triade catalitica del sito esterasico
O
OH
N
OH
NH
HN
HN
HN
O
Glu
O
His
O
Ser
Meccanismo di idrolisi della ACh
catalizzato dalla AChE
Sito esterasico
‘buco ossianionico’
sito esterasico
ACh
triade catalitica
ACh
catalisi basica/acida
intermedio tetraedrico
collasso dell’intermedio tetraedrico
enzima acetilato
idrolisi dell’enzima
Inibitori della AChE (AChEI)
• Inibitori reversibili
• Inibitori competitivi
non-carbamoilanti
O
O
N+
H2N
• alchilcarbammati
N+
O
H2N
Carbacolo
O
Betanecolo
• (carbacolo e betanecolo)
• Inibitori competitivi
carbamoilanti
O
R''
R'HN
• arilcarbammati
O
ar ilcar bammato
• (fisostigmina, neostigmina, piridostigmina)
• Inibitori irreversibili
RO
Y
P
• derivati del fosforo
RO
X
Y = O, S
X = gruppo uscente
Inibitori della AChE (AChEI)
Inibitori reversibili
sito esterasico
sito anionico
Inibitori della AChE (AChEI)
O
N
O
O
N+
Br-
NEOSTIGMINA
Bromuro
N
O
N+
Br -
PIRIDOSTIGMINA
Bromuro
Inibitori della AChE utilizzati nel
morbo di Alzheimer
NH 2
N
N
MeO
O
N
O
N
MeO
Tacrina
O
Donezepil
(Aricept, Memac)
Rivastigmina
(Exelon, Prometax)
Inibitori irreversibili della AChE
(esteri fosforici)
RO
Y
P
Y = O, S
X = gruppo uscente
X
RO
antidot o
O
O
P
N+
I-
O
N
OH
PAM
Pralidossima
metil ioduro
N+(CH3)3IF
O
O
P
S
O
ISOFLUOROFATO
IODURO DI
ECOTIOFATO
Principali usi clinici dei
colinomimetici indiretti
• Ridare forza al muscolo nella miastenia gravis
• Nel glaucoma ad angolo aperto, per diminuire la pressione
intraoculare attraverso la stimolazione della contrazione del
muscolo ciliare e dello sfintere dell’iride; ciò facilita il deflusso
del humor aqueous nel canale di Schlemm.
• Trattamento sintomatico del morbo di Alzheimer e di altri
disordini cognitivi, condizioni caratterizzate da una deficienza
colinergica nel nucleo basale e in zone subcorticali.
Agonisti colinergici
Indiretti
(inibitori della
AChE)
Diretti
(sul recettore
muscarinico)
Metacolina
Carbacolo
Metanecolo
Pilocarpina
Inibitori
reversibili
Inibitori
irreversibili
Fisostigmina
Neostigmina
Piridostigmina
Isofluorofato
Ioduro di ecotiofato
Agonisti colinergici
Diretti
(sul recettore
muscarinico)
Indiretti
(inibitori della AChE)
Inibitori
reversibili
Metacolina
Carbacolo
Metanecolo
Pilocarpina
Fisostigmina
Neostigmina
Piridostigmina
Rivastigmina
Inibitori
irreversibili
Inibitori
non-classici
Isofluorofato
Ioduro di ecotiofato
Tacrina
Donezepil
Antagonisti muscarinici
• Sono antagonisti competitivi reversibili
Effetti farmacologici
Usi terapeutici
•diminuita contrattilità della muscolatura
liscia gastrointestinale e del tratto
urinario
•spasmolitici del tratto gastro-intestinale
ed urinario
•ridotta secrezione gastrica e salivare
•antisecretori gastrici
•dilatazione della pupilla
•midriatici
•effetti sul SNC
•Morbo di Parkinson e prevenzione delle
cinetosi (scopolamina)
•effetti sul cuore
•prevenzione effetti vagali sul cuore, quali
bradicardia e inotropia negativa
Alcaloidi del tropano
• Si ritrovano in piante della famiglia delle Solanaceae
ed in particolare
– Atropa belladonna (foglie, radici, semi)
– Datura stramonium (foglie, fiori, semi)
– Hyoscyamus niger (foglie)
8N
TROPANO
8-metil-8-azabiciclo[3.2.1]ottano
2
1
4
5
7
6
3
Strutture base derivate dal tropano
N
N
H
OH
OH
H
TROPINA
PSEUDOTROPINA
COOH
N
N
H
OH
O
OH
SCOPINA
H
ECGONINA
H
Alcaloidi naturali
esteri dell’acido tropico
Derivati della tropina
N
OH
H
Derivati della scopina
N
H
HO2 C
*
ACIDO (S)-TROPICO
[acido (S)--idrossimetilfenilacetico]
OH
O
O
*
O
(+-)-ATROPINA
S (-)-IOSCIAMINA
OH
O
O
S (-)-IOSCINA o
SCOPOLAMINA
– Atropa belladonna (foglie (0.4%), radici (0.5%), semi (0.8%)
principalmente Iosciamina)
– Datura stramonium (foglie (0.2-0.5%), fiori e semi (0.2-0.5%)
principalmente Iosciamina)
– Hyoscyamus niger (foglie (0.08%) Iosciamina e Scopolamina in
parti circa uguali)
Sintesi atropina
COOH
O
CHO
+
+
NH2 CH3
pH = 5, t. amb.
(Mannich)
COOH
N
- 2 CO2
CHO
N
COOH O
COOH
acido acetondicarbossilico
O
acido tropinon2,4-dicarbossilico
COOH + 2 MeMgBr
COOMgBr
MgBr
N
LiAlH 4
OH
tropina
tropinone
Ac2O/base
1) CH2O
COOH
2) H2O
OH
acido tropico
SOCl2
COOH
OAc
COCl
OAc
1) tropina
2) idrolisi blanda
N
H
O
O
ATROPINA
OH
Usi terapeutici dell’atropina
e della scopolamina
• Atropina solfato
N
OH
H
– midriatico e cicloplegico
– antisecretore
O
*
O
• Scopolamina bromidrato
– anti-cinetosi
– trattamento effetti
extrapiramidali degli
antipsicotici
– anti-Parkinson
N
H
O
O
O
OH
Derivati semisintetici
N+
N
H
O
H
OH
O
*
OMATROPINA
BrOH
H
OH
*
OMATROPINA
O
METIL BROMURO
O
N+
Br-
N+
BrH
OH
O
O
*
O
SCOPOLAMINA BUTIL
BROMURO (BUSCOPAN)
O
O
IPRATROPIO BROMURO
(Atem, Rinovagos)
Studi SAR sull’Atropina
N CH 3
N+
O
O
ATROPINA
OH
O
ACh
O
Farmacoforo di un
antagonista muscarinico
R1
N
H
N
(CH2 )n
X
OH
O
R2
O
R3
ATROPINA
1.
R1 e R2 gruppi carbociclici o eterociclici, di cui almeno uno aromatico
2.
R3 possibilmente un ossidrile o idrossimetile
3.
X un gruppo estereo o etereo
4.
ponte metilenico da due a quattro C
5.
N sale ammonico quaternario o ammina terziaria basica
Esteri aminoalcolici anticolinergici
BrN+
O
O
N+
BrO
HO
O
O
CLIDINIO BROMURO (Li b r ax )
PROPANTELINA BROMURO (Lexil)
N
O
O
O
FLAVOXATO
(Ge n ur i n )
O
Sintesi clidinio bromuro
Amminoalcoli ed amminoeteri
HO
HO
N
N
PROCICLIDINA
(Kemadrin)
N
O
ORFENADRINA
(Disipal)
TRIESIFENIDILE
(Artane)
Connessione neuronale tra lo striato e
la sostanza nera e morbo di Parkinson
Sintesi prociclidina
Antagonisti ai recettori nicotinici
Recettori muscolari o N1
Recettori neuronali o N2
O
N
N
N
Agonisti nicotinici diretti
OH
N+
N
Nicotina
Lobelina
(Lobeli a inf lat a)
Dimetilfenilpiperazinio
(DMPP)
Antagonisti ai recettori nicotinici
• Ganglioplegici (N2)
N+Me3
Me3+N
Esametonio
• Bloccanti neuromuscolari (N1)
Bloccanti neuromuscolari
– depolarizzanti
(leptocurari)
N+Me3
Me3+N
Decametonio
O
Me3
+N
O
O
O
– non-depolarizzanti
(pachicurari)
• Teraidroisochinolinico
– Tubocurarina
– Atracuronio
• Steroidi
– Pancuronio
– Vecuronio
Succinilcolina
N+Me3
Bloccanti neuromuscolari non-depolarizzanti
a struttura tetraidroisochinolinica
O
N+
HO
O
O
O
N
OH
O
N
O
d-TUBOCURARINA cloruro
(Chondod endron t omentosum )
O
Papaverina
O
Bloccanti neuromuscolari non-depolarizzanti
a struttura tetraidroisochinolinica
O
H3CO
H3CO
N
+
OCH3
O
O
O
OCH3
H3CO
OCH3
H3CO
SO3-
2
ATRACURIO BESILATO
N+
OCH3
Sintesi atracurio besilato
COCl
2
+
HO
acriloil
cloruro
OH
O
O
O
pentan-1,5-diolo
O
H3CO
2
SO3Me
NH
H3CO
H3CO
O
OCH3
H3CO
O
OCH3
benzensolfonato
di metile
OCH3
tetraidro papaverina
OCH3
H3CO
H3CO
2
*
N
2
OCH3
N+
O
C
O
OCH3
O
C
O
H3CO
OCH3
H3CO
SO3
-
2
ATRACURIO BESILATO
N+
OCH3
Bloccanti neuromuscolari a
struttura steroidica
OAc
Br-
N+
N+
Br-
AcO
PANCURONIO bromuro
OAc
Br-
N+
N
AcO
VECURONIO
Sintesi pancuronio bromuro
CO3H
OAc
O
AcO
OAc
O
Cl
isopropenil
acetato
ac. m-cloroperbenzoico
O
HgSO4
androst2-en-17-one
OH
O
NH
N
N
NaBH4
N
N
HO
HO
OAc
Ac2O/piridina
N
AcO
OAc
N
CH3Br
N+
N+
AcO
PANCURONIO
BROMURO