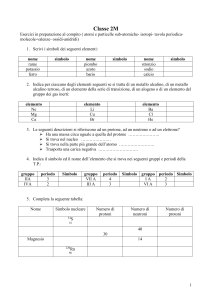
Capitolo 1
Dalla massa
degli atomi alla
mole
Copyright © 2012 Zanichelli editore
1.1 Gli atomi possono essere “pesati” per
confronto reciproco
1.2 Il carbonio-12 è l'isotopo di riferimento
delle masse atomiche relative
1.3 Le misurazioni su larga scala permettono
di contare oggetti molto piccoli
1.4 La mole è il collegamento tra massa e
numero di atomi o molecole
If we know how much one piece of candy
weighs, we can count large numbers of them
by weighing them on a scale. We just
multiply the weight of one piece by the total
number we want, so we know how much
they must weigh altogether. We use a similar
concept in chemistry when we measure large
numbers of atoms and molecules for use in
experiments, as you learn in this chapter.
1.1 GLI ATOMI POSSONO ESSERE PESATI PER CONFRONTO
RECIPROCO
La materia ha una massa ed è formata da atomi, consegue
che gli atomi hanno una loro massa.
Come possiamo, però, misurare le masse degli atomi?
I singoli atomi sono troppo piccoli per poter essere pesati con
i metodi che conosciamo.
Possiamo tuttavia determinare le masse relative degli atomi
degli elementi purché si conosca il rapporto in cui questi
sono presenti in un composto. Vediamo un esempio.
L’idrogeno (H) si combina con l’elemento fluoro (F) per
formare il composto fluoruro di idrogeno. Ciascuna molecola
del composto è costituita da un atomo di idrogeno
e uno di fluoro; ne consegue che un qualsiasi campione di
questa sostanza presenta sempre un rapporto di 1 a 1 tra il
numero di atomi di fluoro e di idrogeno.
Copyright © 2012 Zanichelli editore
1.1 GLI ATOMI POSSONO ESSERE PESATI PER CONFRONTO
RECIPROCO
Copyright © 2012 Zanichelli editore
Sappiamo anche che quando un campione di fluoruro di
idrogeno si decompone, la massa del fluoro ottenuta è sempre
19,0 volte più grande di quella dell’idrogeno, per cui il
rapporto di massa tra fluoro e idrogeno è sempre 19,0 a
1,00.
Come può un rapporto 1 a 1 tra atomi dare un rapporto di
massa di 19,0 a 1,00? Ciò avviene solo se ogni atomo di
fluoro è 19,0 volte più pesante di ogni atomo di
idrogeno.
Osserviamo che, pur non avendo determinato le masse in
grammi degli atomi di F e H, sappiamo qual è il loro rapporto
reciproco (cioè conosciamo le loro masse relative).
Attraverso procedimenti simili, condotti su altri composti,
siamo in grado di determinare le masse relative degli altri
elementi.
1.2 IL CARBONIO-12 È L'ISOTOPO DI RIFERIMENTO PER LE
MASSEATOMICHE RELATIVE
Si rende a questo punto necessario che le masse relative
siano espresse nella stessa scala.
Quasi tutti gli elementi si trovano in natura sotto forma di
miscele uniformi di due o più tipi di atomi, di massa
leggermente diversa, che chiamiamo isotopi dell’elemento.
Un chiodo di ferro, per esempio, è formato da una miscela di
quattro isotopi del ferro, mentre il cloro presente nel sale è
una miscela di due isotopi dell’elemento.
Occorre pertanto sceglierne uno in particolare che assolva alla
funzione di massa di riferimento, cioè di massa unitaria, con
cui confrontare quella di tutti gli altri.
Copyright © 2012 Zanichelli editore
1.2 IL CARBONIO-12 È L'ISOTOPO DI RIFERIMENTO PER LE
MASSEATOMICHE RELATIVE
Oggigiorno, il riferimento universalmente riconosciuto è
l’isotopo più abbondante del carbonio, noto come carbonio12, il cui simbolo è C. Per definizione, un atomo di
questo isotopo ha esattamente la massa di 12 unità di
massa atomica (o Dalton), unità simboleggiata con u.
Definendo che 12 u è la massa di un atomo di C, possiamo
affermare che l’unità di massa atomica è pari a 1/12 della
massa di un singolo atomo di carbonio-12.
Quindi:
1 atomo di
C possiede una massa di 12 u (esatte)
1 u è uguale (esattamente) a 1/12 della massa di 1 atomo di
C
12
12
12
12
Copyright © 2012 Zanichelli editore
La massa atomica relativa (MA) di un elemento è la massa media
degli atomi dell’elemento (secondo la loro distribuzione in natura)
rispetto all’atomo di carbonio-12, cui è attribuita una massa di 12
unità.
1.2 IL CARBONIO-12 È L'ISOTOPO DI RIFERIMENTO PER LE
MASSEATOMICHE RELATIVE
►PER CALCOLARE LA MASSA ATOMICA DI UN ELEMENTO
OCCORRE RIFERIRSI A UN ATOMO MEDIO
I chimici hanno generalmente a che fare con miscele di isotopi di un
certo elemento provenienti da fonti naturali; poiché la composizione
delle miscele isotopiche è praticamente costante, indipendentemente
dalla fonte, possiamo parlare di atomo medio di un elemento,
facendo riferimento alla massa media della miscela isotopica
naturale.
Per esempio, l’idrogeno naturale è una miscela di due isotopi
L’«atomo medio» dell’elemento idrogeno, secondo la sua
distribuzione in natura, possiede una massa che è 0,083 992 volte
quella dell’atomo di C. Poiché 0,083 992 x 12,000 u = 1,0079 u, la
massa atomica media dell’idrogeno è 1,0079 u.
12
Copyright © 2012 Zanichelli editore
1.2 IL CARBONIO-12 È L'ISOTOPO DI RIFERIMENTO PER LE
MASSEATOMICHE RELATIVE
►PER CALCOLARE LA MASSA ATOMICA DI UN ELEMENTO
OCCORRE RIFERIRSI A UN ATOMO MEDIO
Osserviamo che questo valore medio è appena più grande della
massa atomica di 1H perché l’idrogeno in natura contiene anche una
piccola frazione di 2H. In generale, il numero di massa di un isotopo
è leggermente diverso dalla sua massa, perché il primo è sempre un
numero intero, mentre la massa atomica relativa è calcolata in
rapporto a u.
Generalizzando, si trova la seguente espressione per il calcolo delle
masse atomiche medie basate sulle abbondanze relative di ciascun
isotopo:
Copyright © 2012 Zanichelli editore
1.3 LE MISURAZIONI SU LARGA SCALA PERMETTONO DI
CONTARE OGGETTI MOLTO PICCOLI
Contare una manciata di monete è facile. Ma come contare le monete
contenute in un grande salvadanaio o, peggio, in una banca?
Quanto maggiore è il numero di monete da contare, tanto più
laborioso diviene il conteggio diretto.
La conoscenza della massa delle monete ci permette di ottenere una
stima ragionevole del loro numero.
Per contare tante monete si può ricorrere a un metodo indiretto,
pesandole tutte e dividendo per la massa di una moneta.
Copyright © 2012 Zanichelli editore
1.3 LE MISURAZIONI SU LARGA SCALA PERMETTONO DI
CONTARE OGGETTI MOLTO PICCOLI
Con lo stesso procedimento, possiamo calcolare il numero di molecole
presenti in un campione di un certo composto; in questo caso,
impiegheremo la massa molecolare al posto della massa atomica.
La massa molecolare è la somma delle masse atomiche degli
atomi presenti nellaformula del composto.
Copyright © 2012 Zanichelli editore
Teniamo presente che i composti ionici sono costituiti da ioni, non da
molecole, perciò non è appropriato parlare di «massa molecolare»; in
tali casi, è preferibile usare il termine massa formula. La massa
formula si calcola esattamente come la massa molecolare:è la somma
delle masse degli atomi che compaiono nella formula.
1.4 LA MOLE È IL COLLEGAMENTO TRA LA MASSA E IL NUMERO
DI ATOMI O MOLECOLE
Per collegare le misurazioni effettuate con gli atomi e le molecole
finora abbiamo utilizzato le unità di massa atomica. Per rendere il
calcolo più semplice e immediato i chimici hanno introdotto un’unità di
misura, detta mole (simbolo mol), che nel SI è definita in questo
modo:
una mole di una qualsiasi sostanza contiene un numero di unità
formula pari al numero di atomi contenuti in 12 g esatti di carbonio12.
Abbiamo definito l’unità di massa atomica come un dodicesimo esatto
della massa di un atomo di carbonio-12. La definizione di mole è
quindi strettamente collegata a quella di unità di massa atomica. Di
conseguenza, possiamo dire che una mole di sostanza ha una massa
in grammi numericamente pari alla sua massa formula.
Copyright © 2012 Zanichelli editore
La massa di una mole di sostanza è chiamata massa molare
(simbolo) MM.
1.4 LA MOLE È IL COLLEGAMENTO TRA LA MASSA E IL NUMERO
DI ATOMI O MOLECOLE
Poiché sostanze diverse hanno massa formula differente, la massa di
una mole varia da una sostanza all’altra.
Una mole di qualsiasi sostanza contiene lo stesso numero di unità
formula (circa 6,02 X 1023). Tale numero è detto costante di
Avogadro.
Copyright © 2012 Zanichelli editore
Una mole di sostanze diverse contiene lo stesso numero di particelle
ma diverso peso perchè ogni singola particella pesa in modo diverso
dall'altra!
10 banchi e 10 sedie pur avendo quantità uguali hanno pesi
complessivi differenti, pesi che sono multipli del numero dei singoli
oggetti.
Allo stesso modo 6,02 X 1023molecole di acqua (H2O massa
molecolare di 18,016 u) pesano di meno che 6,02 X 1023 molecole di
cloruro di sodio (NaCl massa molecolare di 58,44 u)
1.4 LA MOLE È IL COLLEGAMENTO TRA LA MASSA E IL NUMERO
DI ATOMI O MOLECOLE
La costante di Avogadro o numero di Avogadro (simbolo N) è un
numero incredibilmente grande.
Per esempio, 6,02 x 1023 granelli di sabbia coprirebbero la superficie
dell’intera Italia con uno strato dello spessore di 35 m. Gli atomi e le
molecole sono invece talmente piccoli che un numero di Avogadro di
queste particelle sta nel palmo di una mano
Copyright © 2012 Zanichelli editore
1.4 LA MOLE È IL COLLEGAMENTO TRA LA MASSA E IL NUMERO
DI ATOMI O MOLECOLE
Quando consideriamo una mole di qualcosa, è sempre importante
identificarne con precisione la natura. Per esempio, l’espressione «una
mole di ossigeno» è ambigua: potrebbe significare sia una mole di
atomi di ossigeno sia una mole di molecole. Per evitare tale ambiguità
associamo generalmente una formula chimica all’unità mol. Se
scriviamo «1 mol di O» (o «1 mol O») ci riferiamo a «una mole di
atomi di ossigeno», mentre se scriviamo «1 mol di O » (o «1 mol O »)
ci riferiamo a «una mole di molecole di ossigeno».
Massa, massa molare e moli sono in stretta relazione tra loro e
permettono di eseguire varie tipologie di esercizi e di calcoli. La
relazione che lega le tre grandezze è:
2
2
Copyright © 2012 Zanichelli editore
1.4 LA MOLE È IL COLLEGAMENTO TRA LA MASSA E IL NUMERO
DI ATOMI O MOLECOLE
►CONVERSIONE DELLE MOLI IN NUMERO DI MOLECOLE
ATTRAVERSO LA COSTANTE DI AVOGADRO
Talvolta è necessario conoscere il numero di particelle (atomi o
molecole) contenute in un campione. Come abbiamo visto, una mole
di qualsiasi sostanza contiene un numero di Avogadro di particelle di
quella sostanza. La costante di Avogadro collega le moli agli atomi o
alle molecole e ci consente di passare più semplicemente dalla massa
agli atomi (o alle molecole) rispetto alle conversioni con le unità di
massa atomica viste nel paragrafo precedente.
Copyright © 2012 Zanichelli editore