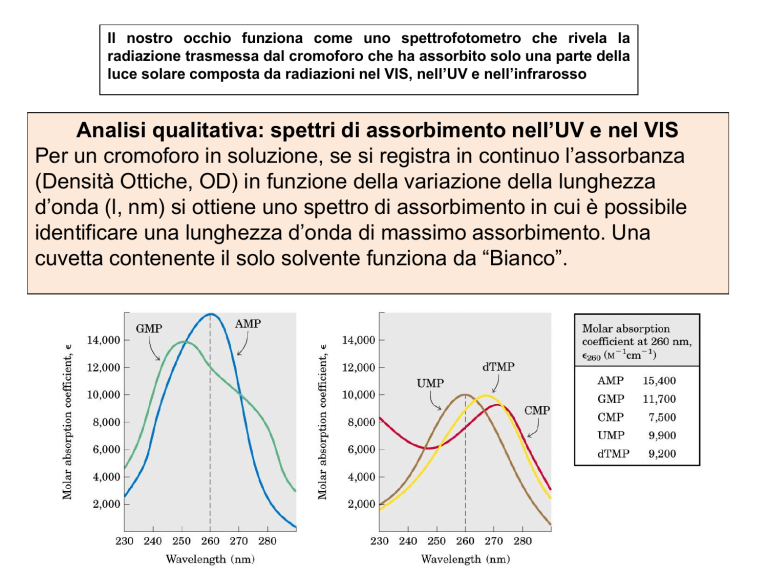
Il nostro occhio funziona come uno spettrofotometro che rivela la
radiazione trasmessa dal cromoforo che ha assorbito solo una parte della
luce solare composta da radiazioni nel VIS, nell’UV e nell’infrarosso
Analisi qualitativa: spettri di assorbimento nell’UV e nel VIS
Per un cromoforo in soluzione, se si registra in continuo l’assorbanza
(Densità Ottiche, OD) in funzione della variazione della lunghezza
d’onda (l, nm) si ottiene uno spettro di assorbimento in cui è possibile
identificare una lunghezza d’onda di massimo assorbimento. Una
cuvetta contenente il solo solvente funziona da “Bianco”.
Max assorbim. Amminoacidi arom.
e proteine con aromatici = 280 nm
Assorb legame peptidico= 220-230 nm
Max assorbim. Nucleotidi e ac. nucleici = 260 nm
I Esercitazione:
ESERCITAZIONE
Determinazione dello spettro di assorbimento di:
una soluzione in acqua di Albumina di Siero Bovino (BSA) da 240 a 320 nm
una soluzione in acqua di blu destrano da 400 a 800 nm
Operazioni da eseguire: 1-Selezionare allo spettrofotometro l’intervallo di lunghezze
d’onda (240 - 320 nm oppure 400 - 800 nm) da utilizzare;
2- trasferire il campione nella cuvetta (quarzo x uv e vis; plastica o vetro solo per vis)
3- sistemare la cuvetta nell’apparecchio;
4- avviare la registrazione;
5- stampare lo spettro
Determinazione del coefficiente
di estinzione
• Legge di Lambert-Beer:
• A=e x c x l
l= 1cm , lunghezza del
•
cammino ottico;
•
c=concentrazione del soluto;
• A= assorbimento della luce ad una lunghezza
d’onda opportuna x il campione in esame
• E= e=coefficiente di estinzione molare o
percentuale
ESERCITAZIONE
Calcolo della concentrazione della
soluzione di BSA sapendo che il
coefficiente di estinzione percentuale
(E%) a 280 nm è di 6,75 O.D.
OD = A
• Svolgimento:
• Legge di L.-B. : A= E% x c x l
• Il soluto in esame e’ la proteina albumina di siero bovino (BSA), di
cui non conosciamo la concentrazione in questa soluzione.
• Sappiamo, tuttavia, che E% a 280nm = 6.72 OD, cioe’ una
soluzione 1% di BSA, misurata a 25°C, nelle stesse condizioni di
pH e di [sale] di quella disponibile, a 280 nm ha un assorbimento =
6.72 OD.
• Nota: 1% = 1g di BSA / 100 ml di soluzione = 10mg/ml
• Applicando la legge di L.B.:
Assorbimento della sol. in esame(misurato a 280nm)=6.72 x c x 1cm
Da cui :
c = Assorbimento della sol. in esame(misurato) x 10mg/ml
6, 72
x
1cm
Il numero che si ottiene dal rapporto va moltiplicato per 10 per ottenere la
[BSA] per millilitro di soluzione
MEMO
• Il saggio di attivita’ misura la velocita’ della reazione enzimatica a
E e S costanti.
• La velocita’ si misura come [S] convertita in prodotto nell’unita’ di
tempo (D(delta)/minuto).
Nota: La curva di velocita’ si ottiene misurando ad ogni minuto la
quantita’ di substrato rimasta, seguendo la reazione per un certo
tempo (per esempio 10’-15’)
• L’Unita’ enzimatica /ml si calcola dividendo il D(delta)/minuto per il
volume della soluzione di enzima utilizzato nel saggio
• L’attivita’ specifica di un enzima e’ uguale al rapporto delle Unita’
(U)/ml sui mg/ml di proteine presenti nel campione contenente
l’enzima:
•
Att. Sp.= U/ml = U
•
mg/ml mg
DOMANDA
• Per controllare se , nel corso di una
purificazione, l’enzima in esame si sta
purificando (= liberando di proteine
contaminanti), fareste riferimento a
U/ml
oppure a
U/mg ??
Domanda
• Nella tabella successiva il Tris (tris idrossimetil amino
metano, con un gruppo amminico ionizzabile), e’
utilizzato per preparare il tampone in cui saggiare
l’attivita’ dell’enzima. Qual’e’ la funzione del HCl?
• A cosa serve la glicina? Perche’ e’ usata con il NaOH??
Schema dei saggi da eseguire
Tampone
Substrato Acqua
25 mM (a 1 ml) Enzi
ma
Tris-HCl 0,1 M, pH 7
500 ml
30 ml
470
5 ml
Tris-HCl 0,1 M, pH 8
500 ml
30 ml
470 ml
5 ml
Glicina-NaOH 0,1 M,
pH 9
500 ml
30 ml
470 ml
5 ml
Glicina-NaOH 0,1 M,
pH 10 500 ml
30 ml
470 ml
5 ml
Glicina-NaOH 0,1 M,
pH 12 500 ml
30 ml
470 ml
5 ml
ml
DA/
min
unità