Chimica ambientale
Rita Giovannetti
Dipendenza dal pH della solubilità di
PbS, CdS e HgS
Il mercurio, nonostante sia stabilmente legato ai
sedimenti come Hg++,
può essere convertito dai batteri anaerobi
presenti nel suolo in metilmercurio, (CH3)2Hg e
CH3HgX,
che,
deassorbendosi
particelle del sedimento,
rapidamente
dalle
si scioglie nella fase acquosa entrando, così,
nella catena alimentare.
Dipendenza dal pH della solubilità di
PbS, CdS e HgS
Sebbene i livelli di concentrazione del
metilmercurio in acqua possano risultare
estremamente bassi,
dell'ordine di 0,01 ppt,
nella carne di alcuni pesci, attraverso il
meccanismo di bioaccumulo, possono
arrivare a livelli di concentrazione dell'ordine
delle ppm,
con un fattore di biomagnificazione di 108.
Studio dei sedimenti
Uno studio sistematico dei sedimenti
può dare una testimonianza storica sulla
contaminazione di un sito
da parte delle varie sostanze in essi
rinvenute tal quali o trasformate in altre da
agenti chimici e/o biologici.
Fanghi che derivano dai processi di
depurazione delle acque reflue
Un altro sito di accumulo dei metalli pesanti
anche quando si tratta di liquidi derivanti dai
sistemi fognari municipali.
Spesso in questi fanghi vengono riscontrati
livelli di concentrazione, in metalli pesanti, fino a
migliaia di ppm!!
Questi fanghi, in passato, sono stati utilizzati
come fertilizzanti di suoli destinati a colture!!
PIOMBO
Numero
atomico
82
Peso
atomico
Densità
D4°20°
207,19 11,4
T. fus,
°C
327,5
T. eboll.
°C
1740
Il piombo allo stato elementare
sia perché viene più diffusamente impiegato che perché, a
Dei quattro metalli pesanti trattati, il piombo è
parte qualche eccezione, viene disperso nell'ambiente in
il
piùpressoché
abbondante
(0,0016%) come presenza
modo
incontrollato.
nell’ambiente.
L'entrata in vigore di disposizioni di Legge restrittive in
materia di impieghi del metallo hanno visto, recentemente,
una diminuzione sensibile della sua presenza nell'ambiente.
PIOMBO
Il piombo allo stato elementare
Grazie alla sua malleabilità, e la sua resistenza agli
agenti atmosferici
è stato usato per millenni nei campi più svariati:
utensili
foggiati
con di
questo
metallo
al 3800
come
materiale
sostegno
nellerisalgono
opere murarie,
a.C.
· come materiale per costruire tubature (negli
impianti di distribuzione idrica, fognature, ecc.),
per
la
copertura
impermeabilizzante
costruzioni (tettoie, cupole, ecc.)
delle
come insonorizzante,
per i recipienti adibiti alla cottura dei cibi ed altri
usi ancora.
PIOMBO
L'uso moderno del metallo:
nella costruzione degli accumulatori al piombo
(elettrodi),
nella costruzione dei "pallini" per le munizioni
destinate alla caccia,
per le "zavorre" usate nella preparazione delle
esche per la pesca.
Come leghe con lo stagno nella preparazione di
materiali idonei per la saldatura dei metalli (in tali
formulazioni il piombo può essere presente anche
per il 95%).
PIOMBO
I problemi ambientali:
Qualora,
ingeritimetallico
da volatili o pesci,
legati però,
al vengano
piombo
derivano
possono
sciogliersi proprio
nell'apparato
digerente
e procurare
principalmente
dall'uso
dello
stesso
avvelenamento;
nella caccia e nella pesca;
è stato dimostrato che uccelli da preda (come l'aquila dalla
i "pallini di piombo" o le "zavorre"
testa bianca)
abbandonati nell'ambiente
vanno incontro ad avvelenamento da piombo se si nutrono
stabili dai
aglicacciatori
agenti atmosferici, anche
dirisultano
prede "impallinate"
perché
il
metallo
si
ricopre
di
uno
strato
e che molte strolaghe muoiono per la stessa ragione se
d'ossidoi piombi
che delle
lo protegge
dai pesca.
processi di
inghiottono
lenze usate nella
corrosione.
PIOMBO
I problemi ambientali:
Il piombo
metallico,
di per se,
è moltosucchi
stabile;
Lo
scatolame
utilizzato
contenere
di
usato che
come
elettrodo
negli
è
frutta,
veniva
sigillato
con accumulatori
l'uso di queste
stabileuna
pur
in aperto,
presenza
acido
solforico
leghe,
volta
davadiluogo
a processi
di
abbastanzadella
concentrato.
corrosione
banda "stagnata" ad opera degli
acidi
nei losucchi
dell'ossigeno
Le suepresenti
leghe con
stagno,e invece,
sono
dell'aria:
instabili in ambiente leggermente acido se è
presente
l'ossigeno.
2 Pb
+ O2 + 4 H+ 2 Pb++ + 2 H2O
Questo processo permetteva al piombo di
entrare nel ciclo alimentare.
PIOMBO
I problemi ambientali:
Processi analoghi possono avvenire nelle
giunzioni delle tubature di piombo utilizzate
nelle reti di distribuzione idrica:
acque troppo "leggere" ricche in anidride
carbonica e ossigeno costituiscono un ambiente
abbastanza acido da consentire la reazione vista.
Una durezza ed una alcalinità abbastanza
elevate consentono però la precipitazione
dell'eventuale piombo ionico sotto forma di ossidi
e carbonati.
PIOMBO ALLO STATO IONICO Pb++
Pb++ rappresenta la forma ionica stabile del piombo
L'acqua, contiene quantità molto basse dell'elemento, se
ed è in questa forma che esso è presente in natura nei
confrontate con l'aria ed il terreno:
minerali da cui viene estratto.
La principale fonte di estrazione del piombo è
dalla
galena,
il rappresentata
piombo presente
nell'acqua
in cui il metallo è presente come PbS, altamente insolubile
in acqua.
viene interamente assorbito dall'organismo.
Il Pb++ può essere assunto dall'uomo, dagli altri
animali e dalle piante
perché presente nell'aria, nel suolo e nell'acqua.
PIOMBO ALLO STATO IONICO Pb++
L'OMS ha stabilito, per le acque destinate
all'alimentazione,
il limite di 50 ppb di piombo
Solo raramente tali limiti vengono raggiunti o
superati ciò, soprattutto, nei paesi dove la rete
idrica è ancora costituita da tubi di piombo.
In questi paesi, vengono spesso utilizzati
sistemi di potabilizzazione domestica che
riescono ad abbattere notevolmente i livelli di
piombo contenuti nelle acque potabili.
PIOMBO ALLO STATO IONICO Pb++
Una fonte di intossicazione
può essere costituita dai recipienti in ceramica, vetrificati con
una forma di PbO, materiale solido di color giallo, usato sin
dall'antico Egitto per impermeabilizzare e dare lucentezza ai
contenitori in terracotta.
Se applicato in modo scorretto,
tale materiale,
presenza di alimenti
acidi, può da
cedere
Altra
fonte diincontaminazione
ambientale
Pb++Pb
, ++
in
a livelli che possono arrivare fino a migliaia di ppm:
passato,
PbO(s)
+ 2 H+ <==>
Pb++ + H2Odi piombo,
era costituita
dall'uso
dell'arseniato
Pb3(AsO4)2, come pesticida.
Tale problema è, ancora oggi, sentito, particolarmente,
nei paesi in via di sviluppo.
PIOMBO ALLO STATO IONICO Pb++
L'uso di composti del piombo +2
ilcome
cromato
di piombo
) 2 additivi per vernici
piombo
bianco",
Pb(PbCrO
4come
pigmenti
colorati
3(COo
3)2(OH)
il pigmento
giallo
per verniciare
scuolabus
e per
èèanticorrosive
stato
utilizzato
fino usato
alla metà
del secolo gli
come
componente
le
sul
manto
stradale;
principale
delle
vernici
per interni (oggi è sostituito da TiO2)
è strisce
stato ed
è ancora
oggi
•una ancora
il "piombo
"minio"
viene
utilizzato
perole
vernici
per3Oesterni:
4)
delle
fonti
di rosso"
inquinamento
da (Pb
non
trascurare
per le
intossicazioni
che gradevole,
possono
sipossibili
presenta
di color
rosso
brillantederivarne:
eingerivano
viene usato
come
bambini
che,
dato
il sapore
la vernice
pigmento per
rivestimento
ferro,
distaccata
dallevernici
paretidadiusare
case come
fattiscenti,
dipintedel
con
tali
per le sue
proprietàelevati
anticorrosive;
vernici,
presentano
livelli ematici di piombo.
•Nel passato,
pigmentidato
a base
piombo
il di
sapore
gradevole conferito dal
piombo,
venivano
addirittura
usati
vengono usati
anche nella
stampa su
cartacome
patinataadditivi
o sugli
coloranti
di alimenti
involucri per
gli alimenti.
"
PIOMBO ALLO STATO IONICO Pb4+
In ambiente fortemente ossidante
il piombo assume lo stato di ossidazione 4+
può dar luogo alla formazione
di biossido di piombo PbO2
ossidi misti come Pb2O3 e Pb3O4 (piombo rosso).
Il biossido di piombo
viene utilizzato, insieme al piombo metallico, per la
costruzione degli elettrodi degli accumulatori al
piombo.
PIOMBO ORGANICO
A differenza del piombo allo stato di ossidazione + 2,
Il piombo allo stato di ossidazione + 4
forma facilmente composti covalenti, metalloorganici.
In tali composti
il piombo presenta le caratteristiche chimiche proprie
degli elementi del IV gruppo del Sistema periodico (C,
Si, Ge e Sn).
PIOMBO ORGANICO
Sotto
Venivano
la forma
aggiunti
di
alla
PbObenzina
il piombo
perdura
nelrivestono
particolato
I composti
organici
del piombo
che
disperso
in atmosfera
anche
per giorni..
importanza
sia
dal
punto
vista commerciale
piccole quantità di dibromuro e didi
dicloruro
di etilene
pertanto
può venir trasportato
anche in località distanti
che ambientale
sono
che combinandosi col piombo evita che questo
dalla rete stradale
depositandosi
sulle paretiPb(CH
del motore
possa provocare
il piombotetrametile
3) 4
seri danni.
il piombo tetraetile Pb(CH2-CH3)4.
ed entrare
Si
formavano
in contatto
composti
con volatili
l'ambiente
chee potevano
finire anche
essere
nella
allontanati
catena
alimentare.
insieme
ai gas di scarico.
Utilizzati
soprattutto
come additivi delle
benzine
come antidetonanti.
Dispersi
nell'atmosfera
i composti del piombo
PbBrCl, PbBr2 e PbCl2
subivano una trasformazione in PbO ad opera delle
radiazioni solari !!!
PIOMBO ORGANICO
I composti tetraalchilici del piombo,
PbR4,
sono volatili e evaporando dalle benzine,
contaminano
e possono
essere
+ agisconol'ambiente
PbR
come
neurotossine
per
la loro
3
assorbiti attraverso
la cute. la barriera ematocapacità
di attraversare
encefalica.
A livello del fegato, questi composti si
+, forme ancora più
trasformano
in
ioni
PbR
3
In
dosi
considerevoli
causano
una
tossiche dei composti
originali
!!! dosi massive
sintomatologia
simile alla
psicosi;
provocano la morte.
PIOMBO: conseguenze nell’ambiente
Al contrario del mercurio,
la trasformazione del piombo in composti
metilati
non avviene o avviene in misura limitatissima;
pertanto tutto il piombo tetraalchilico deriva
dall'uso delle benzine.
PIOMBO: conseguenze nell’ambiente
La maggior parte del piombo assunto
Sotto il profilo biochimico,
dall'uomo,
++
Il Pb , avendo dimensioni simili al Ca++,
interviene
interferendo
enzimidove
nei
inizialmente,
è presenteconnel glisangue
entra
nel meccanismo
di formazione
del
tessuto
meccanismi
che
presiedono
alla
formazione
raggiunge una concentrazione costante
osseo
dell'eme,
da qui il piombo passa nei tessuti molli,
tanto
più nei
bambini
e nei del
soggetti
che
lacompresi
proteina
che
è
responsabile
trasporto
gli organi e, particolarmente, il
presentano
unnel
deficit
di calcio.
dell'ossigeno
sangue;
cervello.
a Infine
concentrazioni
elevate nei tessuti ossei dove
va a depositarsi
sostituisce
il calcio.
può
manifestarsi
l'anemia
saturnina
caratterizzata dalla carenza di questa proteina.
PIOMBO: conseguenze nell’ambiente
Livelli elevati di piombo possono provocare:
Il piombo renali,
attraversa facilmente la barriera
disfunzioni
emato-encefalica !!
aumento della pressione arteriosa
passa facilmente dalla madre al feto e nel
danni permanenti a carico del cervello.
cervello di quest'ultimo interferendone con il
sviluppo
Isuo
fetinormale
ed i bambini
al di sotto dei sette anni
rappresentano gli individui a maggior rischio
questo può essere causa di aborti spontanei,
in quanto il piombo viene assorbito più
nascita di feti morti o danneggiamenti al
facilmente dagli alimenti e va a depositarsi nel
normale sviluppo del cervello.
cervello proprio nel periodo di rapida crescita.
CADMIO
A% = 0,000015
Numero Peso
Atomico atomico
48
Densità
D4°20°
112,41 8,64
T. fus,
°C
T.eboll.
°C
320,9
765
Il cadmio allo stato elementare
Essendo
un
metallo
molto
resistente
all'ossidazione, trova applicazioni industriali come
materiale protettivo di altri metalli, specie se a
contatto con acqua di mare.
CADMIO
Il cadmio viene anche utilizzato come
stabilizzante nella fabbricazione di materie
plastiche come il cloruro di polivinile, PVC.
L'uso più frequente del cadmio:
nella fabbricazione delle
"nicad" (nichel/cadmio)
batterie
ricaricabili
Diventa un grave problema
Ogni elemento di queste batterie contiene
il disfarsi delle batterie esaurite gettandole nei rifiuti destinati
diversi
grammi di cadmio…
all'incenerimento.
La loro combustione porta
nell'ambiente atmosferico!!!
alla
dispersione
del
cadmio
CADMIO
Ma la maggior parte di cadmio disperso
nell'atmosfera
viene generato dai processi di fusione dello
zinco, del piombo e del rame
con i quali si trova, in genere, associato in
natura.
Anche la combustione del carbone
genera un piccolo contributo alla dispersione di
cadmio nell'ambiente.
CADMIO allo stato ionico
Come per lo zinco, il solo ione formato dal
cadmio e Cd++.
il suo uso principale è nella preparazione dei
pigmenti colorati.
Sia il CdS (solfuro) che il CdSe (seleniuro)
vengono abbondantemente utilizzati per colorare
le materie plastiche.
Il CdSe viene utilizzato anche nel campo dei
semiconduttori, nelle celle fotovoltaiche e negli
schermi televisivi.
CADMIO allo stato ionico
Dato che il solfuro di cadmio CdS cambia
colore in una ampia gamma di tonalità a
seconda delle dimensioni delle particelle,
per oltre un secolo e mezzo,
i pittori hanno usato pigmenti a base di
questo composto per ottenere il giallo
brillante
ed hanno continuato ad usarlo nonostante
fosse stato proibito.
CADMIO nell’ambiente
Viene rilasciato:
in prossimità delle miniere e delle fonderie
che producono zinco
o dagli inceneritori che bruciano materie
plastiche ed altri materiali che contengono
cadmio o come stabilizzante o come pigmento
colorato
gli stessi materiali ferrosi placcati con
cadmio rilasciano facilmente l'elemento se
portati a temperature elevate.
CADMIO nell’ambiente
Il Cd++, per la sua somiglianza chimica con
lo zinco,
è solubile in acqua
se non è presente lo ione solfuro
quindi può entrare nel ciclo alimentare di
piante ed animali.
CADMIO nell’ambiente
L'uso di fertilizzanti a base di fosfati, contenenti
cadmio come contaminante naturale,
o dei fanghi provenienti da
depurazione contaminati da cadmio,
impianti
di
incrementa il livello di tale elemento nel suolo
e di conseguenza nelle piante che vi crescono.
Bassi valori di pH facilitano l'assunzione di
cadmio da parte delle piante; perciò le piogge
acide danno un ulteriore contributo alla gravità del
problema.
CADMIO nell’ambiente
L'uomo,
inizialmente,
è
protetto
dall'esposizione al cadmio in quanto
produce una proteina,
la metallotioneina, che è alla base della
regolazione del metabolismo dello zinco.
Questa proteina per la presenza di molti
gruppi solfidrilici,
è in grado di complessare il cadmio
e ne permette l'eliminazione attraverso le vie
urinarie.
CADMIO nell’ambiente
Se, però, la quantità di cadmio supera le
capacità complessanti della
metallotioneina,
il metallo viene trattenuto nel fegato e nei
reni!!
Può scambiare gli ioni calcio
nel tessuto osseo che, col tempo, assume un
aspetto poroso e può fratturarsi facilmente.
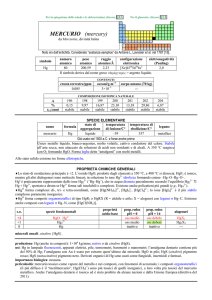
MERCURIO
A% = 0,00005
Numero Peso
Densità
Atomico Atomico D4°20°
T. fus,
°C
80
-38.87 356,58
200,59 13,55
T.eboll.
°C
Il mercurio allo stato elementare
Tutte
queste
applicazioni,
se mal
gestite, possono essere
Metallo
liquido
a temperatura
ambiente,
fonte di inquinamento !!!
con un ottimo coefficiente di dilatazione lineare e con una
specie
questi manufatti
gettati utilizzato
nei rifiuti nella
che
densitàse piuttosto
elevata, vengono
comunemente
finiscono
all'incenerimento,
costruzione
di termometri e barometri.
data
anche l'elevata
tensione quali
di vapore
caratterizza
in moltissime
applicazioni
contatti che
elettrici
mobili,
l'elemento.
lampade fluorescenti e lampade a vapori di mercurio.
MERCURIO
Si estrae dal cinabro, un minerale costituito da HgS
di color rosso vermiglio.
I vapori di mercurio presentano una elevata
tossicità
riescono a
encefalica
superare
la
barriera
emato-
a penetrare nel cervello con gravi danni al
sistema nervoso centrale
che
si
manifestano
con
difficoltà
al
coordinamento, della vista e della sensibilità al
tatto.
MERCURIO
Quantità notevoli di mercurio vengono immesse
nell'atmosfera con la combustione del carbon fossile
e dell'olio combustibile che lo contengono a livelli di
diverse centinaia di ppm.
I vulcani contribuiscono ad immettere nell'atmosfera
vapori del metallo.
I vapori di mercurio, che solo minimamente sono
legati al particolato aereosospeso,
possono essere trasportati per lunghe distanze
prima di andare a depositarsi sul terreno o nelle
acque superficiali.
Amalgami del MERCURIO
Il mercurio scioglie facilmente gli altri metalli
con formazione
"amalgami";
di
soluzioni
o
leghe
dette
gli unici tre metalli che non vengono sciolti il
quantità considerevole sono il ferro, il cobalto ed il
nichel.
L'"amalgama dentale" è un impasto formato,
soprattutto, da mercurio, argento e stagno usato per
riempire le cavità dentarie.
Fino al secolo scorso, l'amalgama era una via per
la ricopertura degli oggetti con metalli preziosi
come l'oro o l'argento.
Usi industriali del MERCURIO
Il processo industriale cloro-soda consiste nel
trattamento elettrolitico di soluzioni di NaCl per
ottenere cloro gassoso, idrogeno gassoso e
idrossido di sodio.
In principio, il processo è semplice, in quanto le
reazioni agli elettrodi sono:
2 H2O + 2 e- <==> H2(g) + 2 OH2 Cl- <==> Cl2(g) + 2 eReazione globale:
2 H2O + 2 Na+ + 2 Cl- <==> Cl2(g) + H2(g) + 2
Na+ + 2 OHLa soluzione contiene ancora NaCl !!!
Usi industriali del MERCURIO
Il processo industriale, per ottenere l'idrossido di
sodio puro,
si avvale dell'uso di un catodo di mercurio
sul quale, anziché l'acqua,
si scarica lo ione Na+ formando un amalgama di Na
(il sodio metallico nell'amalgama non è reattivo nei
confronti dell'acqua così come il sodio puro);
Na+(aq) + e- <==> Na(Hg)
Usi industriali del MERCURIO
Il mercurio contenente sodio metallico viene fatto
passare in una seconda cella elettrolitica, priva di
NaCl, dove funge da anodo:
Na(Hg) <==> Na+(aq) + ementre al catodo avviene la riduzione dell'acqua
vista sopra.
La reazione globale sarà:
2 H2O + 2 Na(Hg) <==> 2 Na+(aq) + 2 OH- +
H2(g) + Hg(l)
Usi industriali del MERCURIO
Il mercurio metallico
viene recuperato e rimesso in ciclo, come catodo,
nella cella elettrolitica precedente.
Il riciclaggio del mercurio,
non è mai completo
ed una parte di esso si disperde nell'ambiente
atmosferico
o nelle acque utilizzate per il raffreddamento e
quindi scaricate nei corpi idrici superficiali.
Usi industriali del MERCURIO
Il mercurio metallico
come tale non passa in soluzione in quanto non si
ossida anche in presenza di acidi diluiti.
Può, però, essere ossidato da batteri presenti
nelle acque naturali
trasformato nella forma ionica,
può entrare nel ciclo alimentare dei pesci e,
infine, dell'uomo.
MERCURIO ionico
il mercurio presenta, comunemente, lo stato di
ossidazione +2,
anche se può esistere nella forma stabile Hg2++ allo
stato di ossidazione +1.
allo stato di ossidazione +1 si presenta stabile
specie in ambiente ricco in ioni clururo,
con formazione del composto poco solubile
"calomelano", Hg2Cl2.
L'Hg2+
non
rappresenta
una
forma
particolarmente tossica dell'elemento e nello
stomaco dell'uomo, l'alto contenuto in acido cloridrico
ne diminuisce la pericolosità.
L'Hg++,
MERCURIO ionico
anche se in misura inferiore ai vapori del
mercurio metallico,
è in grado di colpire il sistema nervoso centrale
dell'uomo ed, in particolare, può causare danni
rilevanti nel fegato e nel rene.
Se presente nelle acque naturali,
può formare composti covalenti, come l'HgCl2,
che è un composto volatile e, quindi, può disperdersi
nell'atmosfera.
può anche adsorbirsi sul materiale particolato
sospeso e venire depositato nei sedimenti del corpo
idrico.
MERCURIO ionico
Il pesce assume il mercurio
sia sotto forma di
come metilmercurio;
composti organoclorurati che
ma mentre gli organoclorurati, si accumulano nei
tessuti adiposi,
il metilmercurio, legandosi alle proteine del pesce,
si distribuisce per tutto il corpo.
MERCURIO ionico
Il metil mercurio si accumula
muscolare biomagnificandosi
nel
tessuto
fino a raggiungere valori che, nei confronti
dell'acqua in cui vive, può assumere rapporti
maggiori di 100 : 1
Le concentrazioni più elevate vengono
riscontrate nelle specie predatrici sia di mare che di
acqua dolce come gli squali i pesci spada o il
pesce persico ed il luccio.
Formazione del metil mercurio
Con anioni capaci di formare legami covalenti più di
quanto non lo siano gli ioni nitrato, ossido e solfato,
lo ione mercurio Hg2+ forma molecole covalenti
piuttosto che uno ione solido;
ne è un esempio l'HgCl2, composto molecolare
volatile.
Come gli ioni Cl- formano un composto covalente con
Hg 2+
così si comporta anche l'anione metile CH3-,
che dà luogo al liquido
dimetilmercurio, Hg(CH3)2 .
volatile
molecolare
Formazione del metil mercurio
Il processo di formazione del dimetilmercurio
si svolge nei sedimenti fangosi dei fiumi e dei
laghi,
soprattutto in presenza di condizioni anaerobie,
allorché i batteri e i microrganismi anaerobi
convertono Hg2+ in Hg(CH3)2
Formazione del metil mercurio
Nel processo di metilazione
l'agente attivo è un comune costituente
microrganismi, la «metilcobalammina»,
dei
un derivato della vitamina B12 in cui un anione CH3- è
legato al cobalto.
A causa della sua volatilità,
il dimetilmercurio evapora
relativamente rapido
dall'acqua
in
modo
a meno che non venga trasformato,
condizioni di acidità, nel monometile.
dalle
Formazione del metil mercurio
le vie di produzione e il destino del dimetilmercurio e di
altre specie chimiche contenenti mercurio in un corpo
idrico.
Formazione del metil mercurio
I composti «miscelati» meno volatili CH3HgCl e CH3HgOH,
spesso indicati complessivamente come CH3HgX,
denominato metilmercurio
si formano con le stesse modalità del dimetilmercurio e
persino più rapidamente.
Formazione del metil mercurio
In soluzioni acquose acide o neutre,
la produzione del metilmercurio eccede la formazione
del dimetilmercurio.
Il metilmercurio risulta un tossico più potente di quanto
non siano i sali di Hg 2+
per la sua solubilità nei tessuti adiposi degli animali
dove subisce una bioaccumulazione e una
biomagnificazione.
Formazione del metil mercurio
Una volta ingerito,
il composto CH3HgX si converte in altri composti in cui
la X è un amminoacido contenente zolfo;
in alcune di queste forme esso risulta solubile nel
tessuto biologico
può così attraversare sia la barriera emato-encefalica
che quella placentare dell'uomo,
presentando un duplice rischio.
Formazione del metil mercurio
Il metilmercurio rappresenta infatti
la forma di mercurio più rischiosa, seguita dal vapore
dell'elemento stesso.
Lo ione mercurio, Hg 2+ non risulta molto tossico dato
che, nello stomaco,
si combina con lo ione cloruro producendo Hg2Cl2.
Formazione del metil mercurio
Il mercurio è presente nell'uomo in gran parte sotto forma
di metilmercurio,
assunto quasi interamente attraverso un'alimentazione
a base di pesce, nella quale almeno l'80% del mercurio
si trova sotto forma di metilmercurio.
Il pesce introduce questa sostanza solubile nell'acqua
assorbendola con le branchie, oltre che con l'alimentazione.
Il metilmercurio è in grado di legarsi al gruppo solfidrilico
delle proteine così da essere distribuito per tutto il pesce;
per tale motivo è praticamente impossibile «asportare»
le parti contenenti il mercurio prima che il pesce venga
mangiato.
Formazione del metil mercurio
Le concentrazioni più elevate
si riscontrano in genere nelle grosse specie predatrici
marine, a vita lunga,
come gli squali e i pesci spada e ancora nelle specie
d'acqua dolce come il pesce persico e il luccio.
Le specie non carnivore,
non accumulano grosse quantità di mercurio
dato che la biomagnificazione attraverso la catena
alimentare risulta, in questi pesci, di gran lunga
inferiore rispetto a quanto avviene nei pesci carnivori.
Formazione del metil mercurio
Nei laghi, il contenuto di mercurio dei pesci risulta in
genere superiore nelle acque acide,
probabilmente perché la metilazione del mercurio è più
rapida in presenza di bassi valori di pH.
Pertanto l'acidificazione delle acque naturali
aumenta indirettamente l'esposizione al metilmercurio
da parte di coloro che si nutrono di pesce.
Altre fonti di metil mercurio
Composti organici del mercurio:
Fungicidi in agricoltura
Nelle industrie
A contatto con il suolo
Demolizione
Mercurio intrappolato come composto insolubile per
l’attacco dei gruppi sulfurei dell’argilla e della materia
organica
Altre fonti di metil mercurio
Il mercurio viene lisciviato dalle rocce nei sistemi idrici
dai processi naturali,
alcuni dei quali vengono accelerati dall'intervento
dell'uomo,
inondazioni di zone coltivate favoriscono la
liberazione del mercurio nelle acque.
Altre fonti di metil mercurio
Altro metilmercurio si formava dal contatto dell'Hg2+
legato al suolo con i batteri anaerobi prodotti dalla
decomposizione del materiale organico sommerso:
in tal modo, il mercurio inorganico precedentemente
insolubile veniva trasformato in metilmercurio
facilmente solubile in acqua.
Successivamente questo composto entrava nella catena
alimentare attraverso l'assimilazione da parte dei pesci.
Hg nei conservanti
•Per la conservazione delle vernici in barattolo
•Per evitare la formazione di muffa dopo l’applicazione di
pitture a base di lattice
Ione fenilmercurio C6H5H+ con acetato e nitrato
come anione
meno tossico del metil-mercurio
Hg come medicinale
•Antisettico per uso topico
•In prodotti cosmetici
•In passato anche in alcuni medicinali
ARSENICO
A% 0,0005
Numero Peso
Densità
Atomico Atomico D4°20°
T. fus,
°C
T.
eboll.°C
33
817
613
74,92 5,73
Le sue proprietà lo fanno somigliare più ad un
metallo che ad un non-metallo in quanto forma
più facilmente legami ionici piuttosto che covalenti.
In natura si trova combinato con altri metalli,
principalmente con rame, piombo, zinco, nichel,
ferro, argento ed oro dove è presente come solfuro
o come ossido.
ARSENICO
forma composti
nei due stati di ossidazione +3 e +5
diversamente dal fosforo,
tende a formare legami ionici piuttosto che
covalenti mostrando caratteristiche prettamente
metalliche.
L'arsenico +3 risulta più tossico dell'altro
probabilmente perché, legandosi ai gruppi
solfidrilici, viene trattenuto più a lungo nel corpo.
ARSENICO
I composti dell'arsenico
hanno trovato un largo impiego come pesticidi
prima che venissero introdotti come tali dei
composti organici
vengono ancora impiegati in alcune parti del
mondo
e continuano, quindi, a rappresentare un serio
problema ambientale.
ARSENICO
Liberazione involontaria
durante i processi di estrazione e fusione dell’oro,
piombo, rame, nichel nei cui minerali è
comunemente presente
Processi di produzione del ferro e dell’acciaio
Combustione del carbone di cui è contaminante
ARSENICO
Rimozione dall’acqua in cui è presente come
arseniato AsO43- :
Si fa scorrere l’acqua sopra l’allumina (ossido di
alluminio) sulla cui superficie rimane adsorbito
Come per il calcio e magnesio,
può essere eliminato per precipitazione in uno dei
suoi sali insolubili: Fe3+ + AsO43- FeAsO4
spesso As è presente nelle acque di falda come As(III)
(condizioni riducenti del sottosuolo) per cui è necessaria la
sua ossidazione a As(V)
ARSENICO
Forme organiche
Non sono semplici derivati metilici (come per Pb e
Hg) ma come acidi idrosolubili che possono così
essere eliminati dall’organismo.
Nell’acqua: come acido H3AsO4 = (OH)3AsO
o come una delle sue forme deprotonate
La metilazione mediata dalla metilcobalamina
interessa la sostituzione dei gruppi OH con quelli
CH3
ARSENICO
Forme organiche
La monometilazione
che avviene nel fegato e nei reni dell’uomo
converte l’As inorganico in (CH3)(OH)2AsO e
poi nel corrispondente dimetile
composti che vengono escreti.
ARSENICO
Composti neutri di As(III)
Arsina AsH3
Trimetil-arsina As(CH3)3
prodotto in condizioni di umidità tra le muffe
nella colla della carta da parati e il pigmento
verde contenente arsenico CuHAsO3
Le forme più tossiche dell’As
ARSENICO
Episodi di avvelenamento
Da arsina gassosa liberata quando soluzioni
acquose
di As(III) come HAsO2
vengono in contatto con un metallo ossidabile
come Al o Zn
Con conseguente riduzione dell’As:
2Al(s) + HAsO2 + 6H+ 2 Al3+ + AsH3 + 2 H2O
CROMO
Di norma è presente in forma di ioni
inorganici
I suoi stati di ossidazione: +3 e +6
In condizioni ossidanti (aerobiche)
– Il cromo è presente nello stato +6
– Ione cromato CrO42- (ossianione)
CROMO
In condizioni debolmente acide
– Lo ione cromato (CrO42-) è protonato:
– H+ + CrO42-
↔
HCrO4-
Ossianioni del cromo:
– Debolmente idrosolubili
CROMO
Colore giallo
– CrO42- HCrO4– Impartiscono colore gialla all’acqua già
a livelli di 1 ppm
CROMO
A concentrazioni elevate:
– Lo ione cromato dimerizza:
–
– Ione dicromato Cr2O72– Forte agente ossidante usato nei laboratori
CROMO
In condizioni riducenti (anaerobie):
– Il Cr esiste allo stato (III):
–
– In soluzione acquosa: Cr3+
– La solubilità non è elevata
– Spesso precipita a formare Cr(OH)3 in
condizioni alcaline, neutre o debolmente acide:
Cr 3+ + 3 OH-
↔
Cr(OH)3
CROMO
Ione disciolto o precipitato:
– Cr(III) o Cr(VI)
Dipende dall’ambiente
dall’ambiente acquoso se
ossidante o riducente.
CROMO
Differenza assai importante per la
differente tossicità:
– Cr(VI) tossico e cancerogeno
– Cr(III) meno tossico e in tracce
agisce come nutriente
CROMO
Lo ione CrO42– Penetra rapidamente nelle cellule
viventi:
Struttura simile allo ione solfato
– All’interno della cellula:
Lo ione è in grado di ossidare le basi del
DNA e dell’RNA.
CROMO
Dato che il Cr(VI):
– Più tossico
– Più solubile
– Più mobile
Fattore di rischio per la salute
CROMO
Contaminazione
Usato:
– Galvanoplastica
– Protezione contro la corrosione
– Concia della pelle:
Si lega alle proteine della cute animale
formando un pellame resistente all’acqua, al
calore e ai batteri
CROMO
Contaminazione
Emissioni industriali:
– Comune inquinante dell’acqua
– Secondo contaminante inorganico delle
acque di falda sottostanti le discariche
per rifiuti pericolosi
CROMO
Rimozione
Mentre gran parte dei metalli pesanti
possono essere rimossi
aumentando il pH di tali acque:
– Il Cr(VI) non precipita a nessun
valore di pH
CROMO
Rimozione
Considerando la bassa solubilità del Cr(III)
e quindi la bassa mobilità del Cr(III),
il sistema più semplice per estrarre Cr(VI)
dall’acqua:
– Usare un agente riducente al fine di convertire
Cr(VI) in Cr(III):
– CrO42- + 3e- + 8H+ ↔ Cr
3+
+ H2O
CROMO
Rimozione
Agenti riducenti usati:
– SO2
– Solfito di sodio (Na2SO3)
Per decontaminare acque reflue:
– Ferro nella forma Fe(II)
– + Base per favorire la precipitazione del
Cr(III)
CROMO
Rimozione
Barriera:
– Ferro elementare a grana fine in pareti
permeabili sotterranee disposte a barriera
lungo la taiettoria del flusso delle acque di
falda contaminate:
Il Ferro riduce il Cromo
Come Fe(III) forma un composto insolubile
Fe(III)-Cr(III)
Tale processo può avvenire spontaneamente nel
suolo per la presenza di Fe(II) o C organico come
riducente.
CROMO
Cr(VI) nel suolo
Piuttosto mobile
– Non viene assorbito saldamente dai vari
tipi di terreno
– Può essere ridotto nella forma trivalente
dalle sostanze umiche del suolo ricche
di materia organica
CROMO
Arseniato Cromato di Rame CCA
come preservante del legno:
– 10% della massa del legno
– Fonte di Cr significativa per l’ambiente:
Usata per proteggere le strutture in legno
usato in ambienti acquatici:
Rilasciano Cr, As e Cu
CROMO
Arseniato Cromato di Rame CCA
come preservante del legno:
– Si usa inizialmente il Cr(VI)
– Durante un periodo di fissazione di
settimane dal trattamento
– Ridotto a Cr(III) con il carbonio presente
nel legno.
CROMO
Arseniato Cromato di Rame CCA
come preservante del legno:
– Si formano così complessi insolubili
che si liberano dal legno trattato con estrema
lentezza.
– La liberazione dei metalli pesanti
inizia a verificarsi lentamente dopo alcuni mesi
dal trattamento con perdita maggiore di As
rispetto al Cr.
COMPOSTI ORGANOSTANNICI
Sebbene i composti inorganici dello
stagno (Sn) siano relativamente privi
di tossicità
– il legame fra questo metallo e una o più
catene di carbonio
– porta alla formazione di sostanze
tossiche.
COMPOSTI ORGANOSTANNICI
I composti organostannici vengono
sfruttati in alcuni comuni impieghi,
– come additivi per stabilizzare le materie
plastiche a base di PVC
– come fungicidi nella conservazione del
legno;
per tale ragione essi sono di
interesse ambientale.
COMPOSTI ORGANOSTANNICI
Lo stagno forma una serie di
composti con formula generale
R3SnX
– queste sono sostanze ioniche (R3Sn+) (X-)
R: gruppo idrocarburico
X: anione monoatomico.
Composti equivalenti come (R3Sn)2O
– si ottengono quando l'anione ha carica
doppia.
COMPOSTI ORGANOSTANNICI
la maggior attività tossica per i funghi,
si ottiene quando ciascuna catena idrocarburica
presenta quattro atomi di carbonio in una catena non
ramificata, cioè quando R è un il gruppo n-butilico,
L'ossido di tributilstagno (R3Sn)2O, dove R è nC4H9, e il fluoruro corrispondente sono stati
impiegati come fungicidi.
essi vengono comunemente aggiunti come agenti
«antivegetativi » (antiincrostazione) alle vernici
utilizzate per le banchine, per lo scafo delle barche,
per le reti da pesca ecc.,
allo scopo di evitare l'accumulo di organismi marini
COMPOSTI ORGANOSTANNICI
Negli ultimi anni il tributilstagno è stato aggiunto
ai rivestimenti polimerici usati per gli scafi delle
barche;
in questo modo viene a formarsi un sottile strato di
questo composto intorno allo scafo.
In queste applicazioni i composti dello stagno
hanno sostituito l'ossido di rame (I) (Cu2O),
dato che la loro efficacia dura per più di una stagione.
Purtroppo parte del composto di tributilstagno si
libera nelle acque superficiali a contatto con i
rivestimenti o le vernici, soprattutto nei porti dove
sono ormeggiate le barche;
COMPOSTI ORGANOSTANNICI
Tale composto penetra nella catena alimentare
attraverso i microrganismi che vivono in prossimità
della superficie.
Ciò comporta la sterilità e persino la morte dei
pesci e di alcuni tipi di ostriche e di molluschi che
si nutrono di tali microrganismi.
Alcuni Paesi hanno limitato l'uso dei composti del
tributilstagno alle grosse navi,
tuttavia, nonostante le precauzioni, la sostanza
inquinante si concentra ancora nelle regioni
costiere come quelle del Mare del Nord.
COMPOSTI ORGANOSTANNICI
Gli scienziati temono che la presenza dei
composti del tributilstagno in queste acque
– possa ripercuotersi sulla riproduzione della fauna ittica.
Gli organismi superiori possiedono la capacità di
scindere, per via enzimatica, il tributilstagno in
modo abbastanza rapido;
– per tale motivo questi composti non si rivelano molto tossici
per l'uomo.
Per tali motivi, dal 2003 la International Maritme
Organization
– ha proibito l’uso del tributilstagno per nuovi trattamenti delle
imbarcazioni di qualsiasi dimensione.