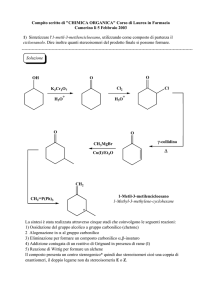
Carboidrati
Classe di molecole organiche più abbondante in natura
Vengono sintetizzati nelle piante per mezzo della fotosintesi
Dal loro catabolismo si ottiene l’energia che sostiene la vita
animale
Sono i precursori metabolici di quasi tutte le biomolecole
Si legano covalentemente con una grande varietà di molecole
( glicoproteine e glicolipidi)
Sono coinvolti nel processo di riconoscimento cellulare
In forma si polimeri servono come elementi strutturali
Quali sono le proprietà chimiche che rendono
uniche le caratteristiche dei carboidrati ?
1) L’esistenza di uno o più centri di asimmetria
2) La possibilità di assumere sia strutture lineari
che ad anello
3) La capacità di formare polimeri mediante
legami glicosidici
4) La possibilità di formare legami idrogeno con
l’acqua e altre molecole
5) La capacità di subire numerose reazioni in
differenti posizioni della molecola
Nomenclatura dei Carboidrati
Gli zuccheri o carboidrati sono composti che contengono C, H,O.
La formula generale è (CH2O)n
Possono essere classificati in 4 gruppi:
Monosaccaridi
Disaccaridi
Oligosaccaridi
Polisaccaridi
I carboidrati sono composti polifunzionali che contengono:
un gruppo carbonilico
uno o più gruppi alcolici
Se il gruppo carbonilico è un’aldeide avremo degli ALDOSI
Se il gruppo carbonilico è un chetone avremo dei CHETOSI
I carboidrati più semplici (con n > = 3 ) sono :
monosaccaridi
Il chetoso più semplice è il diidrossiacetone
C H 2O H
C
O
C H 2O H
L’aldoso più semplice è la gliceraldeide
CHO
H
C
OH
CH2 OH
Diidrossiacetone e gliceraldeide hanno tre atomi di carbonio e sono detti triosi
Tutti gli altri zuccheri si possono considerare derivati dalla gliceraldeide
o dal diidrossiacetone per graduale aggiunta di C HOH
tra il C1 e 2 della gliceraldeide
il C2 e C3 del diidrossiacetone.
CHO
C H 2O H
C
O
(CH O H) m
H
C
OH
CH2O H
(CH O H) m
CH2O H
La gliceraldeide ha un atomo di carbonio asimmetrico, ed esistono due enantiomeri
CHO
H
C
OH
CH2 OH
CHO
HO
C
H
CH2OH
D
L
Gliceraldeide
gliceraldeide
Gli zuccheri con il gruppo OH del carbonio asimmetrico più in basso a destra sono D
Gli zuccheri con il gruppo OH del carbonio asimmetrico più in basso a sinistra sono L
Per allungamento della catena carboniosa potremo avere:
Gli aldosi che derivano dalla D gliceraldeide sono aldosi della serie D
Gli aldosi che derivano dalla L gliceraldeide sono aldosi della serie L
Condensazione aldolica
Reazione di addizzione nucleofila che porta ad un
allungamento della catena carboniosa
C H 22 OPO 3H 2
CHO
C H 2 OPO3 H 2
C
O
C H 2O H
H
+
C
OH
C H 2 OPO3 H 2
C
O
HO
C
H
H
C
OH
HH
C
OH
C H 22 OPO 3H 2
DHAP
GAP
FBP
CHO
CHO
H
C
OH
H
C
OH
H
C
OH
HO
C
H
destra
CH2 OH
sinistra
CH2 OH
D
L
eritrosio
treosio
CHO
ribosio
H
C
OH
H
C
OH
H
C
OH
CH2 OH
destra
D-ribosio
Ci sono diversi modi per rappresentare il glucosio ( e gli altri zuccheri)
CHO
H
C
HO
H
C
OH
H
C
OH
HO
C
H
H
C
OH
H
C
C
H
H
C
OH
H
C
OH
forma aperta
rappresentazione
convenzionale di
Fisher
CH2 OH
O
OH
OH
OH
O
CH2 OH
CH2 OH
OH
forma semiacetalica
rappresentazione
convenzionale
(di Tollens,poco
usata)
OH
forma semiacetalica
rappresentazione
convenzionale di
Haworth
HO
H
H O
H
HO
H
HO
OH
OH
H
forma semiacetalica
Rappresentazione
quasi reale
gruppo aldeidico
Anche se la formula convenzionale sembra
lineare, in realtà la molecola si ripiega su
sé stessa
C2
C5
C3
C4
Il gruppo OH del C5 è vicino al gruppo
aldeidico e può formare un semiacetale
Il C1 diventa asimmetrico
Si possono formare due tipi di semiacetale
Con sei atomi nell’anello, detta forma piranosica dal nome del pirano
HO
H
O
HO
H
H O
H O
H
HO
HO
OH
H
HO
OH
OH
OH
H
HO
H
H
H
a D glucopiranosio
b D glucopiranosio
Con cinque atomi nell’anello, detta forma furanosica dal nome del furano
H
HO
H
O
HO
HO
HO
H
OH
H
H
OH
a D glucofuranosio
O
H
OH
O
HO
HO
H
H
H
H
OH
b D glucofuranosio
HO
H
nella forma a il C semiacetalico ha la stessa
configurazione del C che determina se lo zucchero è
DoL
H O
H
HO
OH
H
HO
il C1 ha la stessa configurazione
OH
(assiale)
H
il C5 dice che è D glucosio
HO
H
H O
OH
HO
H
HO
nella forma b il C semiacetalico ha la configurazione
opposta del C che determina se lo zucchero è D o L
( equatoriale)
OH
H
H
il C5 dice che è D glucosio
il C1 ha la configurazione opposta
I chetoesosi ed i pentosi esistono solo in forma furanosica
zucchero D CH2 OH OH
O
OH in alto: b
b D ribosio
OH OH
C1
zucchero D CH2OOH CH2OH
OH
a D fruttosio
C2 semiacetale
OH
OH
OH in basso: a
Principali zuccheri
CHO
CHO
Pentosi (5 atomi di C)
H
C
OH
H
C
H
H
C
OH
H
C
OH
H
C
OH
H
C
OH
CH2 OH
CH2 OH
D-ribosio
2-desossi D-ribosio
aldosi
Esosi (6 atomi di C)
chetosi
CHO
CHO
CHO
CH2 OH
H
C
OH
HO
C
H
H
HO
C
H
HO
C
H
C
OH
HO
C
H
H
C
C
OH
H
C
OH
H
C
H
C
OH
HO
C
H
H
CH2 OH
D-glucosio
CH2 OH
D-galattosio
C
O
HO
C
H
OH
H
C
OH
OH
HH
C
OH
CH2 OH
D-mannosio
CH2 OH
D-fruttosio
HO
H
Nella rappresentazione convenzionale gli
zuccheri D hanno il CH2OH in alto
H O
OH
HO
H
HO
OH
H
H
CHO
CH2 OH
O
C
OH
HO
C
H
CH2 OH
O OH
OH
OH
OH
H
OH
OH
a D glucosio
H
C
OH
H
C
OH
OH
OH
CH2 OH
D glucosio aperto
b D glucosio
In soluzione esiste un equilibrio tra forma a, forma b e forma aperta
Le forme a e b del D glucosio in soluzione acquosa si interconvertono
l’una nell’altra, questo fenomeno di variazione della rotazione ottica
Prende il nome di MUTAROTAZIONE
Gli isomeri a e b si dicono anomeri
Principali zuccheri
CHO
CHO
Pentosi (5 atomi di C)
H
C
OH
H
C
H
H
C
OH
H
C
OH
H
C
OH
H
C
OH
CH2 OH
CH2 OH
D-ribosio
2-desossi D-ribosio
aldosi
Esosi (6 atomi di C)
chetosi
CHO
CHO
CHO
CH2 OH
H
C
OH
HO
C
H
H
HO
C
H
HO
C
H
C
OH
HO
C
H
H
C
C
OH
H
C
OH
H
C
H
C
OH
HO
C
H
H
CH2 OH
D-glucoso
CH2 OH
D-galattoso
C
O
HO
C
H
OH
H
C
OH
OH
HH
C
OH
CH2 OH
D-mannoso
CH2 OH
D-fruttoso
Proprietà fisiche dei monosaccaridi:
Solidi bianchi di sapore dolce
Solubili
Proprietà chimiche:
Aldosi: tutte le reazioni degli alcoli e delle
aldeidi
Chetosi: tutte le reazioni dei chetoni e degli
alcoli
I semiacetali hanno una reattività simile agli alcoli ma reragiscono più
facilmente
OR
R
C
OR
OH
H
semiacetale
+ R-OH
R
C
OR
H
acetale
Gli zuccheri, in quanto semiacetali, possono formare degli acetali
Il legame che si forma si chiama legame glicosidico
IL LEGAME GLICOSIDICO
Il legame glicosidico si ha per sostituzione dell’OH anomerico con un altro gruppo:
Se al C anomerico si lega un ossigeno diremo che è un legame O-glicosidico
Se al C anomerico si lega un azoto diremo che è un legame N-glicosidico
CH2 OH
CH2 OH
O
NH-CH 3
O
OH
CH2 OH
O
OH
OH
O
OH
OH
OH
OH OH
(legame O glicosidico)
I GLICOSIDI sono stabili
( legame N glicosidico)
Derivati dei monosaccaridi
Acidi aldonici, aldarici, uronici (zuccheri acidi)
Alditoli ( zuccheri con funzione alcolica)
Esteri degli zuccheri
Ammino zuccheri
Addotti con le proteine
ZUCCHERI ACIDI
OSSIDAZIONE:
Monosaccaridi
acidi aldonici, uronici, aldarici (zuccheri acidi)
COO
OH
H
C
OH
HO
C
H
CHO
H
C
OH
H
C
OH
H
C
OH
H
C
OH
HO
C
H
CH2 OH
HO
C
H
H
C
OH
H
C
OH
Sul C1
H
C
OH
H
C
OH
CH2 OH
D glucoso
Blanda ossid.
CH O
Sul C6
H
C
OH
HO
C
H
H
C
OH
H
C
OH
COO
OH
COO
OH
Acido D gluconico
Energica ossid.
COO
OH
Acido D glucuronico
ACIDO D
GLUCARICO
L’acido ascorbico
ALDITOLI
Riduzione :
Monosaccaridi
Alditoli o Polioli
CH2 OH
CHO
HO
H
H O
H
HO
H
HO
OH
OH
H
C
OH
HO
C
H
H
C
OH
H
C
OH
H
CH2 OH
glucosio
riduzione
H
C
OH
HO
C
H
H
C
OH
H
C
OH
CH2 OH
Glucitolo o
Sorbitolo
Derivati dei monosaccaridi
* Acidi aldonici, aldarici, uronici (zuccheri acidi)
* Alditoli ( zuccheri con funzione alcolica)
Esteri degli zuccheri
Ammino zuccheri
Addotti con le proteine
ESTERI degli ZUCCHERI
ESTERIFICAZIONE:
C H 2O H
C
O
C H 2 OPO3 H 2
CHO
H
C
C H 2 OPO3 H 2
OH
O
OH
C H 2 OPO3 H 2
OH OH
Diidrossiaceton fosfato
Gliceraldeide 3 fosfato
Ribosio 5 fosfato
Aminozuccheri
Aminozuccheri acetilati
ADDOTTI con le proteine
GLICAZIONE non ENZIMATICA
Riassumendo
Reazioni dei Monosaccaridi
Riduzione
Ossidazione (in C1 e C6)
Esterificazione
Sostituzione nucleofila (legame glicosidico)
Glicazione (Reazione di Maillard)
Allungamento della catena C (Condensazione aldolica)