Acidi carbossilici e
derivati
Nomenclatura e nomi comuni
Struttura e proprietà
Fonti
Reazioni
Derivati degli acidi carbossilici
Acidi carbossilici
Composti carbonilici
Acidi carbossilici
Gli acidi carbossilici hanno un gruppo OH direttamente legato al carbonio
sp2. L’anione degli acidi carbossilici è stabilizzato dalla risonanza.
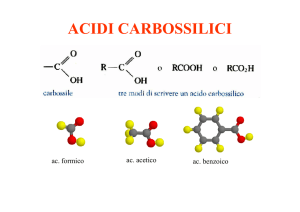
COOH
O
Me
Acido benzoico
OH
Acido acetico
COOH
Acido linoleico
Acidi carbossilici
• Trovare la catena più lunga di atomi di
C, contenente il gruppo COOH.
• Sostituire la –e finale del nome
dell’alcano con –oico, facendo
precedere la parola da acido.
• Assegnare un nome e numero ai
sostituenti.
• Il carbonio 1 è quello del carbossile
Acidi carbossilici
Sostituire la -o con –oico e far precedere
dalla parola Acido: Acido esanoico
Nominare i sostituenti:
Acido 3-metilesanoico
Nomenclatura
Nomenclatura
HO
O
OH
O
COOH
COOH
HOOC
COOH
CH3
Ac. etandioico
(Ac. Ossalico)
Ac. Ciclopentanoico
Ac. 3-metilbenzencarbossilico
Ac. Butandioico
(Ac. Succinico)
O
Br
H3C
O
COOH
H2C
COOH
COOH
COOH
H3C
Br
Ac. 2-bromopropanoico
Cl
HOOC
COOH
H
H
Ac. Propenoico
Ac. 3-oxopropanoico
Ac. 3-bromo-4-oxopentanoico
OH
O
H
C C
H
C C
H H
COOH
Ac. fumarico
(Ac. trans-2-butendioico)
Ac. trans-3-clorociclopentancarbossilico
Acido ciclopentancarbossilico
COOH
HOOC
Ac. maleico
(Ac. cis-2-butendioico)
Acidi bicarbossilici a catena alifatica
Acidi carbossilici
Proprietà fisiche
• I primi termini della serie sono liquidi incolori con
odori pungenti o sgradevoli.
• Composti polari e, come gli alcoli, formano legami
idrogeno con se stessi o con altre molecole.
• Di conseguenza: punti di ebollizione elevati, più
elevati degli alcoli di pari peso molecolare.
[es. l'acido acetico e l'alcol propilico hanno lo stesso
peso formula (60) e bollono rispettivamente a 118°C
e 97°C].
Proprietà fisiche
Gli acidi carbossilici formano dimeri nei quali le due unità sono tenute
saldamente insieme da due legami idrogeno:
Salificazione
Gli acidi carbossilici reagiscono con le basi forti per formare dei sali.
Esempi per la nomenclatura:
Acidi carbossilici
Acidi carbossilici
I derivati degli acidi
carbossilici
Composti nei quali l'ossidrile carbossilico è stato
sostituito da altri gruppi. Esteri e ammidi sono
molto diffusi in natura.
Hanno la caratteristica di dare, per idrolisi, i
corrispondenti acidi carbossilici.
Cloruro acilico
anidridi
I derivati degli
acidi carbossilici
ammidi
Estere
nitrili
Acidi carbossilici
Acidi carbossilici
Acidi carbossilici
Gli acidi carbossilici si dissociano in acqua dando luogo ad un
anione carbossilato ed uno ione idronio:
Con costante di
acidità:
Ka =
[RCO2-][H3O+]
[RCO2H]
Risonanza
Perché gli acidi carbossilici sono tanto più acidi degli alcoli e dei fenoli?
Soprattutto per la possibilità di delocalizzare per risonanza la carica, negli
anioni che si vengono a formare.
es. l'acido acetico è 1011 volte, cioè cento miliardi di volte, più acido
dell'etanolo.
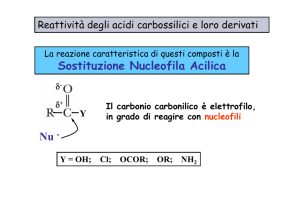
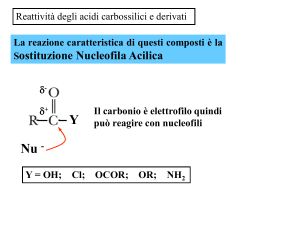
Reazioni degli Acidi carbossilici
Analogamente ad alcoli e fenoli, gli acidi carbossilici si
ionizzano perdendo un H dall'ossidrile, ma sono molto più acidi
perché possono delocalizzare per risonanza la carica negativa
sui due ossigeni del carbossile, ciascuno dei quali porta, quindi,
metà carica. Questa stabilizzazione dovuta alla risonanza fa si
che la reazione
RCOOH
RCOO- + H+
sia più spostata verso destra
e porti ad una maggiore
formazione di ioni H+, rispetto
alla corrispondente reazione
di un alcol che porta alla
formazione
dello
ione
etossido.
Risonanza
La carica negativa è egualmente dispersa sui due atomi di ossigeno, quindi ogni
atomo di ossigeno dello ione carbossilato ne porta soltanto la metà.
Nell'acido formico i due legami carbonio-ossigeno hanno lunghezze
diverse, mentre nel formiato di sodio i legami carbonio-ossigeno
dello ione sono identici (la lunghezza è intermedia fra un legame
semplice e un legame doppio carbonio-ossigeno).
Reazioni degli Acidi carbossilici
Gli ioni fenossido sono, analogamente agli ioni carbossilato,
stabilizzati per risonanza, ma i fenoli sono molto meno acidi
degli acidi carbossilici perché le forme limite dell’ibrido di
risonanza dello ione fenossido non sono tutte equivalenti.
In alcune la carica negativa si trova sul carbonio anziché
sull’ossigeno ed in queste si perde l’aromaticità del sistema.
Nello ione carbossilato, invece le forme di risonanza sono
equivalenti.
Effetto induttivo
Analogamente agli alcoli, il gruppo funzionale che si ionizza è
sempre lo stesso, quindi l'acidità dipenderà da quali altri gruppi
sono presenti sulla molecola.
Nello ione carbossilato la carica si disperde su entrambi gli O
delocalizzandosi per risonanza e stabilizzando la molecola.
In questo caso i due legami con l'O, che hanno lunghezza
diversa (1.23 Å il legame doppio e 1.36 Å il singolo), diventano
di uguale lunghezza (1.27 Å).
Nei cloroderivati del CH3COOH, la maggiore elettronegatività
del Cl disperde la carica negativa su un numero maggiore di
atomi, stabilizzando ulteriormente la molecola.
Effetto induttivo della
risonanza
• Fra acidi carbossilici le acidità possono variare a seconda degli altri gruppi
presenti nella molecola.
• es. tra l'acido acetico e gli acidi mono-, di- e tricloroacetico, l'acidità aumenta
di 10 000 volte.
• È l'effetto induttivo dei gruppi vicini al carbossile.
Effetto induttivo della risonanza
L’effetto trasmette la carica lungo i legami, polarizzando gli elettroni di
legame in direzione degli atomi più elettronegativi (ovvero in direzione opposta
rispetto agli atomi più elettropositivi).
Effetto induttivo
Il legame ClC diventa polare con il (C +) ed il (Cl -), rispetto a quanto
avveniva con CH3COOH non sostituito. Quanti più sono gli atomi di Cl, tanto
maggiore è la delocalizzazione della carica e maggiore la forza dell'acido.
Se il Cl (o un altro atomo molto elettronegativo) è posizionato su un
carbonio più lontano dal carbossile, l’effetto induttivo è molto minore e si
riduce ulteriormente con l’aumentare la distanza dal gruppo carbossilato.
Quindi l’acido 2-clorobutanoico è molto più acido del 3-clorobutanoico.
_
_
_
O
H3C
O
Acetato
_
_
Cl
+
C
H2
O
O
Cloroacetato
_
Cl
+
HC
_
Cl
O
O
Dicloroacetato
_
_
Cl
Cl_
Cl
+
O
O
Tricloroacetato
acidi bicarbossilici
COOH
COOH
COOH
COOH
COOH
CH2
CH2
CH 2
ac. etan-dioico
CH2
COOH
ac. ossalico
ac. propan-dioico COOH
ac. malonico
ac. butan-dioico
ac. succinico
CH 2
CH 2
COOH
ac. pentan-dioico
ac. glutarico
ac. trans-buten-dioico
ac. fumarico
CH2
CH2
C
HOOC
COOH
COOH
H
C
H
ossidazione (-2H)
riduzione (+2H)
COOH
COOH
H
C
C
ac. cis-buten-dioico
ac. maleico
H
COOH
COOH
COOH
O
OH
acido o-idrossi-benzoico
acido salicilico
O C
aspirina
acido acetil-salicilico
CH3
Acidi carbossilici
Derivati degli Acidi carbossilici:
Esteri
• L’OH del carbossile viene sostituito con un
gruppo -OR.
• Sostituire con –ato la desinenza dell’acido
(-ico).
• Far seguire il nome del radicale R del
gruppo –OR, con la desinenza –ile.
Etanoato di propile Propanoato di etile
Questa parte viene
trattata come una
ramificazione (-ile)
Osservare questo Carbonio.
E’ il carbonio carbonilico dell’acido originale,
cui viene data la desinenza –ato.
Esteri
Derivano dagli acidi per sostituzione del gruppo OH con un gruppo OR e
danno origine al profumo di molti frutti e fiori.
La nomenclatura è analoga a quella dei sali: prima si mette il nome della
componente acida, con la desinenza -ico cambiata in -ato, poi quello del
radicale R del gruppo -OR.
Derivati degli Acidi carbossilici:
Esteri
Butanoato di propile
Isopropil propanoato
Derivati degli Acidi carbossilici:
Esteri
Esterificazione di Fischer
la sostituzione nucleofila acilica
Se un acido carbossilico e un alcol vengono riscaldati in presenza di un
catalizzatore acido (di solito HCI o H,SO,),
si instaura un equilibrio tra l'estere corrispondente e l'acqua.
L’ossigeno dell’estere non viene dall’H2O ma dall’alcol:
Meccanismo dell’esterificazione
l'acqua si forma dall'ossidrile dell'acido e dall'idrogeno dell'alcol.
Non si tratta di
una sostituzione
diretta
è un processo in
due stadi: (1) di
addizione nucleofila
e (2) di
eliminazione.
Derivati degli Acidi carbossilici:
Esteri
In questa reazione l'acido carbossilico perde l'ossidrile, e
l'alcol perde l'H.
Il C del carbonile è ibridato Sp2 (trigonale) ed anche al
termine della reazione è ibridato Sp2 passando, però,
attraverso un intermedio tetraedrico neutro ibridato Sp3 nel
quale il carbocatione centrale è legato a 4 gruppi.
O
OH
R
Ibrido sp2
+
OH
R
HO
R
OH
OR'
Ibrido sp3
R
O
OR'
Ibrido sp2
Saponificazione ed ammonolisi
degli esteri
L'idrolisi alcalina degli esteri si chiama saponificazione, perché un
processo di questo tipo serve per preparare i saponi dai grassi
Il meccanismo è un esempio di
sostituzione nucleofila acilica:
L'ammoniaca trasforma gli esteri in ammidi per ammonolisi:
La saponificazione comporta l'attacco nucleofilo da parte
dello ione idrossido, che è un nucleofilo forte, sul
carbonio carbonilico dell'estere.
Il passaggio chiave è l'addizione nucleofila al gruppo
carbonilico.
Riduzione degli esteri
Gli esteri possono essere ridotti ad alcoli primari dal litio
alluminio idruro (LiAlH4).
È possibile ridurre il solo carbonile estereo anche in presenza di un legame
C=C, nella stessa molecola, che resta inalterato. Per esempio:
Derivati degli Acidi carbossilici:
Esteri
Derivati degli Acidi carbossilici:
Anidridi
Anidridi
Derivano dagli acidi per eliminazione di
acqua (condensazione) da due gruppi
carbossilici.
Nei confronti dei nucleofili esse sono più
reattive degli esteri, ma meno reattive degli
alogenuri acilici. Fra le reazioni caratteristiche
dell'anidride acetica vi è anche la sintesi
dell’aspirina:
aspirina
Acidi carbossilici e derivati
Ammidi
Sono estremamente diffuse in natura e sono, tra i derivati
degli acidi carbossilici, i composti meno reattivi. Le ammidi più
importanti sono le proteine.
RCOOH +
Acido
NH3
ammoniaca
RCOO-NH4+
sale di ammonio
calore
RCONH3 + H2O
ammide primaria
Acidi carbossilici e derivati
Ammidi
• Il nome è quello del composto che
contiene il gruppo acilico, si elimina
il termine Acido e la desinenza –oico
e la si sostituisce con "ammide“.
• Qualora all'N siano legati gruppi
alchilici, il nome è preceduto da "Nalchi-”.
Ammidi
Le ammidi hanno geometria piana
e, sebbene il legame carbonio-azoto venga comunemente scritto come
legame semplice, la rotazione risulta parzialmente impedita.
La risonanza fa si che il legame carbonio-azoto si comporti come legame
doppio. Quindi l'azoto, il carbonio carbonilico e gli atomi ad essi legati
giacciono sullo stesso piano. Nelle ammidi il legame C-N misura solo 1,32A
ed è molto più corto del comune legame semplice carbonio-azoto (che è di
circa 1,47A).
Come si può dedurre dalla forma di risonanza dipolare, le
ammidi sono composti altamente polari e danno forti
interazioni di tipo ponte H.
La geometria delle ammidi e la possibilità di instaurare ponti H sono
alla base delle strutture secondarie e terziarie di tutte le proteine
e quindi delle loro funzioni specifiche.
Acidi carbossilici e derivati
Ammidi
Le ammidi possono essere primarie, secondarie o terziarie a
seconda di quanti gruppi sono legati all'atomo di azoto.
Formula:
RC=O
H N H
Ammide primaria
RC=O
H NR'
Ammide secondaria
RC=O
R''NR'
Ammide terziaria
Acidi carbossilici e derivati
Ammidi
Sebbene il legame C-N sia un legame semplice, la rotazione è
parzialmente impedita a causa della risonanza.
°°
O °°
R
H
°°
°° O
°°
H
R
°°
N
H
N H+
H
La forma dipolare è così importante che il legame CN si
comporta come un doppio legame, le ammidi hanno, quindi
geometria piana e la lunghezza di legame è di 1,32 Å a
differenza del legame semplice CN che è di 1.47 Å.
Acidi carbossilici e derivati
Ammidi
Acidi carbossilici e derivati
Ammidi
Acidi carbossilici e derivati
Ammidi
O
H3C
C
H2
NH2
H3C
Propanammide
(Propionammide)
NH2
H
O
O
O
O
Metanammide Etanammide
(Formammide) (Acetammide)
H3C
H2
C
H3C
N,N-dimetiletanammide
(N,N-imetilacetammide)
H H
C C
O
C
H2
Butanammide
N
CH3
CH3
N-metiletanammide
(N-metilacetammide)
NH2
H3C
N
H
CH3
NH2
NH2
HC
C C
H H
O
Benzammide
(Benzencarbossammide)
CLASSIFICAZIONE DEI
LIPIDI
fosfolipidi
glicolipidi
LIPIDI
monogliceridi
gliceridi
digliceridi
trigliceridi
steroidi
colesterolo
ormoni steroidei
• I lipidi sono un gruppo di sostanze organiche insolubili in acqua
e più leggeri di essa.
• Nei vertebrati lo zucchero in eccesso rispetto a quanto se ne
può accumulare sottoforma di glicogeno, viene immagazzinato
sotto forma di grassi.
• Anche le piante immagazzinano energia sotto forma di oli, nei
semi e nei frutti.
• Grassi e oli hanno più legami carbonio - idrogeno rispetto ai
carboidrati, quindi contengono più energia.
FUNZIONE DEI LIPIDI
• I lipidi possono avere tre funzioni:
• FUNZIONE ENERGETICA DI RISERVA (gliceridi)
• FUNZIONE STRUTTURALE ( colesterolo, fosfolipidi e
glicolipidi)
• FUNZIONE REGOLATRICE (colesterolo e ormoni steroidei)
STRUTTURA DEI LIPIDI
• I gliceridi sono dei grassi formati da una molecola di glicerolo e
fino a 3 molecole di acidi grassi.
• Glicerolo e acidi grassi sono legati tra loro tramite una
reazione di condensazione.
• I gliceridi prendono il nome di monogliceridi, digliceridi o
trigliceridi a seconda che vi siano 1, 2 o 3 molecole di acidi
grassi legati al glicerolo.
• I trigliceridi sono i più comunemente presenti nei grassi animali
e vegetali.
• Un acido grasso nella cui molecola non compaiono doppi legami
si dice saturo.
• Se nella catena c’è uno o più doppi legami, l’acido grasso è
detto insaturo.
• La presenza di uno o più doppi legami influisce sulle proprietà
dei lipidi: i grassi insaturi sono liquidi a temperatura ambiente
(olio), quelli saturi sono invece solidi (sego). Il burro contiene
sia grassi saturi che insaturi ed infatti, a temperatura
ambiente è morbido.
LIPIDI SEMPLICI: GLICEROLO + ACIDI GRASSI (detti TRIGLICERIDI)
legame ESTEREO
LIPIDI COMPLESSI
H
CH2-O- CO-(CH2)n-CH3
H
CH2-O-CO-(CH2)n-CH3
O
H
glicerolo
lipidi semplici che contengono composti aggiuntivi:
- elementari (fosforo, azoto, zolfo)
- piccoli composti di carbonio idrofilici (zuccheri,
etanolammina, serina, colina)
O
-O
C
CH2-O-P-O-R
R
acido grasso
OTRIGLICERIDI
(legame ESTEREO)
FOSFOLIPIDE
I trigliceridi
I fosfolipidi: fosfatidilicolina
parte polare
parte non
polare
gruppo
ossidrilico
O
H2-C-OH
H--C-OH
H2-C-OH
O
+
HO C - (CH2)n- CH3
gruppo
carbossilico
H2-C
O C - (CH2)n- CH3
H--C-OH
H2-C-OH
I GLICOLIPIDI
• In questi composti il glicerolo porta due sole catene di acidi
grassi; il terzo atomo di carbonio si lega ad un carboidrato che
può essere formato da 1 a 15 zuccheri semplici.
• Anche in questo caso la testa del glicolipide è idrofila, mentre la
coda di acidi grassi è idrofoba.
• Anche i glicolipidi hanno importanza fondamentale all’interno
delle membrane cellulari.