Introduzione alla proteomica
Prof. Mauro Fasano
[email protected]
http://busto.dipbsf.uninsubria.it/cns/fasano
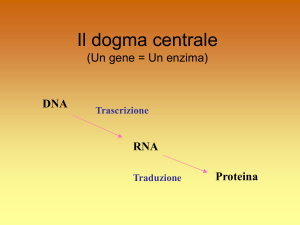
Il dogma centrale
(Un gene = Un enzima)
DNA
Trascrizione
RNA
Traduzione
Proteina
Il dogma centrale
(Un gene = Un enzima)
DNA
Trascrizione
RNA
RNA
Proteina
Regolazione
Proteina
Proteina
Proteoma
Si definisce proteoma il complemento tempo- e cellulo- specifico del genoma.
Proteome = Proteins encoded by the genome
Il proteoma comprende tutte le proteine espresse nello stesso momento in una
cellula allo stesso tempo, incluse tutte le isoforme e le modificazioni posttraduzionali.
Mentre il genoma è costante per una data cellula ed identico per tutte le cellule
di un organismo, e non cambia molto all’interno della specie, il proteoma è
molto dinamico nel tempo e in risposta a fattori esterni, e differisce in
maniera sostanziale tra i diversi tipi cellulari.
Il genoma è costante, il proteoma no…
Proteoma
• L’insieme di proteine codificate dal genoma
• Tutte le isoforme, modificazioni, interazioni
delle proteine
• Come sopra, ma in funzione di un certo stato
(malattia, trattamento, tempo, ecc.)
40000 Geni 1 Milione di Proteine
Perché identificare il pattern di
espressione proteica ?
• Non c’è correlazione tra quantità di mRNA e
quantità di proteina (Gygi et al., 1999)
• Il proteoma è un’istantanea del fenotipo a
livello biochimico
• Il proteoma tiene conto del processing delle
proteine
S.P.Gygi et al., Mol. Cell. Biol. 19, 1720 (1999)
Homo sapiens:6.000.000 kbp
E. coli:
4700 kbp
Se tutto il DNA umano codificasse la sintesi di proteine,
ci sarebbero 10 milioni di proteine, contro le 3000 note
Geni (Esoni, introni, snRPs, RNA catalitico)
Genoma
Famiglie multigeniche
Pseudogeni
Fattori di regolazione
Tandem repeats, sequenze palindromiche
Multigenicità
L’espressione di una singola proteina
dipende da più geni
• Fattori di trascrizione
• Enhancers in trans
• Sequenze di controllo
• Cromatina
• Metilazione del DNA
• Proteine regolatrici
• Modificazioni post-traduzionali
• Chaperonine
• Trasporto e secrezione
• Degradazione
Pleiotropia
Un singolo gene influenza
il destino di più proteine
La trascrizione e la traduzione del gene avvengono
attraverso il coinvolgimento di proteine che a loro volta
influenzano la trascrizione e la traduzione di altri geni
Variazioni somaclonali
Variazioni indesiderate del
genoma che vengono trasmesse
alle generazioni successive
•Instabilità genomica
•Variazione dinamica del fenotipo
Modificazioni post-traduzionali
•
•
•
•
•
•
•
•
Acetilazione, metilazione
Fosforilazione
Glicosilazione (enzimatica)
Glicazione (non enzimatica)
Nitrazione/denitrazione
Cleavage
Protein splicing
Tagging
La Proteomica studia tutti i complementi proteici, i
proteomi, che derivano dai vari tessuti o tipi cellulari.
Al giorno d’oggi, la proteomica può essere divisa in
proteomica classica e proteomica funzionale.
Proteomica & Genomica Funzionale
La Proteomica classica concentra il suo interesse sullo
studio dei proteomi completi, mentre la proteomica
funzionale studia gruppi più limitati di proteine.
Le tre domande più importanti della proteomica sono:
1) Quali proteine sono presenti in una cellula o in un
tessuto?
2) Con quali altre proteine interagisce la mia proteina di
interesse (network)?
3) Come appare una particolare proteina (struttura)?
L’APPROCCIO CLASSICO
SOLUBILIZZAZIONE DEL CAMPIONE
IEF
SDS - PAGE
VISUALIZZAZIONE DEI RISULTATI
ANALISI DEI GEL
SPETTROMETRIA DI MASSA (MALDI)
L’APPROCCIO CLASSICO
SOLUBILIZZAZIONE DEL CAMPIONE
IEF
SDS - CON
PAGE
UREA 7M, TIOUREA
VISUALIZZAZIONE
2M, CHAPS DEI
4% RISULTATI
ANALISI DEI GEL
SPETTROMETRIA DI MASSA
L’APPROCCIO CLASSICO
SOLUBILIZZAZIONE DEL CAMPIONE
IEF
SDS - PAGE
VISUALIZZAZIONE DEI RISULTATI
ANALISI DEI GEL
SPETTROMETRIA DI MASSA
L’APPROCCIO CLASSICO
SOLUBILIZZAZIONE DEL CAMPIONE
IEF
SDS - PAGE
VISUALIZZAZIONE DEI RISULTATI
ANALISI DEI GEL
SPETTROMETRIA DI MASSA
L’APPROCCIO CLASSICO
SOLUBILIZZAZIONE DEL CAMPIONE
IEF
SDS - PAGE
VISUALIZZAZIONE DEI RISULTATI
ANALISI
DEI GEL
•immunoblotting
SPETTROMETRIA DI MASSA
•colorazione con Blue di Coomassie
o silver staining
L’APPROCCIO CLASSICO
SOLUBILIZZAZIONE DEL CAMPIONE
IEF
SDS - PAGE
VISUALIZZAZIONE DEI RISULTATI
ANALISI DEI GEL
SPETTROMETRIA DI MASSA
L’APPROCCIO CLASSICO
SOLUBILIZZAZIONE DEL CAMPIONE
IEF
SDS - PAGE
VISUALIZZAZIONE DEI RISULTATI
ANALISI DEI GEL
SPETTROMETRIA DI MASSA (MALDI)
Elettroforesi bidimensionale (2-DE)
Principi della 2-D
elettroforesi
• I dimensione
Isoelettrofocusing in
condizioni denaturanti:
separazione in base al
punto isoelettrico
• II dimensione
SDS elettroforesi:
separazione in base al
peso molecolare
Elettroforesi bidimensionale (2-DE)
Vantaggi
• Possibilità di caricare campioni non purificati
• Risoluzione estremamente alta
• I gel 2 –DE sono collettori di frazioni
proteiche molto efficienti
• Proteine sono protette all’interno della
matrice del gel
Problematiche
• Gradiente di pH
• Limiti nel determinare proteine poco
rappresentate
• Capacità di caricare campione
• Proteine idrofobiche
• Proteine ad alto peso molecolare