Aspetti termodinamici e cinetici
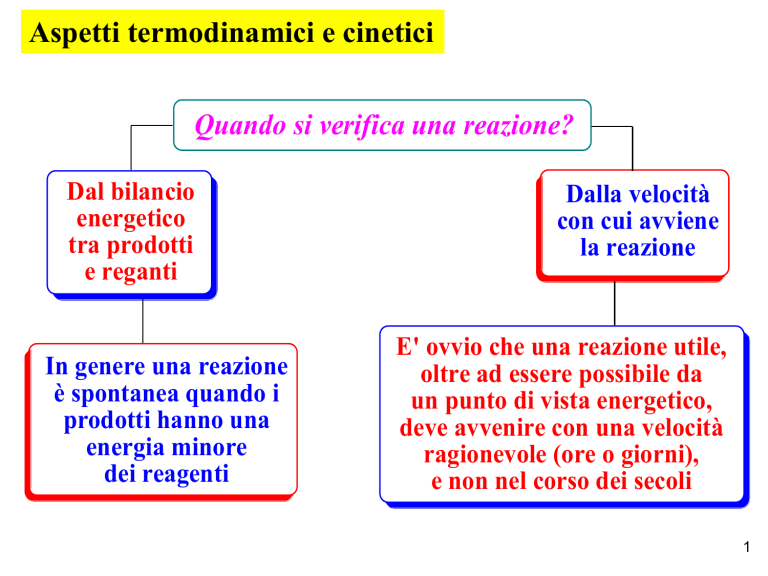
Quando si verifica una reazione?
Dal bilancio
energetico
tra prodotti
e reganti
In genere una reazione
è spontanea quando i
prodotti hanno una
energia minore
dei reagenti
Dalla velocità
con cui avviene
la reazione
E' ovvio che una reazione utile,
oltre ad essere possibile da
un punto di vista energetico,
deve avvenire con una velocità
ragionevole (ore o giorni),
e non nel corso dei secoli
1
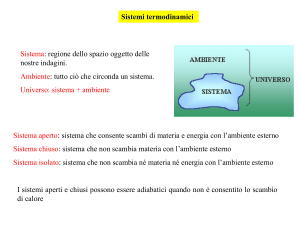
Riassumendo, di fronte ad un sistema chimico occorre
saper rispondere alle seguenti domande
1) In che direzione reagisce il sistema?
Variazione di energia
2) Con che velocità reagisce?
Cinetica di reazione
3) Come avviene la reazione?
Meccanismo di reazione
-Variazione di energiaIl calore sviluppato o assorbito in una reazione chimica
a Temperatura e Pressione costante è chiamato
calore di reazione o variazione di entalpia
e si indica con il segno DH
2
Si possono avere due casi:
entalpia H
CH4 + 2O2
CO2 + 2H2O DH = -192 kcal/mol
CH4 + 2O2
-DH
CO2 + 2H2O
coordinata di reazione
Hp - Hr = -DH reazione esotermica
3
_
entalpia H
CH3 CH3
Pd
CH2=CH2 + H2 DH = 28 kcal/mol
CH2=CH2 + H2
CH3_CH3
+DH
coordinata di reazione
Hp - Hr = +DH reazione endotermica
4
-EntropiaSpesso si osserva che le reazioni chimiche procedono
spontaneamente nella direzione che si sviluppa calore
Reazione Esotermica = spontanea (in realtà non è sempre vero)
Ad esempio l’evaporazione dei liquidi sono processi
spontanei anche se endotermici
Ciò significa che esiste un altro fattore di cui bisogna tener
conto per sapere se una reazione è spontanea
Cioè oltre al fattore energetico (Entalpia, H) nelle
trasformazioni chimiche bisogna tener conto anche del fattore
entropico (Entropia, S)
5
Un sistema chimico infatti tende:
1) Ad uno stato in cui il suo contenuto termico sia minimo
2) Ad uno stato in cui il disordine molecolare sia
massimo, come avviene nei passaggi di stato:
Stato solido
Stato liquido
Stato gassoso
E' chiaro che la reazione avviene
spontaneamente nella direzione che
permette di raggiungere uno stato
di compromesso ottimale
6
REAGENTI
PRODOTTI
in cui la libertà delle
molecole è maggiore di
quella dei reagenti
avviene con una
variazione
positiva di entropia (+DS)
FAVORITE
PRODOTTI
in cui la libertà delle
molecole è minore di
quella dei reagenti
avviene con una
variazione
negativa di entropia (-DS)
SFAVORITE
7
Un sistema tende a reagire
in modo da raggiungere
Il minimo
contenuto
termico,
minimo valore
di entalpia H
Il massimo
disordine,
massimo valore
di entropia S
Reazione spontanea DG < 0
DG = DH – TDS
Equazione di Gibbs-Helmholtz
In pratica per reazioni che a temperatura ambiente
hanno un elevato valore negativo di entalpia
(DH ~ -15 kcal/mole) il termine -TDS non riesce a ribaltare
il segno cosicchè, di fatto
le reazioni fortemente esotermiche hanno anche un DG
negativo e procedono da sinistra verso destra
A + B
C + D
DG < 0
E’ chiaro che se una reazione mostra un
DG > 0
la reazione sarà spontanea in senso inverso
9
-Velocità di reazione Fino adesso abbiamo visto l’aspetto energetico delle
reazioni chimiche, e siamo in grado di sapere in che
direzione tende a muoversi un sistema
Spesso si verifica il fatto che una reazione chimica, con
un DG favorevole alla formazione dei prodotti, avviene
con una velocità talmente piccola da essere trascurabile
CH4 + 2O2
CO2 + 2H2O DH = -192 kcal/mol
A T° ambiente (25 °C) la miscela può essere tenuta per
anni senza che si noti la formazione dei prodotti, cioè ha
una velocità molto bassa
10
Se la reazione viene innescata
-alta temperatura-fiamma o scintillala velocità di reazione diventa
elevata al punto di trasformare la
combustione in un fenomeno
esplosivo
CH4 + 2O2
CO2 + 2H2O DH = -192 kcal/mol
11
La velocità di reazione (dato sperimentale) è data
dalla quantità di C che si forma nell’unità di tempo
o (il che è equivalente), dalla quantità di A e B che
scompaiono nell’unità di tempo
A + B
v = k [A]x [B]y
C
(k = costante di proporzionalità)
L’ordine di reazione, è dato dalla somma degli
esponenti (x+y) delle concentrazioni dei vari reagenti
che entrano a far parte nell’equazione di velocità
12
-Energia di attivazione Affinché i reagenti, in una reazione chimica, possono
scontrarsi per reagire e trasformarsi in prodotti (urto
efficace) devono avere una energia superiore all’energia
media del sistema
Esiste cioè una barriera energetica, che deve essere
superata perché possa avvenire la reazione, tale barriera
viene chiamata energia di attivazione, e viene indicata
con il simbolo
Eatt
÷
D G‡
÷
D H‡
13
Le reazioni chimiche sono accelerate da un aumento di
temperatura in modo molto netto, al punto di raddoppiare la
loro velocità per un aumento di temperatura di 10 °C
Ciò è dovuto al fatto che un piccolo aumento di temperatura
aumenta di molto la frazione di molecole che hanno un energia
maggiore o uguale all’energia di attivazione
.
... .. .. ..... ..
. . .
. .
.. .. .. ..... ..
. . .
. .
.. .. .. ..... ..
. . .
. ... ..
.. ... . .... ..
. .
.. .. .. ..... ..
. . .
T1
T1+ 10 °C
T1+ 20 °C
. .
.. .. .. ..... ..
. . .
Questo comporta ovviamente un aumento della
velocità di reazione
14
Un altro sistema per accelerare una reazione
consiste nell’abbassare la soglia energetica da
superare perché la reazione avvenga
Questo scopo viene raggiunto impiegando un
catalizzatore
Un catalizzatore infatti si combina, in modo
temporaneo, con i reagenti e forma uno stato di
transizione con una energia di attivazione minore
dell’energia di attivazione della reazione non
catalizzata
15
Energia
Eatt
*Eatt
reagenti
prodotti
Coordinata di reazione
*Eatt della reazione con catalizzatore
Eatt della reazione senza catalizzatore
16
Stato di transizione
‡
Energia
Eatt
L’insieme
degli atomi
nel punto di
massima si
chiama stato
di transizione
Ereagenti
Eprodotti
DH < 0
Progresso della reazione dai reagenti verso i prodotti
Nello stato di transizione gli atomi non sono più legati come lo
erano nei reagenti, ma non si sono ancora trasformati in prodotti
Eatt deve essere determinata sperimentalmente per ogni reazione
17
18