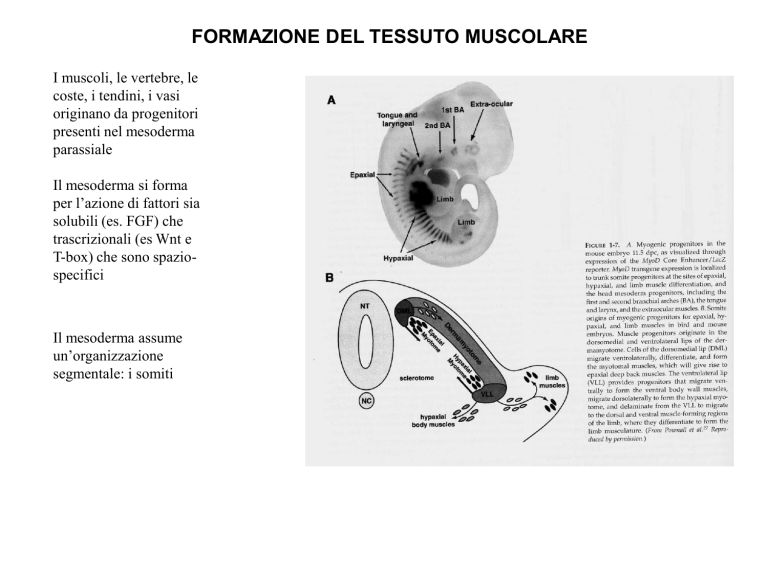
FORMAZIONE DEL TESSUTO MUSCOLARE
I muscoli, le vertebre, le
coste, i tendini, i vasi
originano da progenitori
presenti nel mesoderma
parassiale
Il mesoderma si forma
per l’azione di fattori sia
solubili (es. FGF) che
trascrizionali (es Wnt e
T-box) che sono spaziospecifici
Il mesoderma assume
un’organizzazione
segmentale: i somiti
Da ciascun somite
originano specifici
muscoli
La formazione delle “bozze” muscolari richiede migrazione delle cellule staminali
La migrazione è controllata da fattori trascrizionali (Pax 3) e segnali extracellulari
Ruolo fondamentale di SF-HGF (scatter factor-hepatocyte growth factor) la cui espressione è
sotto controllo di FGF e Shh
Il recettore di HGF (c-met) è sotto controllo trascrizionale di Pax3
Le cellule mesodermiche
sono pluripotenti destinate a
“cell fate specification”
Concetto di “Cell Fate
Specification”: formazione di linee
cellulari da progenitori pluripotenti
che progressivamente perdono la
pluripotenzialità e acquisiscono
proprietà di “lineage” definitive
Fattori induttivi locali, diversi in
varie porzioni del corpo,
determinano “cell fate specification”
Muscle Regulatory Factors
Gli MRF sono fattori trascrizionali
MyoD:
Una volta attivo rimane autoregolato (permanente)
Myf5:
precoce e transitorio (regolazione diversa in varie parti, vedi figura)
Myogenin: tardivo, importante durante il differenziamento
MRF4:
tardivo, importante durante il differenziamento
Controllo della proliferazione dei mioblasti
I mioblasti sono progenitori proliferanti differenziati che esprimono Myf5 e MyoD
Fattori che controllano la proliferazione dei mioblasti: mitogeni, FGF, TGFb, IGF,
integrine
I mioblasti vengono sottratti al ciclo cellulare per attivazione di myogenin, MRF4,
MEF2
Controllo del differenziamento
Il differenziamento implica il controllo trascrizionale di geni per proteine muscolospecifiche
Fattori trascrizionali che regolano il differenziamento:
•Myogenin
•MRF4
•Mef2
I fattori trascrizionali di differenziamento si legano a promotori altamente conservati
tra specie e geni.
In una prima fase il differenziamento è reversibile
Il differenziamento diventa irreversibile quando i mioblasti si fondono con i miotubi
Induzione di competenze e specificità muscolari
Ion channels and myogenesis
Myoblast
Fusion-competent
myoblast
Myotube
nAChR
ec-coupling mechanism
Cellule muscolari in coltura: la colorazione marrone indica l’espressione di una proteina presente solo nei
miotubi differenziati
Notare la presenza di numerosi nuclei nei miotubi
Le cellule miogeniche non differenziate non sono colorate e si intravedono come ombre grigie
Progressione nella maturazione del tessuto muscolare
Mioblsti → miotubi → fibre muscolari
Cellule muscolari in coltura. Per avviare il filmato fare doppio click su ciascuna immagine
A dx immagine in contrasto di fase; si vedono le contrazioni
A sin: variazioni della concentrazione dello ione calcio all’interno di cellule in contrazione. La variazione è
indicata dal passaggio dal colore blu a quello giallo
Le due immagini sono delle stesse cellule ma le riprese sono in momenti diversi; alcune delle celule che si
contraggono nell’immagine di sinistra, non lo fanno nell’immagine di destra e viceversa.
FATTORI DI CRESCITA E CELLULE SATELLITI
Nel muscolo adulto esiste una quota di cellule capaci di proliferare e di differenziarsi
DAPI
M-caderina
Desmina
Fibra muscolare isolata
in celeste si vedono i nuclei che appartengono alla fibra muscolare ad
eccezione di uno che in B è colorato in rosso e che appartiene ad una cellula
satellite
Controllo della proliferazione delle cellule satelliti
Il passaggio dalla fase quiescente alla proliferativa richiede fattori di competenza e di progressione
Riposo o Go
→
ingresso in G1
→
progressione a mitosi
Fattore di competenza
Fattore di progressione
Fattori di competenza:
FGF
•legato a proteoglicani della lamina basale, rilasciato dopo lesioni
•L’espressione aumenta dopo lesione, in ipertrofia
•Agisce su cellule satelliti, ma anche su innervazione, vascolarizzazione, fibroplasia
Fattori di progressione
IGF
•Due isoforme, dette IGF-I e IGF-II
•IGF-I è il mediatore degli effetti di GH; IGF-II induce proliferazione cellule miogeniche
durante lo sviluppo
•E’ trasportato via sangue dove è legato a proteine di trasporto;
•Desametazone (Cortisonico) potenzia le risposte da IGF
•Da solo induce differenziamento
•In combinazione con FGF induce proliferazione
Fattori di controllo negativo della proliferazione delle cellule satelliti
TGF-b (transforming growth factor): inibisce la fusione in miotubi
Miostatina:
•membro di famiglia TGF; attiva sistema di proteolisi intracellulare
•anticorpi inducono ipertorfia muscolare
•la produzione di miostatina e/o suo recettore è controllata
•è un dei fattori che contribuisce all’atrofia da disuso
Fattori da contatto (presente sulla membrana delle cellule muscolari)
TNF-a (tumor necrosis factor):
•citochina coinvolta in atrofia da sepsi o tumore
•non sembra essere coinvolta nell’atrofia da disuso
Atrofia da disuso
Connessa ad attivazione di NF-kB (sistema di regolazione trascrizionale inizialmente scoperto nei linfociti B, ma poi
identificato in diversi tessuti; consente la conversione di segnali extracellulari in eventi di regolazione dell’espressione
genica)
L’ATROFIA E’ UNO SPECIFICO PROGRAMMA CELLULARE CHE RICHIEDE ENERGIA ED ESPRESSIONE
GENICA CONTROLLATA
(per maggiori e interessanti informazioni sui vari meccanismi di regolazione dell’atrofia, vedere il file pdf allegato in
rete: “05 Meccanismi atrofia muscolare review”)
Myostatin Research
Introduction
Myostatin was first described by McPherron et al in 1997. It is a gene which is a member of the Transforming Growth Factor-b (TGF-b)
Superfamily. These genes encode secreted factors that are important for regulating embryonic development and tissue homeostasis in adults.
Myostatin-null mice show a dramatic and widespread increase in skeletal muscle mass due to an increase in number of muscle fibres (
hyperplasia) and thickness of fibres (hypertrophy).
Where and When is it expressed?
During early embryogenesis myostatin is particularly important in the myotome compartment of developing somites. However myostatin also
plays an important role in fully developed skeletal muscle. Myostatin controls not only fibre size but also fibre number. Muscle which is
mechanically hypertrophied shows an increase in myostatin (Sakuma et al 2000). Conversely in regenerating muscle myostatin levels are
reduced (Yamanouchi et al 2000).
How does it work?
In many mammalian cells cell cycle progression is inhibited by members of the TGF-b superfamily. This is done by arresting the cells in the G1 phase of the cell cycle. This is mediated through the many elements of the complex cell cycle machinery.
Cyclin-dependent kinases (Cdks) regulate 'G1' transitions to 'S' through phosphorylation and inactivation of the retinoblastoma (Rb) protein.
However p21 (which is a cyclin inhibitor) suppresses the kinase activities of the Cdk2. Myostatin works by increasing the p21 activity and thus
decreasing the Cdk2 levels. This results in suppression of the Rb protein phosphorylation and concurrent cell cycle arrest of myoblasts in the
G1 phase. As the diagram shows the fibre number is then regulated.
Myostatin Mutations:
Mutations in the myostatin gene has been shown to cause double muscling in cattle (Kambadur et al 1997). Mutations in Belgian blue and
Piedmontese cattle occur in the 3rd exon of the myostatin gene. Ferrell et al 1999 showed that mutations can occur in exon 1 in the human
genotype. Interestingly two of these mutations are polymorphic in the general population.
Bibliografia
McPherron, A.C, Lawler, A. M, Lee, S. J (1987). Regulation of skeletal muscle mass in mice by a new TGF-b superfamily member. Nature.
387. 87-90.
McPherron, A. C., and Lee, S. J. (1997). Double muscling in cattle due to mutations in the myostatin gene. Proc. Natl. Acad, Sci. USA. 94.
12457-61
Thomas, M., Langley, B., Berry, C., Sharma, M., Kirk, S., Bass, J., and Kambadur, R. 2000). Myostatin, a negative regulator of muscle growth,
functions by inhibiting myoblast proliferation. J. Biol. Chem. 275(51):40235-43.
RIGENERAZIONE MUSCOLARE
La rigenerazione delle fibre muscolari è legata all’attività di
cellule satelliti e delle porzioni sopravvissute della fibra
muscolare
La risposta rigenerativa dipende dal tipo di lesione
•Focale (ago o sovraccarico): muoiono poche fibre, la
proliferazione è focale
•Estesa: proliferazione e migrazione delle cellule
satelliti anche nelle parti sane della fibra
Prime manifestazioni cellulari della necrosi muscolare
•Ipercontrazione: strappo della membrana, ingresso Calcio,
segmenti ipercontratti, densi
•Attivazione proteolisi intracellulare: in 24h la parte lesionata
scompare e lascia “tubo vuoto” di endomisio con aggregati
proteici → invasione macrofagica
•L’inizio della proliferazione e dell’invasione macrofagica
dipendono da integrità vasale (non ci sono nel muscolo
macrofagi residenti)
•L’invasione macrofagica e la rimozione dei residui sono
necessari per la rigenerazione delle fibre muscolari, per la
rivascolarizzazione, per la proliferazione delle cellule satelliti
La rigenerazione delle fibre muscolari è legata all’attività di cellule satelliti e delle
porzioni sopravvissute della fibra muscolare
Le cellule satelliti invadono la cellula muscolare morta e si accumulano nel
tubo endomisiale sia negli aggregati proteici che negli spazi vuoti
La rimozione dei residui necrotici facilita la rigenerazione
La lamina basale forma intorno alla fibra muscolare un tubo (endomisio)
Ruolo in rigenerazione dell’endomisio
•
Intrappola le cellule satelliti
•
Consente l’orientamento spaziale dei miotubi rigeneranti
•
Promuove la crescita e il differenziamento delle cellule
satelliti
•
Guida la reinnervazione
Le cellule satelliti iniziano a proliferare 30h dopo il crush
Ruolo di proteoglicani in lamina: immobilizzano FGF, PDGF e altri
fattori che sono poi liberati dopo morte cellulare
Fattori neurogeni
Durante lo sviluppo la crescita delle fibre mediata da fusione di cellule
satelliti richiede l’innervazione
Denervazione perinatale comporta la riduzione della popolazione di
cellule satelliti
Nell’adulto: la denervazione provoca proliferazione delle cellule satelliti
con picco a 4 giorni e che persiste per settimane
Attività muscolare e cellule satelliti
Nel muscolo non allenato
Sessione di corsa: raddoppio delle cellule satelliti
Sessione prolungata su treadmill: triplicano
Muscle overwork: necrosi e rigenerazione: proliferazione → fusione →
iperplasia