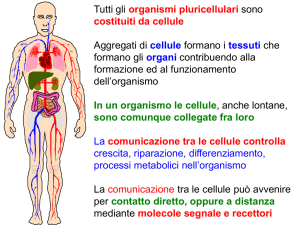
Ormoni
Definizione classica:
messaggeri chimici prodotti da tessuti
specializzati (ghiandole endocrine) che
agiscono a distanza su cellule bersaglio
(segnali endocrini)
Definizione più ampia
la capacità di produrre ormoni non è una
proprietà esclusiva delle ghiandole endocrine.
Gli ormoni possono anche agire localmente su
cellule vicine per diffusione (segnali paracrini)
o anche sulle stesse cellule che li hanno prodotti
(segnali autocrini)
In questi casi l’ormone non è secreto in circolo
Secondo questa definizione più ampia la
separazione tra ormoni e neurotrasmettitori
diventa labile
Certe molecole possono agire sia come
ormoni che come neurotrasmettitori (es:
catecolamine, ormoni ippotalamici, ipofisari,
gastro-intestinali)
I neuroni possono rilasciare in circolo ormoni
(neurormoni)
ossitocina
•
L'ossitocina è un ormone prodotto dai nuclei ipotalamici
e secreto dalla neuroipofisi
•
E’ un ormone peptidico, un nonapeptide, molto simile a
un altro ormone ipofisario, la vasopressina
•
L'azione principale dell'ossitocina è quella di stimolare le
contrazioni della muscolatura liscia dell'utero
•
Governa il "riflesso di eiezione fetale", "riflesso di
eiezione del latte", "riflesso di eiezione dello sperma”
•
Recettori dell'ossitocina si trovano anche nel sistema
limbico del cervello
•
Esperimenti su animali hanno dimostrato l'importanza di
tale ormone nell'accoppiamento, nel comportamento
parentale e sociale
Oxytocin Infusion Reduces Repetitive Behaviors in
Adults with Autistic and Asperger's Disorders
Neuropsychopharmacology (2003) 28, 193-198
Ricerche recenti sugli animali hanno evidenziato un
importante ruolo dell'ossitocina anche nello sviluppo
del comportamento sociale
Questo ha indotto alcuni ricercatori a compiere
ricerche sui soggetti autistici per evidenziare eventuali
alterazioni potenzialmente responsabili dell'alterato
sviluppo sociale
Topi privi del gene che codifica per l’ossitocina sono
indifferenti al distacco dalla madre e in generale
presentano assenza di attaccamento sociale, non
cercano la compagnia dei pari e presentano
un'aumentata aggressività
questi topi recuperano la capacità a sviluppare una
memoria sociale dopo somministrazione
intracerebrale di ossitocina
E' stata dimostrata una correlazione anche tra
ossitocina e comportamenti ripetitivi
Sulla base delle caratteristiche chimiche gli
ormoni possono essere suddivisi in quattro
gruppi:
1) derivati da un solo aminoacido:
amine e ormoni tiroidei (T3 e T4)
2) steroidei: derivati dal colesterolo
3) eicosanoidi: derivati dei grassi polinsaturi
C20 (azione autocrina e/o paracrina). Il PAF è
una molecola ad azione ormonale di
derivazione lipidica
4) peptidici a questo gruppo si possono
ascrivere anche i fattori di crescita (GF) e le
citochine che agiscono con meccanismi
autocrini e/o paracrini
Gli ormoni liposolubili (steroidei, tiroidei) attraversano
le membrane cellulari
gli ormoni proteici poco liposolubili non attraversano
le membrane cellulari
Al gruppo degli ormoni peptidici appartengono
i fattori di crescita GF e le citochine
La concentrazione plasmatica degli ormoni è 10-6 -10-12 M
Gli ormoni peptidici hanno concentrazioni più
basse rispetto agli steroidei e tiroidei
Quest’ultimi sono trasportati nel plasma legati
alle proteine palsmatiche
Anche se le catecolamine e gli ormoni peptidici
sono generalmente presenti in forma libera,
recentemente si sono trovate proteine
specifiche che legano l’ormone della crescita
(GH) e altri fattori di crescita (IGF)
Il legame trasportatore (T) ormone (H) è reversibile
(non covalente) e si crea un equilibrio:
H+T
HT
che è molto spostato verso il complesso, per cui
la frazione libera dell’ormone (forma attiva) può
essere estremamente piccola
Il complesso HT è di fatto una riserva circolante
dell’ormone e inoltre lo protegge dai
meccanismi di degradazione ed escrezione
(tempo di emivita più alto)
Tiroxina:
H = 0.02%
t1/2 = 7 giorni
Analogamente si instaura un equilibrio tra
ormone e recettore:
H+R
HR
[H] [R]
KD =
[HR]
[HR]
[H]
[RT]
[R] = [RT] - [HR]
[RT]
=
[HR]
KD
[HR] max
KD
HR = B
H=F
RT = Bmax
Se nello Scatchard plot si ottiene un andamento
non rettilineo significa che il recettore possiede
più siti a diversa affinità o che c’è cooperatività
- Saturabilità:
il numero dei recettori è piccolo
da [HR]max si ricava il numero totale dei
recettori (siti d legame)
- Elevata affinità:
KD bassa (KA alta)
KD dello stesso ordine di grandezza della
concentrazione fisiologica dell’ormone
- Elevata specificità:
un recettore lega un solo tipo d’ormone (oppure
ormoni dotati della stessa attività biologica)
Quando la concentrazione dell’ormone è
anormalmente elevata si ha il fenomeno detto
spillover in cui un ormone interagisce con il
recettore di un altro ormone
Lo spillover può generare sia un effetto agonista
che antagonista
La funzionalità e il numero dei recettori può
variare in risposta agli stimoli
Diminuzione dell’affinità: desensibilizzazione
Diminuzione del numero dei recettori:
down-regulation
Aumento del numero dei recettori:
up-regulation
La down-regulation è:
omologa se causata dallo stesso ormone a cui è
specifico il recettore
eterologa se causata da un altro ormone che
interagendo con i propri recettori ha effetti anche
su un altro recettore
Uno dei meccanismi attraverso cui si esplica la
down-regulation è quello della internalizzazione
dei recettori di membrana:
dopo stimolazione i complessi recettore-ormone
si addensano in punti della membrana dove sul
lato citosolico è presente la proteina clatrina
si creano delle invaginazioni che generano poi
delle vescicole, e i recettori sono sequestrati
all’interno della cellula e non sono più disponibili
per il legame con l’ormone
L’effetto degli ormoni si esplica su un numero
limitato di proteine: prevalentemente proteine di
regolazione
Nelle vie metaboliche esistono poche reazioni
irreversibili con DG << 0
Queste costituiscono le cosiddette tappe limitanti
La regolazione degli enzimi che catalizzano le
reazioni delle tappe limitanti risulta in un effetto
sull’intera via metabolica
La regolazione enzimatica può avvenire per
alterazione :
- della attività catalitica (veloce)
- della concentrazione dell’enzima (lenta)
La fosforilazione è il meccanismo di regolazione
più diffuso nelle cellule eucariote
Le proteine cinasi (PK) catalizzano la
fosforilazione di residui di serina nella
maggioranza dei casi (90%) e meno
frequentemente di treonina e ancora più di rado
di tirosina (0.1%)
A tutt’oggi sono state individuate più di 200
proteine cinasi suddivisibili sostanzialmente in
due grandi gruppi:
Queste PK sono state individuate di recente e
per ora se ne conoscono poche
Le PK agiscono su siti di riconoscimento
determinati dalla sequenza aminoacidica
La PK AMPc - dipendente fosforila i residui
Ser inseriti nella sequenza:
X-Arg-Arg-X-Ser-X
Le PK possono agire su una sola proteina
oppure su numerosi substrati proteici, e
sidicono allora multifunzionali
Le proteine possono essere fosforilate in un
solo sito oppure in più siti da diverse PK con
effetti sia additivi che inibitori
La fosforilazione oltre che agire direttamente
sulla attività catalitica può anche modificarne le
proprietà come la velocità di degradazione o la
localizzazione subcellulare (modificandone la
lipofilicità)
Esistono due tipi di recettori
- nucleari: ormoni steroidei e tiroidei
- membrana: ormoni peptidici, aminici,
eicosanoidi
Anche se la maggior parte degli ormoni
steroidei e tiroidei agisce a livello nucleare è
verosimile (anche se non ancora dimostrata)
l’esistenza di recettori di membrana anche per
questi ormoni
Gli ormoni steroidei sono lipofili e sono in
grado di attraversare le membrane
Esistono due ipotesi sulla localizzazione dei
recettori degli ormoni steroidei:
- citosol
- nucleo (più attuale)
In ogni caso il legame con l’ormone provoca la
trasformazione del recettore:
- distacco di proteine (proteine dello shock
termico) a cui è associato il recettore libero
- formazione di un omodimero per legame a un
altro recettore
- legame del dimero a sequenze di DNA dette
elementi di risposta dell’ormone (HRE)
Esiste una forma di recettore per ciascun tipo di
ormone steroide
Hanno caratteristiche strutturali e funzionali
simili e sono accomunati in una classe assieme
ai recettori degli ormoni tiroidei e di derivati
della vitamina D e A
Nei recettori nucleari si identificano almeno
cinque domini con specifiche proprietà
funzionali
Al dominio C compete la funzione specifica
di formare il legame col DNA grazie alla
presenza dei cosiddetti Zn finger
Gli Zn finger interagiscono con gli HRE (spesso
localizzati nella regione del promotore)
riconoscendone la specifica sequenza nucleotidica
Le sequenze consenso sono formate da 6
coppie di basi:
- palindromiche con 3 nucleotidi spaziatori
(n) per GRE e ERE
-palindromiche senza nucleotidi spaziatori o
ripetute non palindromiche per gli ormoni
tiroidei
GRE = glucocorticoidi, progesterone, androgeni
ERE = estrogeni
TREp = ormoni tiroidei, Vitamina D, Vitamina A
DR4 = ormoni tiroidei (Direct Repeat)
Si ipotizza che ciascuna molecola del dimero
recettoriale interagisca con metà palidromo (o
sequenza diretta)
Il meccanismo d’azione degli ormoni tiroidei è
analogo a quello degli steroidei
I recettori degli ormoni tiroidei si ritiene siano
saldamente legati alla cromatina diversamente da
quelli steroidei la cui localizzazione è ancora
controversa
Inoltre i recettori tiroidei non sono legati alle
proteine dello shock termico
Altra differenza è la possibilità di formare
degli eterodimeri recettoriali con i recettori
del 9-cis-retinoico
(caratteristica comune con i recettori della
vitamina D e A)
I recettori di membrana sono suddivisibili in tre
classi:
Vi sono pure dei recettori che non interagiscono con
proteine G e non possiedono di per sé attività
enzimatica, ma si pensa possano associarsi a enzimi
citoplasmatici attivandoli
I recettori che interagiscono con le proteine G
sono costituiti da polipeptidi che attraversano la
membrana sette volte
(sette eliche transmembrana)
L’estremità N-teminale è all’esterno e può essere
glicosilata
L’estremità C-terminale è all’interno e ha residui
Ser o Thr disponibili alla fosforilazione
Le proteine G sono costituite da tre subunità: a, b, g ancorate alla membrana
La sub-unità a ha un sito di legame per i
nucleotidi guanilici:
- legato a GDP è in forma inattiva si ancora
alle sub-unità b e g e forma un complesso
inattivo
- legato a GTP è in forma attiva e si dissocia
dalle sub-unità b e g
La sub-unità a possiede una intrinseca
attività GTPasica ed è quindi in grado di
idrolizzare lentamente il GTP legato
autoinattivandosi
La velocità della reazione GTPasica determina il
tempo durante il quale l’effettore rimane attivo
La GTPasi della sub-unità a è una sorta di timer
che controlla un interruttore
Esistono numerosi tipi di proteine G, e ognuna
può regolare uno specifico effettore (anche più
di uno)
Differiscono principalmente per la diversa subunità a
L’AMPc è stato il primo “secondo messaggero”
scoperto
Lo schema d’azione è:
H
R
G
AC
AMPc
PKA
Esistono diversi isoenzimi di AC, ma tutti sono
enzimi transmembrana che presentano il sito
catalitico sul lato citosolico che promuove la
conversione di ATP in AMPc:
La PKA nello stato inattivo è un tetramero
costituito da due unità regolatrici R con ciascuna
due siti di legame per l’AMPc e due unità
catalitiche C
R2C2 + 4AMPc
R2(AMPc)4 + 2C
Il legame con AMPc promuove il distacco
delle unità C che sono poi le responsabili
dell’attività di fosforilazione
La cascata della via dell’AMPc non comporta
solo la trasduzione del segnale, ma anche una
amplificazione:
il complesso HR può attivare circa 10 proteine Gs
ognuna di queste può mantenere attiva l’AC per
un tempo (prima dell’idrolisi di GTP) tale da
produrre circa 100 molecole di AMPc
l’amplificazione risultante è di 103
Una ulteriore amplificazione si verifica se la PKA
fosforila più di una proteina
Caratteristiche peculiari di questa via sono:
- rapidità
- transitorietà
la risposta allo stimolo ormonale ( AMPc)
avviene in pochi minuti (2-5) dopodichè si ha
un rapida diminuzione della concentrazione di
AMPc
Principali responsabili del rapido calo di [AMPc]
sono le fosfodiesterasi (PDE) specifiche per i
nucleotidi ciclici di cui ne esistono molte
isoforme
degradano AMPc
AMP
L’AMPc può controllare l’espressione genica a
livello della trascrizione
Nei regione del promotore dei geni che
rispondono all’AMPc sono stati individuati
elementi di risposta specifici (CRE)
La sequenza consenso palindromica è:
5’-TGACGTCA-3’
I CRE sono riconosciuti da una proteina detta
CREB (CRE binding protein) che si lega in
forma di dimero e funziona come un fattore di
trascrizione controllato mediante fosforilazione
da parte della PKA
Certi ormoni legandosi a certi recettori inibiscono
la via dell’AMPc con un meccanismo analogo
(anche se non ancora del tutto chiarito) a quello
dell’attivazione
Molecole che stimolano la via dell’AMPc
Molecole che inibiscono la via dell’AMPc
Una ipotesi è che le sub-unità b e g possano
associarsi alla as rilasciata dagli attivatori
bloccandone l’attività