La termodinamica
•
Nello studio della meccanica abbiamo lasciato alcuni problemi aperti
– L’energia meccanica totale in presenza di forze non conservative, varia
DE = Wnc
•
Nei casi in cui c’è una dissipazione di energia, DE<0,
– per esempio in presenza di forze di attrito dinamico,
– la scomparsa di energia meccanica è accompagnata da un aumento della
temperatura dei corpi interagenti.
•
La termodinamica si preoccupa di completare lo studio di questi fenomeni
– in questo studio la temperatura gioca un ruolo fondamentale.
•
Quindi dobbiamo studiare le interazioni
– di un sistema
– con l’ambiente circostante
•
La termodinamica si occupa di
quello che succede all’interno
del sistema
Ambiente circostante
Sistema
Superficie ideale, o reale,
che separa il sistema
dall’ambiente circostante
G.M. - Edile-Architettura 2004/05
Descrizione macroscopica e microscopica
•
•
Per studiare il comportamento di un sistema termodinamico dobbiamo
imparare a descriverlo
• Punto di vista microscopico
Punto di vista macroscopico
– parte da un’ipotesi della struttura
– Basato su grandezze, coordinate
termodinamiche, che descrivono
il sistema nel suo insieme
– Non viene fatta alcuna ipotesi
sulla struttura interna del sistema
– Generalmente sono in numero
limitato
– Sono suggerite dai nostri sensi
– Sono misurabili direttamente
•
–
–
–
Per es: sistema costituito dal gas
contenuto nel cilindro del motore
dell’automobile
–
–
–
–
Il volume occupato
La pressione esercitata sulle pareti
La temperatura
La composizione
–
•
della materia (gas costituito da
molecole).
Si descrive il comportamento di
ciascuna molecola (posizione,
velocità, energia cinetica, quantità
di moto, etc)
È necessario un numero molto
grande di grandezze per descrivere
il comportamento del sistema
Che non hanno niente a che vedere
con le nostre percezioni sensoriali
Che sono difficili da misurare
direttamente
I due punti di vista sono complementari
– Le grandezze macroscopiche sono le media di
quelle microscopiche
– Il punto di vista macroscopico
è più stabile2004/05
G.M. - Edile-Architettura
I sistemi termodinamici
•
•
La termodinamica si applica a tutto: qualunque oggetto presente in natura può
costituire un sistema termodinamico.
Le coordinate termodinamiche utili per descrivere lo stato del sistema,
dipendono dal particolare sistema studiato:
– Per una sostanza pura (sostanza costituita da un’unica specie molecolare)
• Pressione, volume, temperatura
– Per un filo sottoposto a tensione
• Sforzo, allungamento e temperatura
– Per una cella elettrolitica
• Forza elettromotrice, pressione e temperatura
•
In molti casi sono sufficienti due sole coordinate termodinamiche per descrivere
lo stato di un sistema
– Per una sostanza pura (sostanza costituita da un’unica specie molecolare)
• Pressione e volume,oppure temperatura e volume, oppure temperatura e pressione
– Nel seguito noi faremo riferimento a sistemi termodinamici descrivibili con due sole
coordinate termodinamiche, X e Y.
•
Come già detto la temperatura gioca un ruolo fondamentale in termodinamica
– Dobbiamo darne una definizione operativa
G.M. - Edile-Architettura 2004/05
L’equilibrio termico
•
•
•
•
Un sistema termodinamico si trova in uno stato di equilibrio
caratterizzato da ben determinati valori delle coordinate X e
Y, se i valori delle coordinate X e Y non cambiano fino a che
non cambiano le condizioni esterne.
Quando le condizioni esterne cambiano, anche lo stato del
sistema, e quindi le sue coordinate termodinamiche, possono
cambiare
Il comportamento di un sistema termodinamico dipende dal
tipo di interazione che può avere con l’ambiente esterno
Le interazioni dipendono dal tipo di pareti che separano il
sistema dall’ambiente esterno
– Adiabatiche
X,Y
X,Y
X',Y'
ambiente
sistema
Stato iniziale
• Le coordinate termodinamiche del sistema non cambiano al cambiare
delle condizioni esterne
– Conduttrici
• Le coordinate termodinamiche del sistema variano, comunque dopo
un tempo più o meno lungo, il sistema raggiunge un nuovo stato
caratterizzato da nuove coordinate termodinamiche che rimangono
costanti fino a che non cambino nuovamente le condizioni esterne
• Si è raggiunto uno stato di equilibrio termico
Xi ,Yi
X'i ,Y'i
sistema
ambiente
Stato finale
Xf,Yf
X'f,Y'f
G.M. - Edile-Architettura 2004/05
Il principio zero della termodinamica
•
due sistemi in equilibrio termico con un terzo sistema, sono in equilibrio termico tra
loro.
Sistema A
Sistema B
Sistema C
•
Sistema B
Sistema A
Sistema C
Questo principio è la base della misura della temperatura
–
se il sistema A è in equilibrio termico con un determinato stato del sistema C
(termometro)
– se il sistema B è in equilibrio termico con lo stesso stato del sistema C
(termometro)
– Allora i due corpi A e B hanno la stessa temperatura.
G.M. - Edile-Architettura 2004/05
Definizione operativa della temperatura
•
L’uomo ha, attraverso il tatto, una percezione sensoriale della temperatura
– Riesce a distinguere un corpo più caldo da uno più freddo
– Comunque la determinazione di un numero (il risultato della misura) solo sulla base
della percezione sensoriale è molto soggettiva
• Ci sono situazioni di palese contraddizione:
–
–
se, in una giornata molto fredda, si tocca un oggetto di legno ed uno di ferro, tutte due alla stessa
temperatura, quello di ferro ci darà l’impressione di esser più freddo
Se si tocca lo stesso oggetto con le due mani, che abbiamo tenuto per qualche minuto una in una
bacinella di acqua calda e l’altra in una di acqua fredda, otterremo dalle due mani della sensazioni
contraddittorie.
– Bisogna usare uno strumento
– Si fa riferimento a sistemi termodinamici per i quali, mantenendo fissa una delle due
coordinate termodinamiche, l’altra varia con la temperatura
• Per esempio è noto che a pressione costante, i corpi si dilatano
–
Un termometro molto classico è costituito da una certa quantità di mercurio che si espande
all’interno di un capillare, la lunghezza del mercurio nel capillare è legata alla temperatura
• La pressione di una certa quantità di gas contenuta in un volume costante dipende dalla
temperatura
–
Termometro a gas a volume costante
• La forza elettromotrice di una cella elettrolitica che lavora a pressione costante dipende
dalla temperatura.
G.M. - Edile-Architettura 2004/05
Taratura di un termometro
•
Una volta selezionato il tipo di termometro usare
– Per esempio le lunghezza del mercurio in un capillare
•
Dobbiamo procedere alla taratura del termometro,
– trovare la legge di corrispondenza tra il valore della grandezza termometrica
utilizzata
• la lunghezza del mercurio nel capillare
– con il valore della temperatura da misurare
•
Per la taratura si fa ricorso a cosiddetti “punti fissi”
– Per punto fisso si intende un particolare sistema termodinamico in cui la
temperatura del sistema resta invariata fin tanto che perdurano certe condizioni
• La temperatura di fusione del ghiaccio alla pressione atmosferica resta costante fintanto
che il sistema risulta composto da acqua allo stato liquido o acqua allo stato solido
(ghiaccio)
• La temperatura di ebollizione dell’acqua alla pressione atmosferica resta costante fintanto
che il sistema termodinamico risulta composto di acqua nella fase liquida ed vapore
acqueo.
G.M. - Edile-Architettura 2004/05
Taratura di un termometro
•
Per molto tempo si è usata una definizione di temperatura basata su l punto di fusione e
sul punto di ebollizione dell’acqua
–
–
–
–
Al punto di fusione dell’acqua è stato assegnato arbitrariamente il valore 0°C
Al punto di ebollizione il valore 100° C
L’intervallo di temperatura è stato suddiviso in 100 parti (gradi centigradi)
Se chiamiamo
•
•
•
LF la lunghezza del mercurio nel capillare quando è in equilibrio termico con il punto di fusione
dell’acqua
Le la lunghezza del mercurio nel capillare quando è in equilibrio termico con il punto di ebollizione
dell’acqua
L la lunghezza del mercurio nel capillare quando è in equilibrio termico con il corpo di cui si vuol
misurare la temperatura
T=
L - Lf
100 °C
Le - Lf
G.M. - Edile-Architettura 2004/05
Taratura di un termometro
•
Recentemente è stato suggerito di tarare il termometro con un solo punto fisso
–
Il punto triplo dell’acqua a cui è assegnata arbitrariamente la temperatura di 273.16 K
•
•
Se Ltr è la lunghezza del mercurio nel capillare quando è in equilibrio termico con il punto triplo
dell’acqua
L la lunghezza del mercurio nel capillare quando è in equilibrio termico con il corpo di cui si vuol
misurare la temperatura
T=
Pgas = Patm + rgh
Il termometro a
gas a volume
costante
L
273.16 K
L tr
Per il termometro a
termocoppia
e
T=
273.16 K
e tr
Per il termometro a
resistenza
R
T=
273.16 K
Rtr
P
T=
273.16 K
Ptr
Il punto triplo
dell’acqua
G.M. - Edile-Architettura 2004/05
La scala di temperatura del termometro a gas
perfetto
•
Ogni termometro definisce una scala di temperatura
– Tutti i termometri misurano correttamente la temperatura del punto triplo
– Mentre a tutte le altre temperature, i vari termometri (a mercurio, a gas, a
resistenza a termocoppia, etc) misurano valori anche molto differenti tra loro.
– Addirittura anche quando si usano gas diversi all’interno del bulbo del termometro
a gas, i valori misurati per la stessa temperatura risultano diversi
– Però, se si diminuisce la quantità di gas presente nel bulbo,
– Ossia si fa il limite per Ptr che tende a zero (la pressione del gas quando è in
equilibrio con il sistema del punto triplo che tende a zero)
– Allora tutti i gas convergono
verso lo stesso valore limite.
• Tutti i gas, in condizione di bassa densità, si
comportano allo stesso modo
Tgas perfetto = lim Ptr ®0
•
P
273.16 K
Ptr
Scala di temperatura del
termometro a gas perfetto
–
Con questo termometro non si
possono misurare temperature
molto basse perché non si trova
più gas
G.M. - Edile-Architettura 2004/05
Le scale Celsius e Fahrenheit
•
•
•
•
•
Della scala Celsius, o centigrada,
abbiamo già parlato
L’unità di misura della scala
Celsius, 1°C, è uguale al
campione della scala Kelvin, 1 K.
1°C=1K
Esiste solo un offset tra le due scale
Infatti alla temperatura di 0°C
corrisponde una temperatura di
273.15 K.
La relazione tra le due temperature
è la seguente:
•
•
La scala Fahrenheit fa coincidere al
punto di fusione dell’acqua la
temperatura tf=32°F, e a quello di
ebollizione la temperatura di
tf=212°F
La relazione tra temperatura
Fahrenheit e centigrada è data da
9
212 - 32
t F = 32 + t C = 32 +
tC
5
100
t C = T - 273.15
•
•
tc temperatura in gradi Celsius
T temperatura in K (kelvin)
G.M. - Edile-Architettura 2004/05
La dilatazione termica
•
•
•
•
Abbiamo già accennato al fatto che i corpi si dilatano
con la temperatura
Ora che abbiamo una definizione più precisa della
temperatura, possiamo studiare con una maggiore
accuratezza il fenomeno
Cominciamo dai corpi solidi
In particolare corpi unidimensionali (un filo, una
sbarra, etc)
D = a DT
1d
a=
dT
•
Coefficiente di dilatazione
lineare
•
•
Dipende dalla temperatura
Per intervalli limitati di
temperatura può essere
considerato costante
G.M. - Edile-Architettura 2004/05
La dilatazione superficiale e di volume
•
Se si ha a che fare con una lastra rettangolare, di un materiale isotropo,
entrambe le dimensioni si dilateranno con la stessa legge:
(1 + a DT)
' = (1+ a DT)
A' = ' ' = (1 + a DT ) (1 + a DT ) =
(1+ 2a DT + a DT )
'1 =
1
2
2
1
2
1
2
2
1
2
1 2
Trascurando a2DT2 rispetto a 2aDT
•
2
(
A' = A 1 + 2a DT
•
•
Il coefficiente di dilatazione superficiale è
due volte quello lineare
In maniera analoga si può vedere che il
coefficiente di dilatazione cubica è tre volte
quella lineare
)
3
1
(
V' = V 1+ 3a DT
)
2
G.M. - Edile-Architettura 2004/05
La dilatazione di volume dei liquidi
•
•
•
•
Nel caso dei liquidi non è possibile parlare di dilatazione lineare o
superficiale
Si parla solo di dilatazione di volume, o cubica:
V' = V(1+ bDT )
I valori del coefficiente di dilatazione di volume per i liquidi sono più
grandi, circa un fattore 10, dei corrispondenti valori per i solidi
(legame molecolare più debole)
L'acqua ha un comportamento diverso dagli altri liquidi.
materiale
b (K-1)
acqua
1.8 10-4
Alcol etilico 10.4 10-4
benzina
9.6 10-4
cloroformio 14.0 10-4
glicerina
5.3 10-4
mercurio
1.8 10-4
– Aumentando la temperatura al di sopra dei 4 °C l'acqua si dilata anche
se non in maniera lineare.
– Ma anche diminuendo la temperatura al di sotto dei 4 °C l'acqua
continua a dilatarsi (il ghiaccio ha una densità più bassa dell’acqua) .
– Quando i fiumi si raffreddano, l’acqua più fredda, o il ghiaccio, sale in
superficie, l’acqua sul fondo del fiume non scende mai al di sotto dei 4°
C (i pesci possono sopravvivere).
•
L'acqua ha dunque una densità massima alla temperatura di 4 °C: in
queste condizioni essa differisce per meno di 1 parte su 10000 da 1
gr/cm3. A tutte le altre temperature, la densità dell'acqua è minore di
questo valore.
G.M. - Edile-Architettura 2004/05
•
Un’asta di acciaio ha un diametro di 3.000 cm alla temperature di 25°C. Un anello di
ottone ha un diametro interno di 2.992 cm alla temperatura di 25°C. A quale
temperatura comune l’asta si infilerà nell’anello.
•
•
Applicaz
ione
Dalla tabella dei coefficienti di dilatazione lineare
ricaviamo
aottone=19x10-6 °C-1
aacciaio=11x10-6 °C-1
d asta = d asta _ 25°C (1 + aacciaoDT )
d anello = d anello_ 25°C (1+ a ottoneDT)
•
Imponiamo l’uguaglianza tra i due diametri e ricaviamo la variazione di
temperatura DT comune
d asta_ 25°C (1 + aacciaoDT) = d anello _ 25°C (1 + aottone DT )
d asta_ 25°C - danello _ 25° C = danello _ 25° Ca ottoneDT - dasta _ 25°C aacciaoDT =
DT =
dasta _ 25° C - d anello_ 25°C
=
d anello_ 25°C aottone - dasta _ 25° C aacciao
3.000cm - 2.992cm
0.008 ´ 106
=
= 335.4°C
-6
-1
-6
-1 =
2.992cm ´ 19 ´ 10 °C - 3.000 ´ 11 ´ 10 °C
23.848
56.848
33.000
DT = T - 25°C = 335.4°C Þ T = 335.4°C + 25°C = 360°C
G.M. - Edile-Architettura 2004/05
Equilibrio Termodinamico
•
•
Un sistema termodinamico si dice isolato se non ha interazioni con l’ambiente
Qualunque sia lo stato di partenza del sistema, anche se
– la pressione all’interno del sistema è differente da punto a punto ed è differente da
quella esterna
– La temperatura del sistema è differente da punto a punto ed è differente da quella
esterna
– Il sistema, a causa della differenza di pressione, è soggetto a moti turbolenti, con
accelerazioni, etc
– Tra le vari componenti del sistema possono avvenire reazioni chimiche
•
Aspettando un tempo sufficientemente lungo si osserva che il sistema si porta
– in uno stato stazionario (si esauriscono i moti)
– in cui sono cessate tutte le reazioni chimiche
– in cui la pressione risulta essere la stessa in tutti i punti del sistema, e se il sistema
non è isolato meccanicamente dall’ambiente esterno deve essere la stessa di quella
esterna
– e in cui la temperatura risulta essere la stessa in tutti i punti del sistema, e se il
sistema interagisce con l’ambiente esterno attraverso pareti conduttrici, è la stessa
di quella esterna
•
Il persistere contemporaneamente dei tre equilibri: meccanico, termico,
chimico, realizza l’equilibrio termodinamico.
G.M. - Edile-Architettura 2004/05
Equilibrio Termodinamico
•
Si dirà che il sistema si trova in equilibrio termodinamico, se esso si trova
contemporaneamente in:
– equilibrio meccanico, quando non esistono forze o momenti non equilibrati né
all'interno del sistema, né tra il sistema e l'ambiente circostante.
• la pressione deve essere la stessa in tutte le parti del sistema e, se il contenitore non è
rigido, essa è la stessa dell’ambiente circostante.
– equilibrio termico, quando tutte le parti del sistema hanno la stessa temperatura, e
se le pareti che circondano il sistema sono conduttrici, questa coincide con quella
dell'ambiente circostante.
– equilibrio chimico, quando non avvengono processi che tendono a modificare la
composizione del sistema, come reazioni chimiche, né spostamenti di materia da
una parte all'altra del sistema, come accade per esempio quando una sostanza entra
in soluzione o quando una sostanza cambia fase, per esempio da liquido a vapore.
(Con l'espressione reazione chimica si intendono sia le reazioni chimiche vere e
proprie che il trasporto di materia e i cambiamenti di fase.)
•
•
Gli stati di equilibrio termodinamico sono estremamente importanti
Noi riusciamo a descrivere solo gli stati di equilibrio termodinamico
– In uno stato di non equilibrio termodinamico la pressione può variare da punto a
punto
– quale valore possiamo assegnare all’intero sistema?
– Non è possibile descrivere gli stati che non siano di equilibrio!
G.M. - Edile-Architettura 2004/05
Il piano PV o piano di Clapeyron
•
•
•
•
Se il sistema è in equilibrio termodinamico, allora sono definite le coordinate
termodinamiche relative a quello stato.
Molti sistemi termodinamici hanno bisogno di solo due coordinate
termodinamiche per individuare un particolare stato
Tipico è l’esempio delle sostanze pure per le quali sono sufficienti le
coordinate pressione e volume per individuare il particolare stato
Lo stato di equilibrio può essere rappresentato in un diagramma (piano PV o
piano di Clapeyron) così fatto:
P
Attenzione: solo gli stati
di equilibrio
termodinamico
Possono essere
rappresentati nel piano
PV
i
Pi
Vi
V
G.M. - Edile-Architettura 2004/05
L’equazione di stato
•
Sostanze pure
– Solo due coordinate termodinamiche sono sufficienti per identificare gli stati di
equilibrio termodinamico
• Per esempio pressione e volume (le due coordinate di tipo meccanico)
– Cosa succede della terza coordinata termodinamica, la temperatura?
• Si vede che una volta determinato lo stato, ossia una volta scelto il valore del volume e
della pressione, la temperatura è univocamente determinata dalla scelta delle altre due
coordinate.
• Esiste una relazione che lega tra loro le coordinate termodinamiche!!
•
•
f(V,P,T)=0
Questa funzione implicita rappresenta l’equazione di stato.
Generalmente l’equazione di stato non è nota.
– Essa va determinata sperimentalmente o dedotta per via teorica
– Per noi è importante sapere che tutti i sistemi termodinamici hanno una equazione
di stato
• che lega le coordinate termodinamiche di tipo meccanico (P e V) alla temperatura.
– L’equazione di stato più nota è quella del gas perfetto:
PV=nRT
G.M. - Edile-Architettura 2004/05
Le trasformazioni
•
Consideriamo un sistema termodinamico in equilibrio
– Per esempio una certa quantità di gas contenuto in un cilindro dotato di pistone
mobile
•
Pgas = Pest +
Mg
A
Supponiamo ora di alterare improvvisamente uno degli equilibri
– Quello meccanico
•
•
Il pistone sotto l’azione della pressione interna non più bilanciata da quella
esterna si metterà in moto
La presenza di attriti tra pistone e cilindro può far variare la temperatura
localmente
L’aumento della temperatura può innescare reazioni chimiche
•
L’aver alterato uno degli equilibri,
•
– porta il sistema ad evolvere attraverso stati di non equilibrio
•
(la pressione è diversa da punto a punto e sicuramente diversa da quella esterna, lo
stesso vale per la temperatura)
– verso un nuovo stato di equilibrio
•
•
Si è verificato un cambiamento di stato
Il sistema ha subito una trasformazione
G.M. - Edile-Architettura 2004/05
Rappresentazione di una trasformazione nel
piano PV
•
•
•
In una trasformazione che procede per stati di non equilibrio termodinamico
Siamo in grado di conoscere coordinate termodinamiche solo nello stato di
partenza (iniziale) e nello stato di arrivo (finale)
Solo questi due stati possono essere rappresentati nel diagramma PV
•
•
la trasformazione non può essere
rappresentata nel diagramma PV,
Negli stati intermedi non è nota la
pressione perché non c’è un valore
unico di pressione per tutto il
sistema (la pressione può essere
diversa da punto a punto durante la
trasformazione)
P
i
Pi
f
Pf
Vi
Vf
V
G.M. - Edile-Architettura 2004/05
Pgas = Pest +
Mg
A
Le trasformazioni quasi statiche
•
Una trasformazione come quella descritta nella trasparenza precedente non è
descrivibile in termodinamica
– Non passa per stati di equilibrio termodinamico!!
– Questo vuol dire che non possiamo farci dei conti sopra.
•
Dobbiamo costruirci delle trasformazioni ideali nelle quali il sistema passa
attraverso stati di equilibrio termodinamico (o comunque stati vicinissimi ad
uno stato di equilibrio termodinamico)
– Solo così potremo descrivere la trasformazione
– Ed eventualmente fare dei conti
•
Per esempio, se suddividiamo la massa M poggiata sul
pistone in tanti piccoli pesi,
–
e togliamo un peso alla volta, ci saremo allontanati molto poco
dallo stato di equilibrio iniziale
– aspettiamo ora il tempo necessario perché l’equilibrio
comunque si ripristini, e poi togliamo un secondo peso.
– Così facendo potremo portare il sistema dallo stesso stato
iniziale allo stesso stato finale della trasformazione precedente
– Ma in questo caso durante tutta la trasformazione siamo passati
attraverso stati di equilibrio o stati molto prossimi a stati di
equilibrio, e quindi confondibili con essi.
Pi Vi
Pi -DP
V i +DV
G.M. - Edile-Architettura 2004/05
Trasformazioni reversibili
•
•
•
Trasformazione quasistatica
È una trasformazione in cui il sistema passa per stati di equilibrio
termodinamica o stati così prossimi ad uno di equilibrio termodinamico da
poter essere confusi con stati di equilibrio.
Una trasformazione quasi statica è una trasformazione ideale
Pi Vi
– Richiede un tempo molto grande di esecuzione
•
Se non sono presenti effetti dissipativi,
– Lavoro effettuato da forze non conservative (forze di attrito dinamico)
– Passaggi di corrente all’interno di resistori
•
Pi -DP
V i +DV
Allora la trasformazione può essere percorsa all’indietro.
– Consideriamo la trasformazione quasi statica che abbiamo descritto
– Supponiamo di aver già tolto un certo numero di pesetti
– Anziché continuare a togliere i pesetti dal pistone, possiamo rimetterli ad uno ad
uno sul pistone.
– Quando li avremo rimessi tutti avremo riportato il sistema nello stato da cui
eravamo partiti
– Abbiamo cioè percorso la trasformazione all’indietro.
•
La trasformazione si dirà reversibile.
– Una trasformazione per essere reversibile deve essere quasistatica e non devono
essere presenti effetti dissipativi.
G.M. - Edile-Architettura 2004/05
Rappresentazione di una trasformazione
reversibile nel piano PV
•
•
•
•
In una trasformazione reversibile tutti gli stati intermedi sono di equilibrio
termodinamico
Quindi siamo in grado di conoscere le coordinate termodinamiche in tutti gli
stati intermedi
Possiamo rappresentare una trasformazione reversibile nel piano PV, mediante
una linea continua che connette lo stato iniziale con quello finale
Una trasformazione reversibile può essere suddivisa in tratti infinitesimi
P
i
Pi
Pf P
f
Vi
V
Vf
V
G.M. - Edile-Architettura 2004/05
Il lavoro in termodinamica
•
•
•
•
•
Il lavoro rappresenta uno dei modi con cui, durante una trasformazione
il sistema e l’ambiente circostante si scambiano energia.
In termodinamica viene considerato positivo il lavoro fatto dal sistema
sull’ambiente circostante
Nel dare la definizione di lavoro fatto dal sistema dobbiamo far
riferimento al lavoro fatto dall’ambiente sul sistema
Il lavoro fatto dal sistema è l’opposto del lavoro fatto dall’ambiente sul
sistema
W=-West
Il motivo di questa scelta è semplice:
Fe= PatmS + Mg
(S superficie del
pistone)
Patm
D
M
Fe
– quando il sistema subisce una trasformazione non reversibile,
• poiché non si conoscono gli stati intermedi del sistema durante la trasformazione
• non è possibile determinare le forze esercitate dal sistema sull’ambiente esterno e
quindi il lavoro effettuato dal sistema
– Mentre, in generale, è possibile determinare le forze esercitate
dall’ambiente esterno sul sistema (quelle esercitate dal sistema saranno
uguali ed opposte).
– È chiaro che in caso di trasformazioni reversibili converrà usare le
coordinate termodinamiche del sistema
G.M. - Edile-Architettura 2004/05
Il lavoro in termodinamica
•
•
•
•
•
•
•
•
•
•
Fe= PatmS + Mg
Facendo riferimento alla figura, il lavoro esterno sarà dato da:
West=-FeDl
(S superficie del
Il segno meno indica che forza e spostamento sono discordi
pistone)
Il lavoro fatto dal sistema sarà allora
M
Patm
W=-West= FeDl
La forza esercitata dall’ambiente esterno può essere derivata dalla
pressione esterna:
D
Fe=PeS
Fe
Dove S è l’area del pistone.
Si ottiene
W= FeDl= PeSDl= PeDV
In cui DV è la variazione di volume subita dal gas
Naturalmente, se la trasformazione è reversibile, e quindi è quasi statica, la
pressione esterna deve essere uguale a quella interna (equilibrio meccanico)
Il lavoro diventa
W= PDV
Se la trasformazione è reversibile allora possiamo suddividerla in tratti
infinitesimi. Il lavoro in ciascun tratto sarà dato da:
dW= PdV
G.M. - Edile-Architettura 2004/05
Il lavoro su una trasformazione reversibile
•
P
Per una trasformazione reversibile tra gli stati i ed f
– Il lavoro infinitesimo
– Il lavoro complessivo:
W=
WI = area sotto la
trasformazione
i
dW=PdV (zona in verde)
P
f
f
ò PdV
i
•
Corrisponde all’aria sotto la trasformazione
– Nel caso di una espansione (Vf>Vi) il lavoro è positivo
– Nel caso di una compressione (Vf<Vi) il lavoro è negativo
– Percorrendo al contrario la trasformazione reversibile, da f a i,P
il lavoro cambia di segno.
•
Il lavoro dipende dalla trasformazione che connette lo stato
iniziale e lo stato finale
V
V V+dV
WI = area sotto la
trasformazione
i
f
V
G.M. - Edile-Architettura 2004/05
Il lavoro dipende dalla trasformazione
P i
Pi
Pf
D
f
C
Vi
•
•
•
W3 = Area sotto la trasformazione = W1 +
•
1
2
3
Vf
V
iCf
iDf
if
1
(Pi - Pf )( Vf - Vi )
2
Il lavoro dW=PdV
– Non è un differenziale esatto
– Non esiste una funzione delle coordinate tale che il lavoro può essere
espresso come differenza dei valori assunti da questa funzione nello stato
finale e in quello iniziale
G.M. - Edile-Architettura 2004/05
Il lavoro adiabatico
•
•
Se però si effettua una trasformazione
adiabatica
In qualunque modo viene effettuata la
trasformazione
– più lentamente o più rapidamente,
– per una parte del tempo azionando il
mulinello, e per la restante il generatore
– Invertendo i due processi
•
•
Il lavoro effettuato non dipende dalla
particolare trasformazione ma solo dallo stato
iniziale e da quelli finale
Quindi
M
Generatore
senza perdite
Mulinello
•
Esiste una funzione dello stato del sistema,
U(P,V), tale che: U - U = W
i
•
f
adiab
Sistema termodinamico:
– Acqua alla pressione atmosferica
alla temperatura Ti
•
•
M
Trasformazione:
– Trasformazione adiabatica che
porta il sistema sempre alla
pressione atmosferica ma ad una
temperatura più elevata, Tf.
La funzione U(P,V) è detta energia interna
DU = U f - Ui = -Wadiab
Esprime la conservazione dell’energia
G.M. - Edile-Architettura 2004/05
La funzione energia interna
•
L’osservazione fatta sul lavoro adiabatico ci dice che esiste una funzione di stato,
l’energia interna:
U(P,V)
U(V,T)
U(P,T)
– Solo due coordinate sono sufficienti per individuare uno stato di equilibrio termodinamico
•
La variazione dell’energia interna non dipende dalla particolare trasformazione subita dal
sistema termodinamico,
reversibile, irreversibile, adiabatica, non adiabatica, senza scambi di lavoro
ma solo dallo stato iniziale e dallo stato finale
•
Per una trasformazione infinitesima la variazione di energia interna sarà data da
dU=-dWadiab
dU è un differenziale esatto
•
– Esiste la funzione U tale che la variazione dell’energia interna è data dalla differenza di valori
assunti dalla funzione nel punto finale meno quello del punto iniziale
•
Anche il lavoro adiabatico, dWadiab, è un differenziale esatto.
G.M. - Edile-Architettura 2004/05
Il I principio della termodinamica
•
Io posso realizzare la stessa trasformazione
–
•
•
•
senza compiere lavoro adiabatico, o addirittura senza compiere
lavoro
per esempio, posso utilizzare la differenza di temperatura tra
l’ambiente esterno ed il sistema
La variazione di energia interna è la stessa che avevo prima
–
–
–
•
•
l’innalzamento di temperatura di una certa quantità d’acqua alla
pressione atmosferica
Lo stato iniziale e finale coincidono
Non è stato compiuto alcun lavoro
Ma a causa delle differenze di temperatura tra il sistema e l’ambiente
esterno c’è stato il trasferimento di qualcosa che chiamo Calore (Q)
•
Per continuare a conservare l’energia
DU=Q
La variazione di energia interna è uguale al calore scambiato con
l’ambiente esterno
–
In generale se nella
trasformazione viene
– Eseguito lavoro
– Scambiato calore
DU=Q-W
I segni del calore sono opposti a quelli del lavoro
•
I principio della
termodinamica
G.M. - Edile-Architettura 2004/05
Il I principio della termodinamica
DU=Q-W
•
Esprime l’esistenza della funzione energia interna del sistema che è una
funzione dello stato del sistema;
•
Esprime la conservazione dell’energia
•
Stabilisce che il calore è una forma di energia,
– è l'energia scambiata tra il sistema e l'ambiente circostante a causa di una
differenza di temperatura.
– In altri termini è l'energia che transita attraverso i confini del sistema a causa di
una differenza di temperatura tra il sistema e l'ambiente circostante.
– Essendo il calore un’energia, nel Sistema Internazionale di Unità di Misura si
misura in Joule.
•
Il primo principio si applica a tutte le trasformazioni, sia a quelle reversibili
che a quelle irreversibili
G.M. - Edile-Architettura 2004/05
L’equivalente meccanico del calore
•
•
•
•
Si definisce “caloria” come la quantità di
calore necessaria per innalzare la temperatura
di un grammo di acqua da 14.5°C a
15.5°C alla pressione atmosferica.
Lo stesso cambiamento di stato si ottiene
anche effettuando solo del lavoro adiabatico
Joule esegui una serie di esperimenti come
quello mostrato in figura con cui determinò
L’equivalente meccanico del calore, ossia la
relazione tra la caloria e l’unità di misura del
lavoro,J.
M
Mulinello
1 caloria = 4.1858 J
G.M. - Edile-Architettura 2004/05
Trasformazioni causate da una differenza di
temperatura
•
•
Abbiamo già accennato al fatto che alcune trasformazioni
sono causate dalla mancanza di equilibrio termico
Se la temperatura dell’ambiente esterno è diversa da quella
del sistema
– Il sistema e l’ambiente esterno interagiscono fino a
raggiungere un valore comune di temperatura (generalmente
quella dell’ambiente esterno)
– Possiamo immaginare che l’interazione avvine attraverso lo
scambio di qualcosa che abbiamo chiamato calore,
– Che, secondo il I principio, altro non è che l’energia scambiata
tra sistema e ambiente circostante a causa della differenza di
temperatura
G.M. - Edile-Architettura 2004/05
La calorimetria
•
Prima che attraverso il lavoro di Joule si riuscisse a stabilire l’equivalenza tra
il calore e il lavoro meccanico,
– E quindi identificare il calore come una forma di energia
•
•
Molto pragmaticamente, i fisici avevano dato una definizione operativa del
calore.
Questa definizione parte dalla osservazione che molti sistemi termodinamici
variano la loro temperatura quando acquistano o cedono del calore.
•
•
•
Dato un sistema termodinamico a cui viene ceduto una quantità di calore Q
e subisce una variazione di temperatura DT
Q
C=
Si definisce capacità termica il rapporto
DT
•
Naturalmente questa è la Capacità termica media nell’intervallo di
temperatura DT.
Q dQ
C = lim DT ®0
=
La Capacità termica è una funzione della temperatura.
DT dT
Se si vuole determinare la capacità termica ad una particolare temperatura
bisogna effettuare il passaggio al limite
Per tutti gli effetti pratici la Capacità termica può essere considerata costante
per variazioni di temperatura limitate intorno alla temperatura ambiente.
G.M. - Edile-Architettura 2004/05
•
•
•
Il calore specifico
•
•
•
•
Il calore specifico è la capacità termica riferita all’unità di massa
Consideriamo il sistema termodinamico di massa m
1 Q
A cui viene somministrato il calore Q
c=
m DT
Subisce una variazione di temperatura DT
•
•
Il calore specifico è anche uguale alla capacità termica diviso per la massa.
Questa definizione è l’equazione fondamentale per definire il campione di
calore: la caloria
Il calore somministrato al corpo, invertendo la definizione di calore specifico
è dato da:
Q = mcDT
•
•
definizione della caloria
– Si sceglie una particolare sostanza: l’acqua e le si assegna arbitrariamente calore
specifico 1
– Si prende l’unità di massa di questa sostanza: 1g
– Si prende una variazione unitaria di temperatura
•
La caloria è dunque la quantità di calore che riesce a far aumentare la
temperatura di un grammo di acqua da 14.5 °C a 15.5 °C alla pressione
atmosferica.
–
L’acqua dunque ha un calore specifico di 1 cal/(g°C) alla pressione atmosferica e a 15°C.
G.M. - Edile-Architettura 2004/05
Tabella dei calori specifici
•
•
Anche i calori specifici come la capacità termica dipendono dalla temperatura
Comunque per piccole variazione della temperatura nell’intorno della
temperatura ambiente possono essere considerati costanti.
•
Il calore specifico dell'acqua
diminuisce tra zero e 35°C
poi cresce nuovamente;
vale 1.007 cal/g°C a 0°C e a
100 °C
.998 cal/g°C intorno a 35
°C.
varia di molto poco tra 0°C e
100°C, si può considerare
costante.
I calori specifici, dipendono
anche
dal
tipo
di
trasformazione con cui viene
ceduto il calore.
Per i solidi ed i liquidi è facile
effettuare trasformazioni a
pressione costante (pressione
atmosferica).
Per i gas vengono forniti due
valori (diversi), a pressione e a
volume costante.
•
•
•
•
•
•
•
C molare =
1 Q
n DT
G.M. - Edile-Architettura 2004/05
La misura del calore -il calorimetro
•
•
•
Per la misura del calore si può usare un strumento come
quello illustrato in figura
È costituito da una certa quantità di liquido, per es.
acqua, in un recipiente il tutto circondato da pareti
adiabatiche, per evitare scambi di calore con l’esterno.
Completano lo strumento
Termometro
Agitatore
– Un agitatore per far si che la temperatura diventi uniforme
nel più breve lasso di tempo
– E un termometro che misura la temperatura del liquido.
•
•
•
è necessario conoscere la capacità termica Ctotale del
liquido, recipiente, agitatore e termometro
Si misura la temperatura prima, Ti, e dopo Tf, il
trasferimento di calore
Il calore scambiato sarà dato da:
Q =C
totale
(Tf - Ti )
G.M. - Edile-Architettura 2004/05
•
Calcolate il calore specifico di un metallo dai seguenti dati. Un contenitore fatto di questo
metallo ha una massa di 3.6kg e contiene 14 kg di acqua. Un pezzo di 1.8kg di metallo
inizialmente alla temperatura di 180°C viene immerso nell’acqua.
Il contenitore e l’acqua inizialmente hanno una temperatura di 16 °C e la temperatura
finale di tutto il sistema è 18°C.
•
•
•
•
Applicaz
ione
Dalla tabella dei calori specifici ricaviamo che quello
dell’acqua vale
cacqua=4190 J/ kgK
Osserviamo che il calore ceduto dal pezzo di metallo è stato tutto acquisito
dall’acqua e dal contenitore.
Il calore ceduto dal pezzo di metallo vale
•
Qc = cmDTmetallo
•
Il calore acquisito dall’acqua e dal contenitore vale:
Qa = cacquamacquaDTacqua + cm contenitoreDTacqua
c acquamacquaDTacqua + cm contenitore DTacqua = -mcDTmetallo
cacquam acquaDTacqua
4190 ´ 14 ´ 2
117320
c ===
= 412J / kgK
mDTmetallo + m contenitoreDTacqua
1.8 ´ (-162) + 3.6 ´ 2 284.4
G.M. - Edile-Architettura 2004/05
Il serbatoio di calore o termostato
•
Con questo nome indicheremo un sistema termodinamico tale che
– Può assorbire o cedere quantità anche rilevanti di calore senza che la sua
temperatura vari apprezzabilmente
•
•
Dalla definizione di capacità termica appare che un tale sistema deve avere
una capacità termica molto elevata
O equivalentemente una massa molto grande
Q
Q Q
DT = =
DT
C mc
DT ® 0 se C ® ¥(m ® ¥)
C =
•
Serbatoi di calore naturali sono gli oceani e l’atmosfera
G.M. - Edile-Architettura 2004/05
Trasformazioni con trasferimento di calore ma
senza aumento di temperatura
•
•
Cambiamenti di fase
Somministrando calore al sistema
– La temperatura non varia
– Varia invece la quantità di sostanza che ha cambiato fase
Q=LFDm fusione
Q=LvDm evaporazione
G.M. - Edile-Architettura 2004/05
•
Un thermos isolato contiene 130 g di caffè caldo, alla temperatura di 80° C.
Per raffreddare il caffè aggiungete all’interno del thermos un cubetto di ghiaccio
di massa 12g tolto da una cella frigorifera alla temperatura di -10°C. Di quanti
gradi si sarà raffreddato il caffè dopo che il ghiaccio si è fuso e si sarà raggiunta Applicaz
ione
la condizione di equilibrio finale? Trattate il caffè come se fosse acqua pura e
trascurate gli scambi termici con l’ambiente circostante.
•
•
Dalla tabella dei calori specifici e da quello dei calori
latenti ricaviamo:
cacqua=4190 J/ kgK, cghiaccio=2220J/kgK, Lf=333kJ/kg
•
Il ghiaccio subirà le seguenti trasformazioni
– Riscaldamento da -10°C a 0°C
Q1=mghiacciocghiaccio (Tf=0°CTicghiaccio)=266.4J
– Fusione a 0°C
Q2=mghiaccioLf=3996J
– Riscaldamento da 0°C alla temperatura finale Q3=mghiacciocacqua (Tf-T0°)
•
Il caffè, invece, subirà la seguente trasformazione
– Raffreddamento da 80°C alla temperatura finale Q4=mcaffècacqua (Tf-Ticaffè) (<0)
Q1 + Q2 + Q3 = -Q 4
Tf =
Q1 + Q2 + mghiaccioc acqua(Tf - T0°C ) = -m caffècacqua( Tf - Ticaffè)
m caffèc acquaTicaffè + m ghiacciocacquaT0° C - Q1 - Q2
m caffèc acqua + m ghiaccioc acqua
130 ´ 10-3 ´ 4190 ´ 80 - 0 - 266.4J - 3996 J
=
= 66°C
-3
-3
G.M. - Edile-Architettura 2004/05
130 ´ 10 ´ 4190 + 12 ´ 10 ´ 4190
Trasferimento del
calore:conduzione
•
Trasmesso dalla struttura cristallina
P=
•
Q
DT
= kA
Dt
L
k coefficiente di conducibilità termica
T2
T1
A
L
G.M. - Edile-Architettura 2004/05
Trasferimento del calore: convezione
•
•
Si viene a stabilire un moto, detto
convettivo, attraverso il quale le
parti di fluido più calde vengono
continuamente sostituite da parti di
fluido più fredde.
Le parti di fluido riscaldate dalla
sorgente di calore allontanandosi
da essa trasportano il calore verso
la sorgente fredda e quindi
trasportano il calore dalla sorgente
più calda a quella più fredda.
G.M. - Edile-Architettura 2004/05
Trasferimento del calore: irraggiamento
•
•
Non è necessario che ci sia materia tra la sorgente calda e
quella fredda.
Il trasferimento di calore avviene attraverso l’emissione e
l’assorbimento di onde elettromagnetiche
P= s e AT4
•
•
•
•
•
s vale 5.6x10-8 Wm-2 k-4 ed è la costante di Stefan-Boltzmann,
e è il potere emissivo della sorgente ed è un numero compreso
tra 0 e 1 che dipende dalla natura della sorgente,
A è l’area della superficie che emette la radiazione
T la sua temperatura (in kelvin).
Il potere emissivo e assume il valore limite 1 nel caso in cui la
superficie emittente è assimilabile ad un corpo nero.
T2
T1
Pass= s e ATamb4
G.M. - Edile-Architettura 2004/05
•
Una barra cilindrica di rame lunga 1.2 m e con sezione di area 4.8 cm2 è isolata
per impedire perdite di calore attraverso la sua superficie laterale. Le estremità
vengono mantenute ad una differenza di temperatura di 100°C ponendo una
estremità in una miscela di acqua e ghiaccio e l’altra in acqua bollente e vapore Applicaz
ione
Trovate quanto calore viene trasmesso nell’unità di tempo lungo la sbarra
Quanto ghiaccio si fonde nell’unità di tempo all’estremità fredda
•
•
•
•
Dalla tabella delle conducibilità termiche e dei calori
latenti ricaviamo
krame=401W/ mK, Lf=333kJ/kg
Q
J
16.0
Dm L f
1 Q
16.0 -3 kg
-3 kg
s
=
=
=
=
10
= 0.048 ´ 10
J
Dt
Dt L f Dt 333 ´ 103
333
s
s
kg
G.M. - Edile-Architettura 2004/05
Espansione isoterma reversibile
•
•
•
•
•
•
•
Per realizzare una espansione isoterma in maniera reversibile di
un certa quantità di gas contenuta in un cilindro chiusa da un
pistone mobile
Togliendo un peso, la pressione esterna diventa un po’ più
bassa,
il gas si espande, il suo volume diventa un po’ più grande,
durante l’espansione il gas si raffredda un poco,
assorbe pertanto un po’ di calore dal termostato per tornare alla
temperatura costante T
In tutto questo processo, se il peso rimosso è piccolo, il gas si
trova o in uno stato di equilibrio o in uno stato molto vicino ad
uno di equilibrio che può approssimato con uno stato di
equilibrio
Se non ci sono attriti la trasformazione può essere percorsa anche
al contrario
– Anziché togliere i pesetti, si rimettono ad uno ad uno sul pistone
Pi Vi
T
Pi -DP
V i +DV
T
P
i
Stati di equilibrio
termodinamico
f
Stati che differiscono da uno stato
equilibrio termodinamico per un
infinitesimo
V
G.M. - Edile-Architettura 2004/05
Riscaldamento di un sistema termodinamico
•
Ti
Per portare un sistema termodinamico
– Nella figura è illustrato il caso di una certa quantità di gas contenuto
in volume costante
•
•
•
•
Dalla temperatura Ti alla temperatura Tf, con Tf>Ti
Basterà far interagire il sistema termodinamico , il gas, attraverso
una parete conduttrice, con un termostato a temperatura Tf e
attendere un certo tempo perché il gas si porti nello stato di
equilibrio finale.
Questa trasformazione non è reversibile, perché durante tutta la
trasformazione non c’è equilibrio termico tra il sistema
termodinamico, il gas, e l’ambiente esterno, il serbatoio di calore a
temperatura Tf
Per realizzarla in maniera reversibile bisogna procurarsi un numero
molto grande di serbatoi di calore con temperatura compresa tra Ti
e Tf, in modo che la differenza di temperatura tra due serbatoi
successivi sia molto bassa.
Q
Tf
G.M. - Edile-Architettura 2004/05
Riscaldamento reversibile di un sistema
termodinamico
•
Ti
Ti
•
•
Ti
•
•
dQ
•
Partendo dalla temperatura Ti, si mette a contatto il
serbatoio a temperatura Ti+dT, si aspetta che sia fluito il
calore
dQ=nCV dT
così il gas si porta alla temperatura Ti+ dT
Si mette in contatto il successivo termostato, si aspetta che
il calore sia fluito dal serbatoio al gas che raggiunge la
temperatura del secondo serbatoio
E così via
Il sistema si trova sempre in equilibrio o in stati molto
prossimi ad uno stato di equilibrio
Naturalmente si può ripercorre all’indietro.
T i+dT
f
Q=
f
ò nC dT = nC ò dT =
v
i
v
i
= nC v[ T]i = nC v (Tf - Ti ) = nCv DT
f
…………….
G.M. - Edile-Architettura 2004/05
Il calore dipende dalla trasformazione
•
•
•
Il primo principio stabilisce che
DU=Q-W
DU non dipende dalla trasformazione
W dipende dalla trasformazione (dW non è un differenziale esatto, dW )
Anche Q dipende dalla trasformazione (dQ non è un differenziale esatto, dQ)
•
Per una trasformazione infinitesima
dU= dQ - dW
•
Esistono due eccezioni
– Le trasformazioni a lavoro nullo (a volume costante)
– Le trasformazioni a pressione costante
•
per queste trasformazioni il calore è una funzione di stato, dipende solo dallo
stato iniziale e da quello finale.
G.M. - Edile-Architettura 2004/05
Il calore nelle trasformazioni a volume
costante
•
Il lavoro può essere valutato utilizzando i parametri dell’ambiente esterno sia
per una trasformazione reversibile che per una irreversibile.
W=Pe(Vf-Vi)
•
Ma Vf=Vi
•
Allora
(volume costante)
DU=Q
W=0 (lavoro nullo)
(per una trasformazione infinitesima dQ= dU)
– il calore scambiato nella trasformazione a volume costante è uguale alla variazione
di energia interna
– Poiché l’energia interna è una funzione di stato,
• Anche il calore in questo caso è una funzione di stato
•
Conseguenza
– Il calore scambiato in una trasformazione a volume costante (lavoro nullo) dipende
solo dallo stato iniziale e da quello finale e non dipende dalla particolare
trasformazione
– Il calore scambiati sulla trasformazione irreversibile è uguale a quello scambiato
sulla trasformazione reversibile.
G.M. - Edile-Architettura 2004/05
Il calore nelle trasformazioni a pressione
costante
•
•
•
Anche in questo caso il lavoro può essere valutato utilizzando i parametri
dell’ambiente esterno sia per una trasformazione reversibile che per una
irreversibile.
W=Pe(Vf-Vi)= PfVf-PiVi
Essendo Pf=Pi=Pe
Per il I principio della termodinamica
DU=Q-W
Q= DU+W= DU+ PfVf-PiVi=Uf-Ui + PfVf-PiVi=(Uf + PfVf)-(Ui + PiVi)
•
La grandezza H= U + PV
•
•
è una funzione di stato (entalpia)
Q= DH
Anche in questo caso il calore scambiato è una funzione di stato.
È lo stesso sia per una trasformazione reversibile che per una irreversibile
•
Per una trasformazione infinitesima
dQ= dH
G.M. - Edile-Architettura 2004/05
I calori specifici a volume e pressione
costante
•
Tornando alla definizione di calore specifico
Calore specifico a volume costante
c=
1 dQ 1 dU
=
m dT m dT V =cos t
Calore specifico a pressione costante
Calore molare a volume costante
CV =
1 dQ 1 dU
=
n dT n dT V =cos t
Calore molare a pressione costante
1 dQ 1 dH
1 dQ 1 dH
=
CP =
=
m dT m dT P=cos t
n dT n dT P= cost
Appare che è possibile esprimere i calori specifici a volume e pressione
costante in termini delle funzioni di stato U e H,
Non dipendono dalla trasformazione (purché a volume o a pressione
costante)
c=
•
•
– La trasformazione potrà essere reversibile o irreversibile il risultato è identico.
G.M. - Edile-Architettura 2004/05
Il gas perfetto
•
I gas
– Monoatomici (i gas nobili: He,Ne,
Ar, Kr, Xe)
– Biatomici (H2, O2, N2)
– Poliatomici (C O2, H2O,…)
•
•
Si comportano come gas perfetto in
condizione di bassa densità
Un gas perfetto è un gas che in ogni
condizioni soddisfa l’equazione di
stato di un gas perfetto
PV=nRT
R = 0.08205
•
•
Legge di Boyle PV=cost a T=cost
Legge di Charles, Gay-Lussac:
V1=Vo(1+btC)
b coefficiente di dilatazione di
volume = 1/273.15 per tutti i gas (in
condizioni di gas perfetto)
•
Legge di Avogadro: volumi uguali
di gas nelle stesse condizioni di
pressione e temperatura contengono
lo stesso numero di molecole.
litri × atm
joule
cal
= 8.314
= 1.986
mole × K
mole × K
mole × K
G.M. - Edile-Architettura 2004/05
L’energia interna del gas perfetto
•
•
L’espansione libera
La trasformazione è irreversibile
– Non c’è equilibrio meccanico
– La pressione è diversa nei due
contenitori
•
•
•
Vuoto
G as
Pe
fig. A
Per calcolare il lavoro dobbiamo usare i parametri
dell’ambiente:
W=PeDV
DV è la variazione del volume su cui agisce la pressione
esterna (=0 contenitore con pareti rigide)
Temperatura iniziale
=T
Facendo avvenire l’espansione in un calorimetro
– Se il gas si comporta come un gas perfetto
•
•
•
Ti=Tf
Il calore scambiato con il calorimetro è nullo (Q=Cap_terDT)
DU=Q-W=0
U(T,V1)=U(T,V2)
U non dipende da V ma solo da T.
Temperatura finale
=T
G.M. - Edile-Architettura 2004/05
Determinazione della variazione di energia interna
del gas perfetto tra due stati qualsiasi
•
Supponiamo di voler calcolare la variazione di energia
interna tra i due stati i ed f
L’energia interna è una funzione di stato: possiamo usare
una qualsiasi trasformazione che connetta lo stato i con f
Scegliamo una trasformazione costituita da una isocora,
tratto ic, e da una isoterma, tratto cf.
•
•
P
Pf
Pi
f
i
Vi
•
•
•
DUif=DUic+ DUcf
DUcf=0 perché l’energia interna del gas perfetto dipende
P
solo dalla temperatura e la temperatura non varia tra c ed f.
DUic=Qic +Wic
(Wic =0, volume costante)
Pf
Qic =nCVDT= nCV(Tf-Ti) (numero di moli per il calore
Pi
specifico molare a volume costante per la variazione di
temperatura)
DUif=nCV(Tf-Ti)
Tf
Ti
Vf
V
c
f
i
Vi
Tf
Ti
Vf
V
G.M. - Edile-Architettura 2004/05
La relazione di Mayer
CV =
•
•
1 dU
n dT V
Per un gas perfetto
H=U(T)+nRT
•
Gas monoatomici
•
Gas biatomici
CP =
1 dH
n dT P
dove H = U + PV
PV=nRT
(H(T))
3
5
R Þ CP = R
2
2
g =
CP C V + R 5
=
= = 1.6
CV
CV
3
5
7
CV = R Þ CP = R
2
2
g =
CP C V + R 7
=
= = 1.4
CV
CV
5
CV =
G.M. - Edile-Architettura 2004/05
L’equipartizione dell’energia
Kx
(
1
1
2
= m vx = kT
2
2
U = N Kx + Ky + Kz
)
k costante di Boltzmann
NA k = R
1
1 ö 3
3
3
æ1
= Nè kT + kT + kTø = NkT = nN A kT = nRT
2
2
2
2
2
2
3
1 dU 1 d( 2 nRT ) 3
CV =
=
= 2R
n dT n dT
CP = CV + R = 32 R + R = 52 R
G.M. - Edile-Architettura 2004/05
Gas biatomici
•
•
•
•
I gradi di libertà di una molecola biatomica
3 di traslazione (x,y,z)
2 di rotazione (lungo i due assi perpendicolare
alla congiungente i due nuclei
2 di oscillazione (energia cinetica e potenziale)
7
7
U = N kT = n RT
2
2
7
1 dU 1 d( 2 nRT ) 7
CV =
=
= 2R
n dT n dT
•
•
•
È come se ci fossero delle
soglie
Solo al di sopra di una certa
energia media si attivano i
gradi di libertà della rotazione e
quelli della oscillazione
Comportamento non spiegabile
con la meccanica classica
G.M. - Edile-Architettura 2004/05
•
•
Una quantità di gas ideale monoatomico alla temperatura di 10.0°C e a una
pressione di 100 kPa occupa un volume di 2.50 m3. Il gas viene riscaldato a
volume costante fino a quando la pressione diventa 300 kPa .
Determinare il calore assorbito dal gas e la variazione di energia interna.
PV = nRT
P
N
3
100
´
10
´
2.50m
2
P1Vo
m
n=
=
= 106.2mol
J
RT1 8.314
( 273.15 + 10.0)K
mol ´ K
3
P2
P1
Vo
3 N
3
300
´
10
´
2.50
m
2
P2 Vo
m
T2 =
=
= 849.4K
J
nR
8.314
106.2 mol
mol ´ K
W=0
Applic
azione
V
T
DU = Q
T+dT
3
J
DU = nC VDT = 106.2mol ´ ´ 8.134
(849.4 - 283.15)K =
2
mol ´ K
= 733.7kJ
G.M. - Edile-Architettura 2004/05
•
•
Una quantità di gas ideale biatomico alla temperatura di 0.0°C e a una
pressione di 100 kPa occupa un volume di .50 m3. Il gas viene riscaldato a
pressione costante fino a quando il volume raddoppia.
Determinare il calore assorbito dal gas, la variazione di energia interna, il lavoro
effettuato.
P
Applic
azione
PV = nRT
N
3
´
.50m
2
PVi
m
n=
=
= 22.0mol
J
RTi 8.314
( 273.15)K
mol ´ K
100 ´ 103
3 N
3
100
´
10
´
1.00m
2
PVf
m
Tf =
=
= 546.7K
J
nR 8.314
22.0mol
mol ´ K
P
Vi
Vf
V
W = P(Vf - Vi ) = 100 ´103 Pa ´ (1.00 - .50) = 50kJ
T
5
J
DU = nC VDT = 22.0mol ´ ´ 8.134
(546.7 - 273.15)K =
2
mol ´ K
T+ dT
= 122.4 kJ
7
J
Q = nCP DT = 22.0mol ´ ´ 8.134
(546.7 - 273.15)K = 171.4kJ
2
mol ´ K
G.M. - Edile-Architettura 2004/05
•
Calcolate il lavoro svolto da una certa quantità di ossigeno durante una
espansione isoterma alla temperatura di 0.00°C da un volume di 16.8L e
pressione iniziale Pi a un volume di 22.4 L e Pf =1 bar di pressione.
N
-3 3
´
22.4
´10
m
2
Pf Vf
m
n=
=
= 0.99mol
J
RTf 8.314
( 273.15) K
mol ´ K
10 5
Applic
azione
P
Pf
Isoterma
W=
dW = PdV
ò
f
PdV =
i
ò
f
i
nRT
dV = = nRT
V
ò
f
i
T
dV
V
Vf
= nRT [logV ]i = nRT (logVf - logVi ) = nRTlog
f
W = nRT log
DU = 0
Pi
Vf
Vi
Vi
V
PV = nRT
Vf
J
22.4
=1mol ´8.314
273.15K log
= 653,17J
Vi
molK
16.8
DU = Q - W
Q=W
G.M. - Edile-Architettura 2004/05
•
Una certa massa di gas occupa un volume di 4.3 L a una pressione di 1.2 bar e
una temperatura di 310 K.
• Essa viene compressa adiabaticamente e reversibilmente fino a un volume di
0.76 L.
• Determinare la pressione finale e la temperatura finale supponendo che si tratti
di un gas ideale per il quale g=1.4.
• Dobbiamo innanzitutto determinare l’espressione di una adiabatica reversibile.
• Troveremo infatti che l’adiabatica reversibile vale
PV = nRT
PV g = cos t
•
Applic
azione
O una equazione che deriva da questa utilizzando l’equazione di stato
PV g =
1
g
nRT g
V = cost Þ TV g -1 = cost
V
1
g
nRT
P V =P
= cost Þ TP
P
1
-1
g
= cost
G.M. - Edile-Architettura 2004/05
Le trasformazioni del gas perfetto:
adiabatica
reversibile
•
P
Consideriamo un tratto infinitesimo di adiabatica
reversibile
dU = dQ - dW
dQ = 0
Pi
Þ dU = -dW
dU = nCV dT
Þ nCVdT = -PdV
dW = PdV
nC VdT = -
Adiabatica
nRT
dV
V
CV dT
dV
=C P - CV T
V
Pf
Vi
Vf
V
1
dT
dV
=CP
T
V
-1
CV
1 dT
dV
=g -1 T
V
G.M. - Edile-Architettura 2004/05
Le trasformazioni del gas perfetto:
adiabatica
reversibile
P
1 dT
dV
=g -1 T
V
•
Adiabatica
Pi
Sommiamo su tutti i tratti infinitesimi
ò
f
i
1 dT
=g -1 T
ò
f
i
dV
V
1
T
V
log f = -log f
g -1
Ti
Vi
1
1
æ Tf ö g-1
V
log ç ÷
= log i
è Ti ø
Vf
g -1
Tf Vf
g -1
= Ti Vi
æ Tf ö g -1 Vi
ç ÷
=
è Ti ø
Vf
TV
g -1
= cos t
Pf
Vi
Vf
Tf æç Vi ö÷
=
Ti è Vf ø
V
g -1
come funzione di P e V
PV g -1
TV g -1 =
V
= cost Þ PV g = cost
nR
utilizzando l'equazione di stato
PV=nRT
G.M. - Edile-Architettura 2004/05
•
•
•
•
Una certa massa di gas occupa un volume di 4.3 L a una pressione di 1.2 bar e
una temperatura di 310 K.
Essa viene compressa adiabaticamente fino a un volume di 0.76 L.
Determinare la pressione finale e la temperatura finale supponendo che si tratti
di un gas ideale per il quale g=1.4.
Applic
azione
PV = nRT
L’ adiabatica reversibile vale
PV g = cos t
g
g
Pf Vf = Pi Vi
g
1.4
æ
V
ö
4.3
æ
ö = 13.56bar
Pf Vfg = Pi ç i ÷ = 1.2 ´ 105
è 0.76 ø
è Vf ø
g -1
Tf Vf
g -1
= Ti Vi
Pi Vi = nRTi
Pf Vf = nRTf
æ Vi ö
Tf = Ti ç ÷
è Vf ø
Tf = Ti
g-1
æ 4.3 ö
= 310K
è 0.76 ø
0.4
= 620K
Pf Vf
Pi Vi
13.56bar ´ 0.76L
Tf = 310K
= 619.1K
1.2bar ´ 4.3L
G.M. - Edile-Architettura 2004/05
•
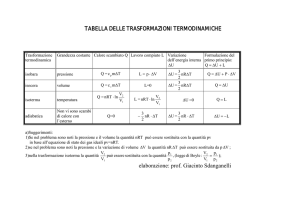
•
In figura sono illustrate le quattro trasformazioni reversibili (isocora, isobara,
isoterma ed adiabatica) subite da una certa quantità di gas ideale.
Identificate le quattro trasformazioni e poi ordinatele
– secondo i valori decrescenti del calore assorbito dal gas
– secondo i valori decrescenti del lavoro effettuato dal gas
– secondo i valori decrescenti della variazione di energia interna
•
–
–
–
–
•
1
2
3
4
Isobara
Isoterma
Adiabatica
Isocora
Secondo valori decrescenti della
variazione di energia interna
DU=nCVDT
– 1 Isobara
– 2 Isoterma
– 3 Adiabatica, 4 Isocora a pari
merito
PV = nRT
•
•
•
•
Secondo valori decrescenti del lavoro
effettuato (area al di sotto della
trasformazione)
•
Applic
azione
1
2
3
4
Isobara
Isoterma
Adiabatica
Isocora
Secondo valori decrescenti del calore
assorbito Q= DU+W
–
–
–
–
1
2
3
4
Isobara (Q= DU+W)
Isoterma (Q=W)
Adiabatica, (Q=0)
Isocora (Q<0) G.M. - Edile-Architettura 2004/05
L’adiabatica ha una pendenza più elevata
della isoterma passante per lo stesso stato
PV = Po Vo
PV g = Po Vog
PV
P= o o
V
Po Vog
P=
Vg
per l' isoterma
dP
dV
Vo
P
æ 1
= Po Vo - 2 ö
=- o
è V øV
Vo
o
P
Po
Isoterma
Adiabatica
Vo
To
V
g -1
æ
dP
ö
P
g ç gV
per l' adiabatica
= Po Vo - 2 g ÷
= -g o
dV Vo
è V ø
Vo
Vo
• Tutte e due le pendenze sono negative
• L’adiabatica ha una pendenza che è g volte quella dell’isoterma
• Ma g è maggiore di 1 (CP>CV)
• La pendenza dell’adiabatica in valore assoluto è più grande di quella
dell’adiabatica
G.M. - Edile-Architettura 2004/05
•
Un gas monoatomico ideale, a una temperatura iniziale To (in Kelvin) si espande
da un volume Vo ad un volume 2Vo per mezzo di uno dei cinque processi indicati
nel grafico delle temperature in funzione del volume mostrato in figura.
– In quale processo l'espansione è
Applic
azione
• isoterma
• isobara (pressione costante)
• adiabatica
– Date una spiegazione alle vostre risposte.
•
•
Isoterma trasformazione AE
Isobara trasformazione AC
PVo = nRTo
P2Vo = nRT1
ß
T1 = 2To
•
Adiabatica trasformazione AF
T1 (2Vo )
g -1
= To Vog -1 Þ T1 =
To
To
=
g-1
1.66- 1 = .63To
2
2
G.M. - Edile-Architettura 2004/05
•
•
•
•
•
Un gas ideale subisce una compressione adiabatica reversibile da P=1.0 bar,
V=1.0 106 litri, T=0.0 °C a P= 1.0 105 bar, V=1.0 103 litri.
Applic
Si tratta di un gas monoatomico, biatomico o poliatomico?
azione
Qual è la temperatura finale?
Quante moli del gas sono presenti?
Qual è l’energia cinetica traslazionale per ogni mole prima e dopo la
compressione?
g
æ
Pi
V
ö
Pi
Vf
f ÷
g
g
ç
=
Þ
log
=
glog
PiVi = PfVf
Pf è Vi ø
Pf
Vi
Pi
1
log
log 5
Pf
log10-5 -5 ´ log10 5
10
g =
=
=
=
= = 1.66
Vf
103 log10-3 -3 ´ log10 3
log
log 6
Vi
10
Po Vo
105 Pa ´ 10 3 m 3
• Il gas è monoatomico
Po Vo = nRTo Þ n =
=
= 44000mol
RTo 8.31 J 273.15K
molK
PV
Tf = f f
nR
1010 Pa ´ 1m 3
Þ Tf =
= 27349K
J
8.31
44000mol
molK
3
3
3
3
Tf = K = kT Þ Kmol =NA kT = RT = 8.31 ´ 273.15 = 3404J
2
2
2
2
G.M. - Edile-Architettura 2004/05