Termodinamica dei composti contenenti
fosfato
MOLTE REAZIONI BIOCHIMICHE POSSONO PROCEDERE IN
QUANTO I PRODOTTI VENGONO RIMOSSI EFFICIENTEMENTE
IN ALCUNI CASI QUESTA RIMOZIONE NON E’ SUFFICIENTE; IN
QUESTO CASO E’ NECESSARIO CHE LA REAZIONE VENGA
“TRASCINATA”
AB
G0’ = + 10 kJ/mole
CD
G0’ = - 30 kJ/mole
SE LA CELLULA ACCOPPIA QUESTE DUE REAZIONI IL G0’
COMPLESSIVO SARA’ LA SOMMA ALGEBRICA DEI SINGOLI
VALORI
AB
G0’ = + 10 kJ/mole
CD
G0’ = - 30 kJ/mole
A+C B+D
G0’ = - 20 kJ/mole
“TRASCINARE” UN PROCESSO CON L’ACCOPPIAMENTO E’ UN
EVENTO USUALE CHE NELLA CELLULA DEBBONO ESISTERE
COMPOSTI CHE POSSONO ANDARE INCONTRO A REAZIONI
CHE COMPORTANO VARIAZIONI NEGATIVE DI ENERGIA LIBERA
QUESTI
COMPOSTI
SONO
CONSIDERATI
TRASPORTATORI DI ENERGIA LIBERA NELLE CELLULE
COME
Termodinamica dei composti contenenti
fosfato
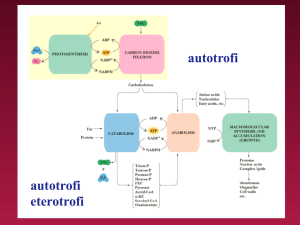
Questi intermedi rappresentano quindi una sorta di
“moneta” universale sotto forma di energia libera che
viene scambiata tra le reazioni che producono energia
libera e quelle che invece la consumano
La forma di energia chimica più utilizzata è
l’ADENOSINA TRIFOSFATO (ATP) che è presente in
tutte le forme di vita
Il suo ruolo centrale nel metabolismo è stato
scoperto per la prima volta nel 1941 da Fritz Lipmann
e da Herman Kalclar
L’ATP è costituito dall’adenosina cui sono legati
sequenzialmente tre gruppi fosforici (-PO3 2-)
Il primo fosfato è legato mediante un legame
fosfoesterico, gli altri due da legami fosfoanidridici,
definiti legami ricchi
L’adenosina
difosfato
(ADP)
e
l’adenosina
monofosfato (AMP) sono chimicamente simili all’ATP,
ma contengono rispettivamente soltanto due gruppi
fosforici ed un gruppo fosforico
L’IDROLISI DELL’ATP E’ ALTAMENTE ESOERGONICA
AVENDO UN G0’ = - 31 kJ/mole
MOLTI ALTRI SONO I COMPOSTI ORGANICI PRESENTI NELLA
CELLULA DEPUTATI AL TRASFERIMENTO DI ENERGIA LIBERA
AD ALTRI COMPOSTI
TUTTI QUESTI COMPOSTI PRESENTANO IL “LEGAME
FOSFATO AD ALTA ENERGIA”, CHE IN REALTA’ NON E’ IL
DIRETTO RESPONSABILE DELLA LIBERAZIONE DI COSI’
TANTA ENERGIA.
QUALI SONO I MOTIVI PER CUI L’IDROLISI DI QUESTI
COMPOSTI LIBERA COSI’ TANTA ENERGIA?
1) STABILIZZAZIONE
PRODOTTO
PER
RISONANZA
DEL
FOSFATO
Lo ione ORTOFOSFATO (HPO4-; abbreviato con Pi) possiede
una grande varietà di forme di risonanza. Sia il protone che il
legame tra ossigeno e fosforo devono essere considerati
delocalizzati:
LE DIVERSE FORME, CHE POSSIEDONO UGUALE ENERGIA,
CONTRIBUISCONO ALL’ELEVATA ENTROPIA DI QUESTA
STRUTTURA DI RISONANZA. IL RILASCIO DEL FOSFATO
DETERMINA UN AUMENTO DELL’ENTROPIA DEL SISTEMA
2) ULTERIORE IDRATAZIONE DEI PRODOTTI DI IDROLISI
Il rilascio del residuo fosforico di un composto aumenta le
possibilità di idratazione soprattutto se entrambi i prodotti sono
carichi (l’idratazione è uno stato energetico altamente
FAVORITO)
3) REPULSIONE ELETTROSTATICA TRA I PRODOTTI CARICHI
Nella idrolisi dei composti contenenti fosfato i prodotti
dell’idrolisi portano una carica negativa. La repulsione tra
questi prodotti ionici favorisce fortemente la reazione di idrolisi
4)
AUMENTO
DELLA
STABILIZZAZIONE
RISONANZA O TAUTOMERIZZAZIONE
MEDIANTE
Talvolta l’idrolisi è favorita anche dalla capacità dell’altro
prodotto di assumere diverse forme molecolari
Reazioni di trasferimento del gruppo
fosforico
Le reazioni di trasferimento del gruppo fosforico:
R1O PO3 2- + R2 OH R1 OH + R2 O
PO3 2Sono molto rilevanti per il metabolismo in
generale. Le reazioni di questo tipo più importanti
sono la sintesi e l’idrolisi dell’ATP:
ATP + H2O ADP + Pi
ADP + H2O AMP + PPi
dove Pi e PPi rappresentano rispettivamente
l’ortofosfato ed il pirofosfato.
Queste reazioni altamente esoergoniche
sono accoppiate a numerosi processi
biochimici endoergonici per renderli
possibili. L’ATP viene poi rigenerato
accoppiando la sua sintesi ad un processo
ancora più esoergonico
Per illustrare meglio questi concetti, prendiamo in
considerazione due esempi di reazioni di
trasferimento del gruppo fosforico.
La tappa iniziale del metabolismo del glucosio è la
sua conversione in glucosio-6-fosfato.
La reazione diretta del glucosio con il Pi è
termodinamicamente
sfavorita
in
quanto
caratterizzata da un G 0’ positivo.
Nei sistemi biologici però questa reazione
è accoppiata all’idrolisi esoergonica
dell’ATP in modo tale che la reazione
complessiva risulti termodinamicamente
possibile.
Perché due reazioni risultino accoppiate
occorre che abbiano in comune una
sostanza che sia al tempo stesso un
prodotto della prima e un reagente della
seconda
Questa sostanza è il fosfato
Perché il processo che coinvolge le due reazioni
sia favorito occorre che la somma algebrica dei G
0’ delle due reazioni sia negativa, cioè che il G 0’
della reazione esoergonica superi in valore
assoluto quello della reazione endoergonica. L’ATP
può inoltre, essere sintetizzato, ad esempio, a
partire da ADP e Pi mediante idrolisi più
esoergonica del fosfoenolpiruvato
L’utilità
bioenergetica
delle
reazioni
di
trasferimento del gruppo fosforico è data dalla loro
stabilità cinetica all’idrolisi, combinata con la loro
capacità di trasferire grandi quantità di energia
libera
L’energia libera di idrolisi viene spesso indicata
come potenziale di trasferimento del gruppo
fosforico, che è una misura della tendenza dei
composti fosforilati a trasferire i loro gruppi
fosforici all’acqua
L’ATP ha un valore di potenziale di
trasferimento
del
gruppo
fosforico
intermedio
In condizioni standard i composti che nella
tabella successiva si trovano sopra all’ATP
(hanno cioè un potenziale più negativo)
trasferiscono spontaneamente un gruppo
fosforico all’ADP per formare ATP, il quale, a
sua volta, può trasferire spontaneamente un
gruppo fosforico ai prodotti dell’idrolisi (la
forma ROH) dei composti elencati sotto di lui
(composti con potenziale meno negativo)
TABELLA 4.1 Energie libere standard di idrolisi del gruppo
fosforico di alcuni composti
COMPOSTO
G °’(KJ mole -1)
Fosfoenolpiruvato
- 61,9
1,3-difosfoglicerato
- 49,9
Acetil fosfato
- 43,1
Fosfocreatina
- 43,1
PP
- 33,5
ATP( AMP+PPi)
- 32,2
ATP ( ADM + Pi)
- 30,5
Glucosio-1-fosfato
- 20,9
Fruttosio-6-fosfato
- 13,8
Glucosio-6-fosfato
- 13,8
Glicerolo-3-fosfato
- 9,2
TABELLA 4.2 Alcune reazioni accoppiate cui partecipa l’ATP: (a) la
fosforilazione del glucosio a glucosio-6-P ed ADP. (b) La fosforilazione
dell’ADP ad opera del fosfoenolpiruvato con formazione di ATP e
piruvato. Ogni reazione è stata suddivisa nella reazione di fosforilazione
(semi-reazione 1) e nell’idrolisi dell’ATP (semi-reazione 2). Le due semireazioni procedono nella direzione in cui la reazione complessiva risulta
esoergonica (G<0)
(a) Semi-reazione
endoergonica 1
Pi + glucosio Glucosio-6-P + H2O
G °’
(KJ mole -1)
+ 13,8
Semi-reazione
esoergonica 2
ATP + H2O ADP + Pi
- 30,5
Reazione complessiva
accoppiata
ATP + glucosio ADP + glucosio-6-P
- 16,7
(b) Semi-reazione
esoergonica 1
Fosfoenolpiruvato + H2O Piruvato + Pi
- 61,9
Semi-reazione
endoergonica 2
ADP + Pi ATP + H2O
+ 30,5
Reazione complessiva
accoppiata
Fosfoenolpiruvato + ADP Piruvato + ATP
- 31,4
Sintesi dell’ATP
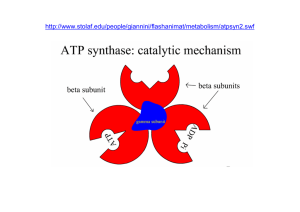
La sintesi di ATP avviene a livello delle membrane,
utilizzando il potenziale e i gradienti protonici di
membrana e con la catalisi di una ATP-sintasi,
secondo la reazione :
ADP 3- + Pi 2- ATP4+ + H2O
L’ATP-sintasi è un enzima con struttura
tipica costante, qualunque sia l’origine
(mitocondri,
cloroplasti,
membrane
citoplasmatiche di batteri eterotrofi o
membrane di procarioti fotosintetici)
Essa è costituita da due sub-unità:
F0, unità idrofobica di ancoraggio alla
membrana e canale ionico;
F1, centro attivo, costituito da 3 sub-unità
e 3 sub-unità
Come noto l’energia liberata durante il
trasporto degli elettroni secondo gradiente
viene utilizzata dall’ATP- sintetasi per la
produzione di energia sotto forma di ATP. Il
processo è noto come FOSFORILAZIONE
OSSIDATIVA
nel
mitocondrio
e
FOTOFOSFORILAZIONE nel cloroplasto
I protoni possono ritornare indietro
attraverso due sistemi:
- ANTIPORTO,
un
protone
scambiato con un altro catione
viene
- SIMPORTO, un protone è trasportato
nel compartimento e l’energia per il
trasporto è fornita dal simultaneo
trasporto di un anione o un’altra
molecola nella stessa direzione
Gradiente protonico elettrochimico di
membrana
Durante il trasporto elettronico si stabilisce
gradiente protonico, cioè concentrazioni di
maggiori in un compartimento rispetto all’altro
esempio, interno rispetto all’esterno nel caso
tilacoidi ed in senso inverso, esterno-interno,
caso delle creste mitocondriali)
un
H+
(ad
dei
nel
Gli atomi e le molecole elettricamente cariche
possono attraversare la membrana solo con l’aiuto di
specifiche proteine di membrana (canali ionici o
pompe ioniche)
Le POMPE IONICHE trasportano gli ioni in modo
attivo creando una distribuzione di cariche ineguale
ai due lati della membrane formando così un
GRADIENTE ELETTROCHIMICO
La forza protomotrice p che si determina fra i due
compartimenti si compone di due parti:
a. il potenziale di membrana
b. il gradiente di concentrazione protonica z pH
Il termine z vale 59 mV per il trasferimento di un
elettrone;
ad esempio, nel caso dei tilacoidi, per un pH di 2,7 si
ha un valore di potenziale attribuibile al gradiente
protonico di 160 mV
Questo termine è preponderante rispetto al
potenziale
di
membrana
essendo
la
forza
protomotrice totale dell’ordine di 200 mV
H+ = F. + RTIn[H+] A/[H+]B
H+/ F = + z pH = p(forza motrice protonica)
p = - z pH
3 H+ sono necessari per la sintesi di 1 ATP
Nella tabella 4.3 sono rappresentati i valori delle
membrane cloroplastiche e mitocondriali
TABELLA 4.3 Valori tipici di , z pH e
mitocondriali e tilacoidali
p
delle membrane
z pH
p
Mitocondri (mV)
90
40
130
Tilacoidi (mV)
40
160
200