ENDOCRINOLOGIA
Organi endocrini
ormoni
Gli organismi multicellulari devono disporre di sistemi di controllo per il
mantenimento della propria omeostasi, per adattarsi all’ambiente e per
svolgere tutte le loro funzioni.
I sistemi di controllo si avvalgono di specifiche molecole che, legandosi a
recettori, controllano e modificano il funzionamento delle cellule.
Il più evidente sistema di controllo è il sistema nervoso, che coordina
l’attività di molte cellule liberando appunto specifiche molecole
denominate «mediatori chimici» (es. acetilcolina, noradrenalina) alle
terminazioni dei neuroni.
Ma molte altre cellule liberano molecole che hanno effetti regolatori sul
funzionamento di cellule e tessuti, secondo tre modalità
1) Effetti autocrini: le molecole liberate agiscono sulle stesse cellule che
le hanno prodotte
2) Effetti paracrini: le molecole liberate si propagano nel liquido
interstiziale ed agiscono su cellule circostanti
3) Effetti endocrini: le molecole liberate entrano nel torrente
circolatorio ed agiscono su cellule (o tessuti) bersaglio in tutto
l’organismo, laddove siano presenti recettori specifici.
La secrezione endocrina (anche detta secrezione interna) è soprattutto
effettuata da cellule raccolte in specifici organi endocrini, classicamente
chiamati ghiandole. Esistono però, in alcuni casi, anche cellule
secernenti sparse o raggruppate in piccoli agglomerati, che hanno le
stesse funzioni. Le molecole liberate in circolo sono chiamate ormoni
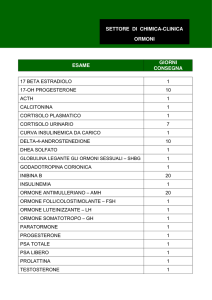
Classificazione biochimica degli ormoni
PROTEICI:
• Ormone della crescita (GH)
• Prolattina (PRL)
• Ormone adrenocorticotropo (ACTH)
• Paratormone (PTH)
• Calcitonina
• Insulina
• Glucagone
• Somatostatina
• Polipeptide pancreatico
• Ormoni ipotalamici (CRH, TRH, GHRH, GnRH)
• Inibenti VIP
• Vasopressina (ormone antidiuretico ADH)
• Ossitocina
Classificazione biochimica degli ormoni
GLICOPROTEICI:
• Ormone tireotropo TSH)
• Ormone follicolo-stimolante (FSH)
• Ormone luteinizzante (LH)
• Gonadotropina corionica (hCG)
STEROIDEI:
• Cortisolo
• Aldosterone
• 17 β-estradiolo
• Progesterone
• Testosterone
DERIVATI DA AMINE:
• Tetraiodotironina (T4)
• Adrenlina
Triiodotironina (T3)
Noradrenalina
Gli ormoni sono normalmente prodotti nel reticolo endoplasmatico
delle rispettive cellule sotto forma di pro-ormoni e accumulati
nell’apparato di Golgi spesso racchiusi in vescicole. Possono essere
attivati all’interno o all’esterno delle cellule.
Sono in genere trasportati nel sangue legati a specifiche proteine
trasportatrici (albumine o globuline), che ne prolungano la vita in
circolo.
I recettori possono trovarsi sulle membrane cellulari o sui nuclei
(quando la struttura dell’ormone permette il suo passaggio attraverso la
membrana).
La concentrazione ematica di ciascun ormone dipende dall’equilibrio fra
velocità di sintesi (o di liberazione) e velocità di eliminazione ed è
costantemente regolata in maniera molto precisa.
Il principale sistema endocrino è l’asse ipotalamo-ipofisi, che regola la
funzione di numerose altre ghiandole endocrine e collega il sistema
endocrino con quello nervoso.
L’ipotalamo è collegato con l’ipofisi attraverso un peduncolo che
contiene vasi e nervi: i primi formano il circolo portale ipotalamoipofisario, mentre i secondi realizzano la neurosecrezione nell’ipofisi
posteriore.
Tutti gli ormoni prodotti dall’ipofisi, e in parte anche i fattori rilascianti
prodotti dall’ipotalamo, agiscono principalmente sulle loro cellule
bersaglio, ma, essendo ormoni che entrano in circolo, hanno anche
effetti diretti su altre cellule (non tutti noti).
L’attività dell’asse ipotalamo-ipofisi è prevalentemente controllata a
feed-back negativo dagli stessi ormoni che esso controlla
Ormone della crescita - GH
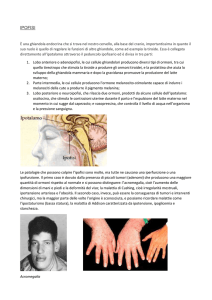
Patologie correlate:
Durante l’accrescimento:
gigantismo (ipersecrezone)
nanismo (iposecrezione)
Patologie correlate:
Nell’adulto:
Acromegalia: crescita abnorme di ossa piatte (fronte,
zigomi), ingrossamento delle
dita, diabete.
Non si conoscono effetti della
iposecrezione nell’adulto.
L’unico ormone ipofisario che agisce direttamente, non attraverso la
regolazione di altri organi endocrini, è l’ormone della crescita (Growth
Hormone – GH):
Ruolo principale: regolatore della crescita dell’organismo e del
metabolismo.
Meccanismo d’azione: stimola la sintesi proteica, la gluconeogenesi (da
precursori lipidici) e la lipolisi; provoca ritenzione di sodio e di azoto.
Azione specifica sulle cartilagini di accrescimento.
Effetto indiretto: stimola la produzione di IGF (insuline-like growth
factor) nel fegato e in altri tessuti. IGF(1) coadiuva le azioni di GH, ma ha
effetti opposti sul metabolismo, riducendo la glicemia e favorendo la
deposizione di trigliceridi.
La regolazione della secrezione è basata su molteplici anelli a feed-back
negativo. L’ipotalamo produce un GHRH (releasing factor) ed un fattore
inibente chiamato somatostatina. Stato nutrizionale, sonno e vari fattori
ambientali influenzano la produzione di GH. Esiste anche un chiaro
ritmo circadiano, con un picco durante il sonno.
Uso del GH per produrre ipertrofia muscolare: nonostante l’indubbia
azione sulla sintesi proteica, l’effetto terapeutico è modesto e la
concomitante iperglicemia induce un diabete da esaurimento delle
cellule beta del pancreas resistente alla terapia.
LA TIROIDE
Posizione
Ipertiroidismo
Struttura
Ipotiroidismo
La tiroide presenta follicoli ripieni di una sostanza ialina chiamata
colloide e fatta della proteina tireoglobulina: molecole molto grandi su
cui sono presenti anelli di tirosina. Una speciale catena enzimatica lega
uno o due ioni iodio alla tirosina, formando rispettivamente
monoiodotirosina (MIT) e diiodotirosina (DIT). Una molecola di DIT lega
un MIT formando triiodotirosina (T3) oppure una altro DIT formando
tetraiodotirosina (tiroxina – T4). Le forme secrete sono T3 e T4. T4 è la
forma di gran lunga più abbondante, ma si trasforma in T3 nelle cellule
bersaglio. T3 pertanto è la forma effettivamente attiva.
La colloide, prodotta nel reticolo endoplasmatico e accumulata nello
spazio intracellulare viene attaccata da lisosomi, che staccano gli
aminoacidi iodati: T3 e T4 sono secreti per pinocitosi ed entrano nel
torrente circolatorio, dove sono trasportati prevalentemente in legame
con proteine specifiche. MIT e DIT sono deiodinati e tutti i prodotti
residui sono riutilizzati per la produzione di nuova colloide, limitando il
fabbisogno giornaliero di iodio. Tutte le fasi della produzione e della
secrezione di ormoni tiroidei sono controllate dall’asse ipotalamo-ipofisi.
L’ipotalamo produce un fattore (TRF) che stimola la liberazione
dell’ormone ipofisario TSH, che agisce direttamente sulle cellule
follicolari tiroidee: aumenta la captazione dello iodio, stimola la
produzione di colloide e il suo riassorbimento, regolando quindi
l’immissione in circolo di T3 e T4.
La produzione di TRF è controllata a feed-back negativo dalla
concentrazione di T3 e T4.
La carenza di iodio nella dieta, oppure il consumo prevalente di verdure
che inibiscono il riassorbimento dello iodio (cavoli) (problema diffuso ad
esempio in alcune vallate alpine, prima dello sviluppo delle conoscenze),
provoca, oltre ad altri numerosi sintomi dell’ipotiroidismo, una caratteristica ipertrofia tiroidea che si manifesta come gozzo (ipotiroideo)
perché le tirosine non iodate non possono essere secrete e si
accumulano nei follicoli, continuamente stimolate dal TSH. Esistono
anche varie forme di gozzo ipertiroideo, accompagnate da iperfunzione.
L’ipotiroidismo durante la vita fetale o dopo la nascita provoca l’aborto
precoce o una sindrome chiamata cretinismo, con nanismo
(ipotiroideo):
Gli ormoni tiroidei sono indispensabili per la differenziazione dei tessuti
e la formazione degli organi. Classico esempio: i girini tenuti in un
ambiente privo di iodio non subiscono la metamorfosi a rane.
Nell’adulto, c’è una classica sindrome da ipertiroidismo, nota come
morbo di Basedow, su base autoimmunitaria, oppure ci possono essere
vari tipi di neoplasie benigne (cisti) o maligne (carcinoma) caratterizzate
da ipersecrezione tiroidea e presenza di gozzo più o meno vistoso.
L’aspetto caratteristico del volto basedowiano non è dovuto agli ormoni
tiroidei, ma ad un effetto diretto del TSH che provoca accumulo di
collagene retro orbitale. La sintomatologia generale comprende:
ipertermia (aumento della temperatura), dimagrimento, irritabilità e
instabilità dell’umore, insonnia, iperfagia, tachicardia con modesta
ipertensione, tremore muscolare fine.
L’ipotiroidismo nell’adulto, anch’esso caratterizzato da una facies
specifica, presenta sintomi opposti: ipotermia, affaticabilità, torpore e
sonnolenza, aumento di peso pur con scarso appetito, ritenzione idrica,
edema duro (mixedema), bradicardia e ipotensione.
Tutti i sintomi di iper ed ipo secrezione sono riconducibili al principale
meccanismo d’azione dei T3-T4: questi ormoni stimolano i nuclei delle
cellule inducendoli ad aumentare la sintesi proteica e in particolare la
sintesi degli enzimi della catena respiratoria. La principale variabile
regolata dalla tiroide è quindi il metabolismo basale, e con esso il
consumo di ossigeno e la temperatura corporea.
Nell’ipertiroidismo, la frequenza cardiaca aumenta per meccanismo
diretto ed indiretto: c’è un’azione diretta sulle cellule del nodo del seno
(aumento dell’eccitabilità), ma c’è anche una importante vasodilatazione
periferica provocata dall’aumento del metabolismo, che è corretta dal
baroriflesso con un aumento della frequenza.
Tutti i sintomi neurologici sono dovuti alla regolazione dell’eccitabilità
generale dei neuroni da parte degli ormoni tiroidei, e sono abbastanza
autoesplicativi.
Il cretinismo è una conseguenza della mancata maturazione di varie aree
cerebrali, che non sono ancora completamente differenziate alla nascita.
L’azione degli ormoni tiroidei è indispensabile per gli effetti del GH e
aumenta gli effetti delle catecolamine
LA SURRENALE
Secondo la terminologia classica: capsule a forma di « berretto frigio »
poste al di sopra dei reni
ORMONI CORTICOSURRENALI
Adenoma della corticale del
surrene: sindrome di Cushing.
Aspetto tipico con faccia a luna
piena, depositi di grasso sul
dorso e sull’addome, irsutismo, strie cutanee, pelle secca,
obesità, ritenzione idro-salina,
ipertensione e molti altri segni
caratteristici
Insufficienza corticosurrenale: morbo di Addison. Dimagrimento e
astenia, grave ipotensione, iperpotassiemia
Gli ormoni della coricale derivano tutti dal colesterolo (ormoni
steroidei), secondo una serie di passaggi ben descritti in tutti i libri.
Piccole variazioni nella formazione degli ormoni ne determinano la
funzione. Si distinguono tre categorie:
• Glucocorticoidi (colesterolo)
• Mineral corticoidi (aldosterone)
• Ormoni sessuali (testosterone, progesterone, estrogeni).
Ogni ormone ha un’azione specifica, ma ha anche minori effetti simili a
quelli degli altri corticosteroidi.
GLUCOCORTICOIDI
La parte fascicolata, che produce glucocorticoidi, è controllata
dall’ormone ipofisario adrenocorticotropo (ACTH), a sua volta
controllato da un releasing factor ipotalamico. La sua azione consiste
prevalentemente nell’aumentare la glicemia, stimolando la gluconeogenesi ed inibendo l’utilizzazione del glucosio per interazione con gli
effetti dell’insulina (azione anti-insulinica). Fornisce substrati per la
gluconeogenesi attraverso l’inibizione della sintesi proteica. Tutti gli
effetti, anche quelli sfruttati in terapia, dipendono da questo
meccanismo d’azione: il più importante è un effetto anti infiammatorio,
dovuto al blocco della produzione di anticorpi; ritarda la guarigione delle
ferite (e così ne previene l’eccessiva fibrosi).
Il cortisolo è considerato il principale ormone anti stress, proprio perché
blocca la risposta infiammatoria, blocca i processi anabolici ed aumenta
la disponibilità di substrati per le cellule.
MINERALCORTICOIDI
La parte glomerulosa, che produce mineralcorticoidi, è controllata in
minima parte dall’ormone ipofisario adrenocorticotropo (ACTH), mentre
lo stimolo principale per la liberazione in circolo di aldosterone è
rappresentato dall’angiotensina II. La sua azione si esplica a livello delle
parti tubulari delle ghiandole tubuloacinose, ma è quantitativamente
più importante sui tubuli contorti distali del rene dove promuove il
riassorbimento del sodio (parte facoltativa del riassorbimento),
scambiandolo con K+ e H+. Ha quindi un’importante azione anti
ipotensiva e contribuisce alla regolazione dell’equilibrio idro-salino e del
pH. Contemporaneamente, promuove l’escrezione del potassio,
mantenendone bassa la concentrazione nel liquido interstiziale (e nel
plasma): un aumento della potassiemia riduce la negatività delle cellule
eccitabili a riposo, aumentandone l’eccitabilità (il livello soglia si
raggiunge prima) ma riducendo l’ampiezza dei potenziali d’azione, fino a
rendere le cellule completamente ineccitabili. Un aumento eccessivo
arresta il cuore in sistole.
ORMONI SESSUALI (androgeni)
La parte reticolata produce una serie di ormoni che hanno come
bersaglio principale le gonadi, ma sono soprattutto responsabili della
manifestazione dei caratteri sessuali secondari, comprese manifestazioni
comportamentali (aggressività e libido). La loro importanza è dovuta al
fatto che sono le uniche fonti di ormoni del sesso opposto, sia per i
maschi sia per le femmine.
MIDOLLARE SURRENALE
La parte midollare ha una diversa origine embrionale ed è innervata da
fibre simpatiche pregangliari (nervi splancnici). Le sue cellule specifiche,
chiamate cromaffini, liberano una miscela di catecolamine, con
prevalenza di adrenalina. Gli effetti delle catecolamine circolanti si
aggiungono a quelli delle stesse sostanze liberate dalle terminazioni
postgangliari del simpatico, ma la maggiore concentrazione di
adrenalina rende più importanti gli effetti metabolici.
Esiste un tipo di tumore, generalmente benigno, chiamato feocromocitoma, che produce gravi episodi ipertensivi. Al contrario, vi può essere
un’assenza ereditaria delle midollari, con sindrome ipotensiva
conclamata.
Tutte le condizioni che comportano un aumento del tono del simpatico
fanno anche aumentare la secrezione della midollare.
PARATIROIDI
Segni di ipoparatiroidismo: rchitismo,
deformazioni ossee, mano « da
ostetrica »
Il calcio gioca un ruolo fondamentale in molteplici funzioni fisiologiche,
molte delle quali sono già state viste. Per esempio: attivazione della
contrazione dei muscoli scheletrico, cardiaco e liscio, coagulazione,
potenziali d’azione, stabilizzazione delle membrane, mineralizzazione
delle ossa. Per alcune funzioni, è necessaria solo la sua presenza (effetto
catalitico), mentre altre dipendono strettamente dalla sua
concentrazione.
Il calcio è trasportato nel plasma legato alle albumine: la forma legata è
in equilibrio con quella libera, che è la frazione attiva.
Le ossa rappresentano un deposito di calcio molto abbondante: esso è
continuamente rimosso, ad opera degli osteoclasti e precipitato nella
nuova matrice formata dagli osteoblasti. L’equilibrio fra rimozione e
precipitazione è regolato dall’ormone paratiroideo (PTH) e dalla
calcitonina (prodotta delle cellule parafollicolari (C) della tiroide). Nel
liquido interstiziale delle ossa è sempre presente una miscela di calcio e
fosfati, e la precipitazione (o la rimozione) dipende dal prodotto
calcio*fosforo.
Il PTH aumenta la calciemia (concentrazione ematica di CA2+ libero), il
cui valore è mantenuto strettamente costante a 10 mg*dl-1. La
secrezione di PTH è regolata a feedback negativo direttamente dalla
calciemia.
Il PTH interviene a tutti i livelli in cui il calcio è trattato nell’organismo,
dall’assorbimento intestinale (in cooperazione con la vitamina D3) al
riassorbimento renale (favorisce anche l’escrezione dei fosfati) ed alle
ossa (vedi figura).
In carenza di calcio, dovuta anche all’insufficiente esposizione a raggi UV
che favoriscono la trasformazione della vitamina D1 in D2, si ha la
sindrome del rachitismo.
L’ipercalciemia rende le ossa più dure (meno elastiche) e favorisce le
fratture traumatiche, mentre l’ipocalciemia può produrre fratture
spontanee. Il metabolismo del calcio è fortemente influenzato dagli
estrogeni, la cui carenza è responsabile dell’osteoporosi nelle donne in
menopausa.
IL CONTROLLO DELLA GLICEMIA
(pancreas endocrino: insulina, glucagone e IGF)
Ogni volta che si assume un pasto, che sicuramente contiene carboidrati
in quantità variabili, la glicemia (concentrazione ematica del glucosio)
aumenta, per poi diminuire durante il digiuno. Non dimentichiamo che
gli animali (uomo compreso) in natura possono essere sottoposti a fasi
di digiuno anche molto prolungate. Questo rende l’animale e l’uomo
libero di esercitare altre funzioni, diverse dall’alimentazione e dalla
ricerca del cibo; nelle società avanzate il tempo dedicato dalla specie
umana ai bisogni alimentari si riduce a misura che ognuno svolge le sue
particolari mansioni.
È pertanto necessario un sistema omeostatico che impedisca eccessive
variazioni della glicemia e che garantisca l’accumulo di substrati dopo i
pasti, influenzando anche il deposito di grassi e la sintesi proteica. A
questo sistema contribuiscono numerosi ormoni ed anche il sistema
nervoso autonomo, ma i protagonisti principali sono l’insulina ed il
glucagone, ormoni polipeptidici prodotti dalle isole del Langerhans del
pancreas.
L’INSULINA
L’insulina è un ormone polipeptidico prodotto dalle cellule beta del
pancreas. La sua secrezione è regolata direttamente dalla glicemia, di
cui abbassa rapidamente i valori, mediante i seguenti meccanismi:
• Stimola il trasporto del glucosio (attiva GLUT4, la molecola
trasportatrice) all’interno delle cellule muscolari, dove viene
immediatamente fosforilato e può essere utilizzato direttamente
oppure immagazzinato sotto forma di glicogeno;
• Stimola l’assunzione di glucosio nel fegato che lo deposita come
glicogeno;
• Stimola la produzione di trigliceridi nelle cellule adipose, fornendo il
glicerolo e aumentando l’assunzione di acidi grassi (per questa
ragione gli zuccheri fanno ingrassare);
• Stimola in generale la sintesi proteica.
L’esercizio fisico aumenta la sensibilità dei muscoli agli effetti
dell’insulina.
IL GLUCAGONE
Il glucagone è una molecola polipeptidica prodotta delle cellule alfa del
pancreas: è un ormone iperglicemizzante, con effetti opposti a quelli
dell’insulina: stimola la glicogenolisi e la gluconeogenesi nel fegato;
stimola la lipolisi nelle cellule adipose. La sua secrezione è stimolata
dall’ipoglicemia, ma anche dagli aminoacidi (utilizzati per formare
glucidi).
Il sistema nervoso autonomo controlla la secrezione degli ormoni
pancreatici in maniera opposta: il vago aumenta la secrezione di insulina
e il simpatico la diminuisce; il contrario succede per il glucagone.
LA SOMATOSTATINA
Prodotta anche dall’ipotalamo (inibisce la secrezione di GH). Ha in
genere effetti inibitori
IL POLIPEPTIDE PANCREATICO
È prodotto anche nel SNC come neurotrasmettitore. Ha numerose
funzioni, prevalentemente inibitorie, in particolare sulle secrezioni
intestinali.
INTERAZIONI E COMPLEMENTARIETA’ D’AZIONE
DEGLI ORMONI PANCREATICI
L’insulina riduce la secrezione di somatostatina, mentre questa stimola
la secrezione degli altri ormoni. L’insulina è anabolizzante e il glucagone
è catabolizzante, pertanto i loro ruoli sono complementari per
ottimizzare l’accumulo o il consumo dei substrati energetici.
LE GONADI
Ormoni sessuali: estrogeni, progesterone,
testosterone, androsterone
Le funzioni delle gonadi sono regolate da ormoni ipofisari: follicolostimolante (FSH) nei maschi e luteinizzante (LH) nelle femmine. Attivi
durante la vita fetale, nella prima infanzia, fin verso la pubertà, tali
ormoni sono quiescenti, ma quando cominciano ad essere secreti danno
inizio alla pubertà, con sviluppo dei caratteri secondari caratteristici e
avvio della gametogenesi (spermatozoi nei maschi e oociti nelle
femmine).
Gli estrogeni esercitano la propria attività sullo sviluppo delle vie genitali
(utero, tube e vagina) e dei caratteri sessuali secondari femminili.
Stimolano la proliferazione della mucosa endometriale e vaginale;
stimolano anche la ghiandola mammaria, con sviluppo dei dotti
galattofori.; sono responsabili dell’estro (calore) negli animali e e
sostengono la libido nella donna.