Biocatalizzatori e loro
applicazioni nelle
bio- trasformazioni.
1
.
biotrasformazione
reazione accelerata da catalizzatori biologici
= i biocatalizzatori
a)
b)
Enzimi isolati
Cellule intere .
2
Che cosa sono gli Enzimi ?
Le proteine
STRUTTURE
FUNZIONI
MONOMERI
Figura 3.11
Funzioni delle proteine
MONOMERI
20 tipi diversi di amminoacidi
Essenziali
Non essenziali
Amminoacidi essenziali
Metionina
Valina
(Istidina)
Treonina
Fenilalanina
Leucina
Granoturco
e altri cereali
Isoleucina
Triptofano
Lisina
Fagioli e altri legumi
• Ogni amminoacido contiene:
– un gruppo amminico;
– un gruppo carbossilico;
– un gruppo R, la regione variabile che determina
le proprietà specifiche di ciascuno dei 20 diversi
amminoacidi.
H
O
H
N
C
H
C
OH
R
Figura 3.12A
Gruppo
amminico
Gruppo (acido)
carbossilico
• Ogni amminoacido ha proprietà specifiche
basate sulla propria struttura:
H
H
H
O
N
C
H
CH2
CH
CH3
O
N
C
H
C
OH
H
Idrofobico
O
N
C
C
OH
H
CH2
CH2
OH
C
CH3
Leucina (Leu)
Figura 3.12B
H
C
OH
H
OH
Serina (Ser)
O
Acido aspartico
(Asp)
Idrofilico
STRUTTURE
STRUTTURA PRIMARIA
Condensazione legami covalenti
detti legami peptidici.
Gruppo
carbossilico
H
H
H
O
N
C
Legame
peptidico
Gruppo
amminico
C
H
+
OH
H
O
N
C
Reazione
di condensazione
H
C
H
N
OH
R
R
Amminoacido
Amminoacido
H
H2O
H
O
C
C
R
H
N
C
H
R
Dipeptide
Figura 3.13
O
C
OH
Leu Met
Pro
Gly Glu
Struttura primaria
Gly
Thr
Cys
Ser Lys
Asn Val
Val
Ile
Lys
Val
Ala
Pro
Leu Asp Ala Val Arg Gly Ser
Amminoacidi
Ala
Val
His
Phe
Val
Arg
STRUTTURA SECONDARIA
configurazione specifica determina la sua funzione
Legame
idrogeno
C
C
C
C
C
H
O
C
O
H
O
C
N
H
O
H
O
C
N
C
N
C
R
H
O
H
C C
N
H
C C
N
O
H
H
C
H
H
N C
C N
H
O
C
C
C
H
C
O
C
C C
N
O
H
C
C
O
H
N
C
C
N
C
O
C N
C
O
C
alfa elica
Beta foglietto ripiegato
Foglietto ripiegato
H
C
N
H
Alfa elica
N
O
H
C
N
H
C
O
C N
O
H
C
O
C N
O
R
C
H
C
C
H
C
C
N
C
O
C
C
N
C N
O
H
N
N
Struttura secondaria
H
H
N
O
N
C
O
C
O
H
H
H
N
N
O
C
C N
O
C
struttura terziaria
Polipeptide
(singola unità
di transtiretina)
di una proteina è l’aspetto generale e tridimensionale di un
polipeptide.
è dovuta ai legami a idrogeno e ionici che si formano tra
alcuni dei gruppi R polari e alle interazioni tra gruppi R
idrofobici del polipeptide e l’acqua.
struttura quaternaria
Catena polipeptidica
Transtiretina,
con quattro subunità
polipeptidiche
identiche
Collagene
due o più catene polipeptidiche
configurazione specifica determina la sua funzione
Scanalatura
Scanalatura
19
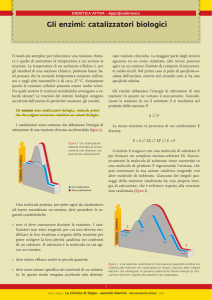
ENZIMI
Energia assorbita
Quantità
di energia
assorbita
Reagenti
Energia potenziale
delle molecole
Energia potenziale
delle molecole
Prodotti
Reagenti
Quantità
di energia
liberata
Energia liberata
Prodotti
energia di attivazione (EA).
Enzima
Barriera EA
Reagenti
Contenitore 1
Prodotti
Contenitore 2
Esempio di reazione catalizzata da un enzima:
http://www.youtube.com/watch?v=zFWsSjA4R58
1 Enzima disponibile
con il sito attivo
vuoto
Sito attivo
Glucosio
Substrato
(saccarosio)
Il substrato
2 si lega all’enzima
che subisce
un adattamento indotto
Enzima
(saccarasi)
Fruttosio
H2O
4 I prodotti
vengono liberati
3 Il substrato
si scinde
nei prodotti
Gli Enzimi spesso sono inattivi senza la presenza di altre particelle dette
Coenzimi (NAD + , FAD, ATP, CoASH ) ,
Cofattori ioni metallici
Gruppi prostetici leg cov.
25
26
27
28
INIBITORI
http://www.youtube.com/watch?v=PILzvT3spCQ
Sito attivo
Substrato
Enzima
Legame normale del substrato
Inibitore
competitivo
Inibitore
non competitivo
Inibitore enzimatico
– Gli inibitori competitivi occupano il sito attivo di un substrato.
– Gli inibitori non competitivi cambiano la funzione dell’enzima
modificando la sua forma.
• Dimensioni e PM E< S
• Siti catalitici o Siti attivi apolari
• > Parte di AA non in contatto con S, ma
x orientamento enzima – substrato
32
dimensioni della molecola enzimatica
( E ) sono normalmente superiori a quelle
della molecola del substrato ( S ).
L' Enzima ha in media un peso molecolare
di alcune migliaia di Dalton, mentre quello
del Substrato è dell' ordine di alcune
centinaia .
33
Tale rapporto dimensionale lascia intuire
che solo alcune regioni dell' enzima sono
direttamente interessate all' attività cataliti-
ca: queste regioni , dette Siti catalitici o
Siti attivi, sono quasi sempre una sorta
di tasca della superficie della proteina enzimatica.
34
I residui amminoacidici presenti, sporgenti
all' interno del sito attivo, sono prevalente-
memente apolari; in questo modo si creano le premesse per l' espulsione della mag-
gior parte delle molecole d' acqua dalla
cavità, in modo da consentire una maggior
concentrazione del substrato nel sito attivo.
35
In conclusione la maggior parte degli
amminoacidi degli enzimi non entrano in
contatto con il substrato; essi tuttavia
hanno un ruolo importantissimo: costituiscono l' impalcatura adatta per favorire il
reciproco orientamento enzima – substrato,
tanto necessario per garantire una buona
catalisi.
36
.
Il riconoscimento substrato - sito attivo
è altamente specifico.
37
E + S
ES
E + P
Il modello interpretativo più semplice dell' interazione fra Enzima e
Substrato inizia con il legame tra lo stesso Enzima ed il
substrato formando un complesso intermedio, che poi si
trasformerà nel Prodotto lasciando l' Enzima libero, pronto per un
nuovo atto catalitico :
38
Modello di Fischer detto a
chiave - serratura.
39
Per quanto riguarda il meccanismo, secondo
cui puo' realizzarsi l' inserimento del substrato
nel sito è stato formulato il Modello di Fischer
detto a chiave - serratura.
L' Enzima ha una configurazione rigida già
perfettamente complementare a quella del
substrato;
il riconoscimento vicendevole è
quindi altamente specifico.
40
Velocità di reazione
dipende
Concentrazione del Substrato
Concentrazione dell' Enzima
pH dell'ambiente di reazione
T dell'ambiente di reazione
Legge di Michaelis-Menten
-1
Medico-biochimico tedesco
Maud Menten (1879-1960)
Velocità di reazione (s )
Leonor Michaelis (1875-1949)
0.4
Medico canadese
Vmax
0.3
0.2
1/2Vmax
0.1
0.0
0
Km
1000
2000
3000
4000
Concentrazione del substrato (M)
• velocità iniziale v0 = pendenza della tangente alla
curva di avanzamento della reazione al tempo zero t0
• al tempo t1 il prodotto si accumula con velocità sempre
minori perché il substrato si consuma
La velocità delle reazioni enzimatiche
è influenzata da molti fattori.
Infatti l' azione catalitica di una proteina
enzimatica consiste nel selezionare, tra i
diversi percorsi possibili, quello che ri-
chiede minore energia di attivazione.
46
In tal modo si ha un maggior numero di
molecole trasformate nell' unità di tempo
e cio' si traduce in un aumento della
velocità di reazione . Tale velocità dipende
anche da numerosi parametri chimico- fisici,
come :
Concentrazione del Substrato e del-
l' Enzima, pH dell'ambiente di reazione.
47
Cinetica
enzimatica
LEGGE DI MICHAELIS-MENTEN
Enzima
proteina in grado di catalizzare una reazione
chimica
1 interazione tra substrato (molecole che partecipano alla
reazione) e sito attivo (parte di enzima in cui avvengono le
reazioni)
2 formazione del complesso enzima-substrato
3 formazione del prodotto, allontanato dall’enzima che
resta libero di iniziare una nuova reazione
Importanza della cinetica enzimatica
Informazioni indirette su:
• meccanismo di reazione
• specificità enzimatica
• parametri che caratterizzano proprietà fisiche degli enzimi
Legge di Michaelis-Menten
• descrive la dipendenza iperbolica velocità enzimatica vs..
• introduce un parametro cinetico
importante per:
concentrazione del substrato
Km, costante di Michaelis-Menten
– caratterizzare l’interazione enzima-substrato
– valutare la specificità enzimatica
– modificare la velocità di un’intera via metabolica
Legge di Michaelis-Menten
-1
Medico-biochimico tedesco
Maud Menten (1879-1960)
Velocità di reazione (s )
Leonor Michaelis (1875-1949)
0.4
Medico canadese
Vmax
0.3
0.2
1/2Vmax
0.1
0.0
0
Km
1000
2000
3000
4000
Concentrazione del substrato (M)
• velocità iniziale v0 = pendenza della tangente alla
curva di avanzamento della reazione al tempo zero t0
• al tempo t1 il prodotto si accumula con velocità sempre
minori perché il substrato si consuma
Legge di Michaelis-Menten
1° : enzima, substrato e complesso in equilibrio
Le reazioni enzimatiche procedono in due stadi
E+S
KS
[ E ] [S ]
[ ES ]
KS
ES
kcat
E+P
v kcat ES
costante di dissociazione del complesso ES
poiché [E]<<[S], v è proporzionale a [E]T = [E]+[ES] :
k cat E T [ S ]
E T [ S ]
ES
v
K S [S ]
K S [S ]
Legge di Michaelis-Menten
2° : ipotesi dello stato stazionario
• se k-1 >> k2
– l’equilibrio è raggiunto prima della
formazione del prodotto
• se k2 k-1
– [E]T < [S]
– [ES] raggiunge subito uno stato
stazionario d [ ES ]
dt
0
d [ ES ]
k1 E S k 2 ES k 1 ES 0
dt
k 2 [ E ]T S
v
K m S
Km
k 1 k 2
k
KS 2
k1
k1
Km : costante di Michaelis-Menten
Legge di Michaelis-Menten
2° : ipotesi dello stato stazionario
Per qualunque reazione enzimatica [E]T , k2, Km sono costanti
k2 E T
v
• se [S]<<Km :
Km
• se [S]>>Km :
v k2 E T
S koss S reazione circa del 1° ordine
reazione di ordine zero rispetto ad S
poiché [E]T e k2 sono costanti si definisce velocità massima di reazione
Vmax k2 E T
• se [S] = Km :
–
1
v Vmax
2
enzima semisaturo
Vmax S
v
K m S
se [E] è espressa in moli di siti attivi/litro, k2 (espresso in t-1) rappresenta il n° di turnover
dell’enzima, ovvero il n° molecole di S trasformate in P nel tempo quando l’enzima opera al
massimo dell’efficienza
Legge di Michaelis-Menten
3° : formazione di un intermedio ES’ con
legame covalente
• Reazioni enzimatiche a più substrati
E+S
KS
– per lo stato stazionario:
essendo
ES
k2
X
ES’
k3
E+P
d [ ES ' ]
k 2 ES k3 ES ' 0
dt
E T E ES ES '
risolvendo rispetto as ES, si ottiene
E T ES K S 1 k2
k3
S
kcat
k2 k3 / k2 k3
v E T S
K S k3 / k2 k3 S
Km
Classificazioni degli Enzimi
56
Vantaggi e svantaggi delle biotrasformazioni
- Elevata selettività ( chemo- , regio- , stereoselettività ) ;
- Condizioni blande ed ecologicamente compatibili ;
- Possibilità di classificare come naturali i prodotti di biotrasformazioni di substrati naturali . 57
Gli svantaggi spesso evocati come principali limiti all' impiego di biotrasformazioni sono:
- Bassa stabilità di molti biocatalizzatori nelle
condizioni di operazione;
- Basse rese;
- Basso numero di biocatalizzatori disponibili
commercialmente.
58
La selettività, la stabilità e l' attività di
molti biocatalizzatori nelle condizioni
di reazione desiderate possono essere
migliorate attraverso diverse tecniche :
- selezione di nuovi enzimi con tecniche
di screening innovative ;
59
- immobilizzazione ;
- ricerca delle migliori condizioni di
reazione ( ingegneria di reazione );
. Applicazioni
La produzione di molecole come singoli
enantiomeri è di importanza sempre
crescente non solo nel settore farmaceutico,
ma anche in quelli della chimica
agroalimentare.
60
61
- E' quindi necessario avere a disposizione
metodi stereoselettivi semplici che permettano
l' ottenimento di molecole enantiopure anche
in quantità limitate.
- Gli Enzimi sono catalizzatori chirali prodotti
in forma stereochimicamente pura e, come
62
tali, sono in grado di catalizzare la trasfor-
mazione di un singolo enantiomero di una
miscela racemica, oppure di indurre asimmetria
in reazioni che generano un centro stereogenico, come si puo' notare nell' immagine suc-
cessiva :
63
64
- Ingegneria di reazione
Una volta ottenuto il biocatalizzatore adatto
alla trasformazione richiesta, è necessario
ricercare le condizioni di reazioni ideali per
ottenere la massima attività del biocatalizzatore e, nel contempo, favorire la Termodina-
mica della reazione nel senso desiderato.
65
. L' equilibrio della reazione biocatalizzata
puo' essere spostato verso il prodotto desi-
derato, giocando su diversi parametri come:
. La concentrazione di prodotti/ substrati, pH,
temperatura, forza ionica, solubilità dei prodotti/ substrati.
66
Un esempio riguarda l' impiego di Enzimi
( soprattutto Idrolasi ) in condizioni di
bassa concentrazione e/o attività d' acqua;
questa situazione è facilmente ottenibile utilizzando il biocatalizzatore in solventi organici quasi anidridi.
Come si vede dalla figura successiva le
67
idrolasi catalizzano la rottura di vari legami
attraverso l' intervento di acqua mediante
una reazione di Equilibrio.
Tuttavia il catalizzatore puo' promuovere anche la reazione opposta, ovvero la
Condensazione con eliminazione d' acqua.
68
In condizioni in cui prevale un eccesso del
mezzo acquoso l' equilibrio è spostato
69
verso l' Idrolisi per azione di massa.
In condizioni di bassa attività di acqua, prevale
la Condensazione ( ad esempio la sintesi
di Esteri, ammidi , ecc. ) . Per queste ragioni, sono state cercate Idrolasi stabili e
attive in solventi organici.
Un altro interessante esempio per favorire
70
termodinamicamente l' equilibrio chimico
verso il prodotto desiderato consiste nel
far precipitare il medesimo prodotto mediante un composto coprecipitante, sottraen-
dolo all' equilibrio stesso e spostando la
reazione verso destra.
71
La selettivita' e la resa della reazione
possono essere limitate quando vengono utilizzate cellule intere come biocatalizzatori, che
aumentano la presenza di numerosi Enzimi,
catalizzando ulteriormente la trasformazione
del prodotto desiderato.
Questi inconvenienti possono essere risolti
utilizzando sul catalizzatore tecniche di Ingegneria genetica .
72