IPERURICEMIE
• gruppo di malattie metaboliche relativamente comuni
• causate dalla aumentata produzione o ridotta escrezione del
prodotto terminale del metabolismo delle purine
PURINE
• Le purine sono basi (adenina e guanina) che sono legate a
zuccheri (ribosio e deossiribosio) e gruppi fosfato, per
svolgere importanti funzioni legate alla replicazione del
materiale genetico, trascrizione genica, sintesi proteica e
metabolismo cellulare:
creano acidi nucleici incorporati in DNA ed RNA
partecipano al metabolismo energetico (ATP)
partecipano al signaling intracellulare (GMP)
partecipano alla comunicazione tra cellule (adenosina)
ACIDO URICO
• L’acido urico è il prodotto catabolico finale del metabolismo delle purine
• è un acido debole che si ritrova in forma ionizzata (urato monosodico)
• se i liquidi corporei che contengono acido urico divengono soprasaturi,
l’acido urico può precipitare formando cristalli
• la saturazione dipende dalla temperatura, dal pH, dalla concentrazione
di sodio e da altre caratteristiche dei liquidi biologici:
il plasma si satura a concentrazioni >7 mgdl (0.41 mmol/L) a
pH7.4, 37°C e normale concentrazione di sodio
i tessuti avascolari (cartilagini) o poco vascolarizzati (tendini e
legamenti) o più distali (padiglione auricolare) sono più freddi e si
saturano a concentrazioni inferiori: >4 mg/dl a 30°C
nelle urine la solubilità è molto più alta: urea, proteine e
mucopolisaccaridi aumentano la solubilità, l’acidità la diminuisce.
- a pH 5.0 le urine si saturano a concentrazioni 6-15 mg/dl
- a pH 7.0 le urine si saturano a concentrazioni 158-200 mgdl
METABOLISMO DELL’ACIDO URICO
Le purine sono
sintetizzate in
tutti i tessuti
Le purine sono
anche
introdotte con la
dieta
Le basi possono
essere riciclate
grazie all’enzima
fosforibosiltransferasi
Solo i tessuti con
xantina-ossidasi
(fegato, intestino)
possono produrre
acido urico
70% dell’acido urico è escreto dal rene,
il resto prevalentemente dall’intestino
BIOSINTESI
De novo purine biosynthesis, the formation of a purine
ring from nonring structures, is an 11-step process that
results in formation of inosine monophosphate (IMP).
• The first step combines phosphoribosyl-pyrophosphate
(PRPP) and glutamine and is catalyzed by amidophosphoribosyltransferase (amidoPRT). The rates of
purine biosynthesis and urate production are determined,
for the most part, by this enzyme. AmidoPRT is regulated
by the substrate PRPP, which drives the reaction forward,
and by the end products of biosynthesis (IMP and other
ribonucleotides), which provide feedback inhibition.
• A secondary regulatory pathway is the salvage of
purine bases by hypoxanthine-phosphoribosyl
transferase (HPRT). HPRT catalyzes the combination of
the purine bases hypoxanthine and guanine with PRPP to
form the respective ribonucleotides IMP and guanosine
monophosphate (GMP). Increased salvage activity thus
retards de novo synthesis by reducing PRPP levels and
increasing concentrations of inhibitory ribonucleotides.
(1) Phosphoribosylpyrophosphate (PRPP) synthetase, (2) amidophosphoribosyltransferase (amidoPRT), (3) adenylo
succinate lyase, (4) adenylate (AMP) deaminase, (5) 5'-nucleotidase, (6) adenosine deaminase, (7) purine nucleoside
phosphorylase, (8) hypoxanthine phosphoribosyltransferase (HPRT), (9) adenine phosphoribosyl transferase (APRT),
and (10) xanthine oxidase. PRA, phosphoribosylamine; SAICAR, succinylaminoimidazole carboxamide ribotide; AICAR,
aminoimidazole carboxamide ribotide; GMP, guanylate; IMP, inosinate.
ESCREZIONE RENALE
CONCENTRAZIONE DI ACIDO URICO
• La concentrazione di acido urico varia con sesso ed età: da 3-4 mg/dl
nell’infanzia, si eleva nei maschi durante la pubertà (6.8 mg/dl) e più
tardivamente nelle femmine prima della menopausa (6.0 mg/dl). Dopo la
menopausa scompare il dimorfismo sessuale.
• età, altezza, peso corporeo, pressione sanguigna, funzione renale e
intake alcoolico si associano positivamente alle concentrazioni di acido
urico
• IPERURICEMIA si ha quando la concentrazione di acido urico eccede
7.0 mg/dl. Questa definizione si basa su diversi criteri:
fisico-chimico: il limite di saturazione nel plasma è 6.8 mgdl
epidemiologico: il cut-off per il 95% dei valori nella popolazione
generale (media+2SD) è 7 mg/dl
rischio di malattia: la probabilità di sviluppare complicanze (artrite
gottosa e nefrolitiasi) è proporzionale ai valori di acido urico a partire
da 7.0 mg/dl
IPERURICEMIA: CLASSIFICAZIONE EZIOLOGICA
IPERURICEMIA: CLASSIFICAZIONE
FISIOPATOLOGICA
AUMENTATA PRODUZIONE
• DIETA: contiene una significativa quantità di purine (fegato, timo,
pancreas, rene, aciughe) che compaiono in larga parte nelle urine come
acido urico.
• AUMENTATA BIOSINTESI DI PURINE: porta ad aumento di
produzione ed escrezione di acido urico
aumentata attività di amidoPRT, l’enzima chiave che inizia la
sintesi di purine
ridotta attività di HPRT, l’enzima chiave per il salvataggio delle
purine
• AUMENTATA DEGRADAZIONE DI NUCLEOTIDI:
rapido turnover proliferazione e morte cellulare, crisi blastiche
leucemiche, terapie citotossiche, emolisi
eccessiva degradazione di ATP muscolare in esercizio strenuo,
stato epilettico, glicogenosi II, V, VII, in infarto miocardio, fumo e
scompenso respiratorio acuto
RIDOTTA ESCREZIONE
• l’efficienza di escrezione renale è ridotta (-40%) nel 90% degli individui
con la gotta.
• acidosi (ketoacidosi,digiuno, intossicazione da etanolo, salicilati e
acidosi lattica) produce acidi organici che competono con l’acido urico per
la secrezione tubulare
• aumentato riassorbimento tubulare (diabete insipido, diuretici)
MECCANISMI COMBINATI
• deficit di glucosio 6 fosfatasi causa eccessiva degradazione di ATP in
caso di digiuno e ipoglicemia. La deplezione di nucleosidi causa upregulation di amidoPRT. L’acidosi di questi soggetti a sua volta causa
ridotta secrezione tubulare
• intolleranza ereditaria al fruttosio causata da deficit di fruttosio 1P
aldolasi: si accumula FRU 1P, con deplezione di ATP, e quindi accelerato
catabolismo e sintesi di purine. Si determina acidosi che contribuisce a
ritenzione di urati. Un terzo degli eterozigoti (1-1.5% della popolazione)
sviluppa gotta.
• alcolici: aumentato consumo epatico di ATP, acidosi lattica. La birra ha
un alto contenuto di purine.
IPERURICEMIA: COSA FARE
non è necessariamente da trattare
bisogna 1) individuare la causa, 2) stabilire le potenziali
conseguenze e 3) decidere su questa base
aumentata produzione o ridotta escrezione?
dosare l’escrezione di acido urico
dopo dieta priva di purine deve essere <600 mg/die nell’uomo
a dieta libera deve essere <800 mg/die
* in insufficienza renale i dati possono essere falsati verso il basso. Se
sono assunti uricosurici, glucocorticoidi, acido ascorbico e >2g salicilati i
valori possono essere falsati
LE CONSEGUENZE DELL’IPERURICEMIA
(prevalenza 2-13%)
• ARTRITE GOTTOSA: prevalenza 1-2% negli adulti. Nel maschio è la forma più
frequente di artropatia infiammatoria La probabilità di svilupparla dipende dai livelli e
dalla durata dell’iperuricemia.
• NEFROLITIASI: i calcoli di acido urico non sono esclusivi della gotta. La probabilità
di svilupparli dipende dalle concentrazioni nel siero e nelle urine: 50% di coloro che
hanno una escrezione >1100 mg/die
• NEFROPATIA DA URATI: è una manifestazione tardiva e oggi rara di gotta severa.
Reazione infiammatoria ai cristalli di urati nell’interstizio midollare e nelle piramidi.
Questa lesione può non dare conseguenze o causare proteinuria, ipertensione
insufficienza renale.
• NEFROPATIA DA ACIDO URICO: causa reversibile di insufficienza renale acuta
causata da precipitazione di cristalli nei tubuli e nei dotti collettori che causano
ostruzione.
aumentata produzione ed escrezione di acido urico in crisi blastiche, terapia
citolitica, neoplasie, crisi epilettiche, esercizio strenuo. Precipitata da acidosi e
disidratazione
potenzialmente mortale ma trattabile se diagnosticata, sulla base delle
concentrazioni urinarie: la concentrazione di acido urico > creatinina
ARTRITE GOTTOSA
• prevalenza 1-2 %. La probabilità di svilupparla dipende dai livelli e dalla
durata dell’iperuricemia. i tessuti avascolari (cartilagini) o poco vascolarizzati
(tendini e legamenti) o più distali (padiglione auricolare) sono più freddi e si
saturano a concentrazioni inferiori rispetto al plasma: >4 mg/dl a 30°C
• cristalli di urato monosodico si depositano a forma di ago in cartilagini,
tendini e legamenti, padiglione auricolare e articolazioni periferiche. Nella
malattia cronica grave i cristalli si possono depositare anche nelle
articolazioni centrali.
• si possono creare aggregati di cristalli, tofi gottosi, che possono essere
documentati radiologicamente (lesioni a stampo dell’articolazione) e poi
essere palpati come noduli sottocutanei
ARTRITE GOTTOSA: sintomi e segni
• presentazione acuta, improvvisa: microtraumi, alimenti ricchi di purine,
alcolici, stress chirurgico, medico e psichico
• dolore mono o poliarticolare, acuto spesso ad insorgenza notturna,
ingravescente ed insopportabile
• segni di infiammazione acuta
• manifestazioni più frequenti:
• sedi più colpite: articolazione metatarso falangea dell’alluce, arco
plantare, caviglia, ginocchio, polso gomito
• accompagnamento: febbre con brivido, tachicardia, leucocitosi
• evoluzione: attacchi monoarticolari della durata di qualche giorno,
possono diventare pauciarticolari, sequenziali per settimane. Inizialmente la
funzione articolare torna normale, ma con attacchi ripetuti si verificano
lesioni permanenti
ARTRITE GOTTOSA
• artrite cronica gottosa consegue a ripetuti attacchi acuti in assenza di
adeguata profilassi. Raramente può costituire la presentazione della
malattia
• la ciclosporina causa gotta a livello delle grandi articolazioni centrali (anca,
sacroiliache)
ARTRITE GOTTOSA: diagnosi
• sospettata su base clinica: gli attacchi acuti sono tipici
• uricemia elevata <7 mg/dl: rafforza la diagnosi ma è aspecifica e poco
sensibile (assente nel 30% in corso di attacco acuto)
• agoaspirato di liquido sinoviale o di depositi tofacei con dimostrazione
della presenza dei caratteristici cristalli: patognomonico, conferma la
diagnosi
• risposta rapida alla colchicina: test poco specifico
• immagine Rx di tofi: poco sensibile (>5mm) e poco specifica
Algorithm for the diagnosis of
musculoskeletal complaints. An
approach to formulating a
differential diagnosis (shown in
italics). (ESR, erythrocyte
sedimentation rate; CRP, C-reactive
protein; DIP, distal interphalangeal;
CMC, carpometacarpal; PIP,
proximal interphalangeal; MCP,
metacarpophalangeal; MTP,
metatarsophalangeal; PMR,
polymyalgia rheumatica; SLE,
systemic lupus erythematosus; JA,
juvenile arthritis.)
Algorithmic approach to the
use and interpretation of
synovial fluid aspiration and
analysis
TRATTAMENTO
• IPERURICEMIA ASINTOMATICA: prevalenza 5% nella popolazione
generale e nel 25% di quella ospedalizzata, non presenta rischio clinico
significativo. Fa parte della sindrome polimetabolica insieme a obesità,
ipertensione, dislipidemia e insulino resistenza, ma non è causa di malattia
cardiovascolare.
si tende a non trattarla di routine come misura preventiva se non in
condizioni particolari, ad es. in corso di terapia citolitica, per la prevenzione
della nefropatia acuta da acido urico
le cause vanno però valutate e trattate. La sindrome polimetabolica
associata va ugualmente individuata e trattata
TRATTAMENTO
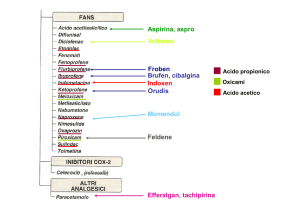
• ATTACCO ACUTO DI GOTTA:
Obiettivi terapeutici:
interrompere l’attacco acuto con COLCHICINA oppure FANS ad
alte dosi:
Colchicina: 1 mg inizialmente, poi 0.5 mg ogni 2-3h fino ad un massimo
di 6mg fino alla risoluzione del dolore o a comparsa di sintomi
gastrointestinali (vomito e diarrea). Non superare 7 mg nelle 48ore.
Si ottiene un effetto completo in 36-48 ore
Oppure:
FANS: diclofenac, ketoprofene, indometacina, naprosene, piroxicam,
sulindac (non usare aspirina): ai pasti per 4-5 giorni
Sono ugualmente efficaci ma più lentamente
+
Misure di supporto: riposo, idratazione
Obiettivi terapeutici:
CONTROLLO A LUNGO TERMINE terapia ipouricemizzate con
ALLOPURINOLO (inibitore della xantino ossidasi) oppure PROBENECID E
SULFINPIRAZONE (uricosurici). Si dovrebbe portare la concentrazione di
acido urico entro 5 mg/dl per prevenire attacchi ricorrenti ed eliminare i
depositi tofacei.
Misure generali: calo pnderale, dieta povera di purine, ingestione di liquidi,
limitazione di alcolici, eliminazione di diuretici
Allopurinolo: prima scelta, iniziare da 100 mgdie, in media 300 mg/die
una volta al giorno, dosi maggiori vanno frazionate. Farmaco a lunga emivita,
efficace in pochi giorni nel ridurre produzione ed escrezione di acido urico.
Efficace a dosaggio ridotto in insufficienza renale. Se si verifica un attacco
acuto, non sospendere, ma trattare con colchicina o FANS.
Oppure:
Uricosurici: non indicati in caso di insuficienza renale o nefrolitiasi.
Probenecid: indicato in pazienti con ridotta escrezione di urati , ipertesi con
diuretici tiazidici. Iniziare da 200mg*2 fino a 2g/die. Ingerire abbondanti liquidi
TRATTAMENTO
• NEFROLITIASI: TERAPIA ANTIIPERURICEMICA per chi ha artrite
gottosa + calcoli di calcio o acido urico.
ingestione di fluidi per mantenere il volume di urine >2L die
alcalinizzazione delle urine con bicarbonato di sodio o acetazolamide
allopurinolo: in media 300 mg/die una volta al giorno. Farmaco a lunga
emivita, efficace in pochi giorni nel ridurre produzione ed escrezione di acido
urico. Efficace a dosaggio ridotto in insufficienza renale.
TRATTAMENTO
• NEFROPATIA DA ACIDO URICO: potenzialmente mortale, ma trattabile e
prevenibile.
idratazione EV vigorosa + diuresi con FUROSEMIDE
alcalinizzazione delle urine con bicarbonato di sodio o acetazolamide
250-500 mg ogni 6-8 ore
monitorare pH urine >7.0 e sovraccarico di liquidi
allopurinolo: dose singola 8 mg/kg seguita da dosi giornaliere di 100-200
mg
EMODIALISI
EULAR, European League Against Rheumatism
QUANDO L’ALLOPURINOLO E’ CONTROINDICATO
Uricosurici: in aggiunta al Probenecid che in Italia è approvato solo per la
prevenzione della nefrotossicità da somministrazione del farmaco antivirale
cidofovir, si è resa disponibile la forma ricombinante della urato ossidasi,
Rasburicase, disponibile endovena, indicata per la prevenzione
dell'iperuricemia indotta da farmaci cititossici.
Farmaci usati per altre indicazioni (losartan, atorvastatina e fenofibrato) sono
uricosurici per cui possono aiutare efficacemente e sono da preferire in caso di
ipertensione o dislipidemia.
Densensitivizzazione ad Allopurinolo: sembra controversa e indicata solo per
chi ha manifestazioni cutanee lievi.
Recentemente sperimentato il Febuxostat, inibitore della Xantina Ossidasi che
potrebbe essere la reale alternativa all‘Allopurinolo: Molte valutazioni positive,
anche se in 500 pazienti trattati si sono verificati 4 decessi, apparentemente
non collegabili al farmaco.
Recentemente sperimentata una forma PEGilata di uricasi