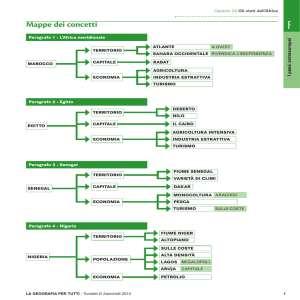
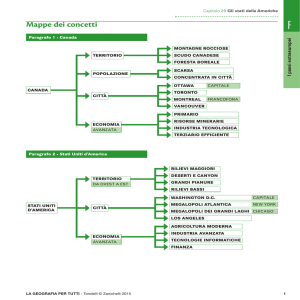
1. ------IND- 2016 0057 DK- IT- ------ 20160215 --- --- PROJET
Quadro sintetico (sommario)
Capo
Allegato 1
Elenco delle sostanze biologiche soggette a controllo.
Testo integrale
Decreto sul controllo di determinate sostanze che possono essere utilizzate in
relazione ad attacchi biologici rivolti agli animali
1)
In conformità dell'articolo 1, articolo 4, paragrafo 2, e articolo 7, paragrafo 2, della legge sulla protezione degli agenti
patogeni animali, cfr. decreto legge n. 475 del 15 maggio 2014, e per delega a norma dell'articolo 7, paragrafo 5 del decreto n.
511 del 23 aprile 2015 sulle funzioni e competenze dell'amministrazione veterinaria e alimentare danese si stabilisce
successivamente a negoziazione con il ministero delle Salute e degli anziani:
Capo
Campo di applicazione
Articolo 1. Il presente decreto contiene disposizioni sul controllo di determinate sostanze che possono essere utilizzate in
relazione ad attacchi biologici rivolti agli animali.
Paragrafo 2. Il presente decreto è valido per le sostanze biologiche elencate nell'allegato 1.
Autorizzazione
Articolo 2. I poteri ai sensi degli articoli 2, 3 e 5 , paragrafi 1, 4 e 5, della legge sul controllo di agenti patogeni animali
conferiti al ministro dell'Ambiente e dell'alimentazione, sono esercitati dal "Centre for Biosecurity and Biopreparedness" danese.
Definizioni
Articolo 3. Nel presente decreto si utilizzano le seguenti definizioni:
1) Agenti patogeni animali: taluni virus, batteri, micoplasmi nonché taluni elementi genetici e organismi modificati
geneticamente che possono essere utilizzati in relazione ad attacchi biologici rivolti agli animali.
2) Dotazione: essere in possesso o detenere una delle sostanze biologiche di cui all'allegato 1.
3) Unità d’immagazzinamento: unità univoca per la conservazione di talune sostanze biologiche, p.es. una provetta chiusa
con cultura batterica.
4) Obiettivo professionale: obiettivo di ricerca, diagnostico o commerciale che coinvolga o imprese pubbliche o private, p.es.
dipartimenti universitari, laboratori, imprese biotecnologiche o aziende farmaceutiche.
5) Piano di controllo: piano di provvedimenti o azioni da intraprendere per prevenire, rilevare e reagire al furto o abuso di
sostanze biologiche, cfr. allegato 1.
6) Valutazione della vulnerabilità: identificazione di minacce e carenze in materia di sicurezza connesse alla detenzione,
produzione, utilizzo, conservazione, acquisto, vendita, trasporto, trasferimento e smaltimento di sostanze biologiche, cfr.
allegato 1.
7) Entità: persona giuridica, compresi laboratori, istituzioni, imprese di produzione o suoi reparti, responsabili per le
sostanze biologiche.
Permesso di detenzione, fabbricazione, utilizzo e conservazione di sostanze biologiche che possono essere utilizzate in relazione
ad attacchi biologici rivolti agli animali
Articolo 4. Detenzione, produzione, utilizzo e conservazione di sostanze biologiche di cui all'allegato 1 possono avvenire
soltanto dietro autorizzazione emessa dal "Centre for Biosecurity and Biopreparedness" danese.
Paragrafo 2. la richiesta di autorizzazione avviene inviando un modulo di richiesta al "Centre for Biosecurity and
Biopreparedness" danese. Il modulo di richiesta si ottiene rivolgendosi al "Centre for Biosecurity and Biopreparedness" danese o
tramite il sito web www.biosikring.dk.
Paragrafo 3. il modulo di richiesta deve essere firmato dalla persona responsabile della sicurezza, cfr. l'articolo 5, paragrafo
2. Il modulo di richiesta dovrà contenere le seguenti informazioni:
1) denominazione e indirizzo dell'entità,
2) reparto dell'entità dove deve essere presente la sostanza biologica,
3)
4)
5)
6)
nome e formazione della persona responsabile della sicurezza, cfr. l'articolo 5, paragrafo 2, e articolo 9,
scopo e livello desiderato dell'autorizzazione, cfr. l'articolo 5, paragrafo 1, e articolo 6,
informazioni sulle condizioni di conservazione, cfr. articolo 13, e
informazioni sulle condizioni di sicurezza, cfr. Articolo 15.
Paragrafo 4. Il "Centre for Biosecurity and Biopreparedness" danese deve deliberare al più tardi 4 settimane dopo la
ricezione del modulo di richiesta e delle necessarie informazioni.
Paragrafo 5. Il termine di cui al paragrafo 4 può essere prorogato una sola volta qualora, data la natura del caso, non sia
possibile procedere a delibera entro la scadenza del termine. IN caso di proroga del termine, il richiedente viene informato entro
la scadenza del termine della data della delibera. Nella notifica deve essere menzionata la ragione della proroga e il termine
fissato.
Paragrafo 6. Un superamento del termine fissato secondo il paragrafo 4 o del termine prorogato secondo il paragrafo 5 non
comporta che il richiedente consideri l'autorizzazione garantita.
Paragrafo 7. Quando il "Centre for Biosecurity and Biopreparedness" danese ha ricevuto un modulo di richiesta di
autorizzazione e tutti i documenti necessari, lo stesso invia un avviso di ricevimento al richiedente con informazioni relative a:
1) il termine prescritto per il procedimento, cfr paragrafi 2 e 3,
2) l’impossibilità del richiedente di avviare l'attività, prima di avere ricevuto l'autorizzazione relativa dal "Centre for
Biosecurity and Biopreparedness" danese, e
3) le possibilità di ricorso.
Articolo 5. Autorizzazioni per la detenzione, produzione, utilizzo e conservazione di sostanze biologiche di cui all'allegato 1
possono essere solo notificate a entità che hanno uno scopo professionale e legittimo nell'ottenere l'autorizzazione.
Paragrafo 2. Un'entità richiedente autorizzazione ai sensi dell'articolo 4, paragrafo 2, deve designare una persona fisica
(persona responsabile della sicurezza), approvata ai sensi dell'articolo 9, e che è responsabile della conformità delle disposizioni
del presente decreto.
Articolo 6. L'autorizzazione, cfr. articolo 4, paragrafo 1, può essere assegnata per una sostanza biologica singola o per un
gruppo di sostanze biologiche.
Paragrafo 2. L'autorizzazione può essere assegnata per un periodo stabilito in precedenza, o per tutto il periodo di tempo nel
quale l'attività giustificativa dell'autorizzazione, continua, cfr. articolo 8, paragrafi 2 e 3.
Paragrafo 3. L'autorizzazione può inoltre essere assegnata a indicazioni diagnostiche, che potrebbero coinvolgere le sostanze
biologiche di cui all'allegato 1. Al più tardi 14 giorni dopo il termine dell'indicazione tali sostanze biologiche devono essere
smaltite, a meno che non si ottenga l'autorizzazione dal "Centre for Biosecurity and Biopreparedness" danese relativamente alla
specifica sostanza biologica.
Articolo 7. In associazione alla concessione di un'autorizzazione, cfr. articolo 4, paragrafo 1, il "Centre for Biosecurity and
Biopreparedness può applicare condizioni specifiche relative alla conservazione, smaltimento, deposito, condizioni di sicurezza e
formazione del personale, oltre ai requisiti specificati nel decreto.
Articolo 8. Modifiche nelle attività dell'entità, rilevanti ai fini dell'autorizzazione concessa all’ente stesso, come da articolo 4,
paragrafo 1, devono essere notificate al "Centre for Biosecurity and Biopreparedness" danese.
Paragrafo 2. Il "Centre for Biosecurity and Biopreparedness" danese può revocare totalmente o parzialmente
un'autorizzazione, emessa ai sensi dell'articolo 4, paragrafo 1, se l'ente non rispetta le condizioni stabilite a norma dell'articolo
7, o se si constata che l'ente non rispetta più le condizioni per ottenere un'autorizzazione.
Paragrafo 3. Il "Centre for Biosecurity and Biopreparedness" danese può revocare totalmente o parzialmente o modificare
un'autorizzazione già emessa, se ciò si rende necessario per motivi di pubblica sicurezza.
Paragrafo 4. Il termine per lo smaltimento di sostanze biologiche di cui all'allegato 1 dopo la revoca dell'autorizzazione è
stabilito dal "Centre for Biosecurity and Biopreparedness" danese.
Responsabilità e formazione
Articolo 9. Un'entità che riceve autorizzazione ai sensi dell'articolo 4, paragrafo 1, deve aver assunto almeno una persona
responsabile della sicurezza. La persona responsabile della sicurezza deve essere approvata dal "Centre for Biosecurity and
Biopreparedness" danese. Ai fini dell'autorizzazione la persona responsabile della sicurezza designata invia un consenso esplicito
al "Centre for Biosecurity and Biopreparedness" danese che dà l'autorizzazione ad acquisire informazioni sul casellario giudiziale.
Paragrafo 2. L'entità è responsabile della nomina di un nuovo responsabile della sicurezza e che questa sia approvata dal
"Centre for Biosecurity and Biopreparedness" danese prima che l’incaricato precedente cessi il servizio.
Articolo 10. Il responsabile della sicurezza deve seguire una delle formazioni offerte dal "Centre for Biosecurity and
Biopreparedness" danese. La formazione è offerta gratuitamente.
Paragrafo 2. Tale responsabile deve garantire che le persone che hanno accesso alle sostanze biologiche di cui all'allegato 1
siano a conoscenza delle regolamentazioni in materia, e che conoscano le linee guida inviate dal "Centre for Biosecurity and
Biopreparedness" danese al riguardo. Queste ultime possono essere richieste al "Centre for Biosecurity and Biopreparedness"
danese o tramite il sito web www.biosikring.dk.
Paragrafo 3. La persona responsabile della sicurezza deve registrare tutte le persone che hanno accesso alle sostanze
biologiche di cui all'allegato 1. L'elenco deve essere presentato in qualsiasi momento al "Centre for Biosecurity and
Biopreparedness" danese su richiesta.
Articolo 11. Le persone, che non sono registrate, cfr. 10, paragrafo 3, possono accedere alle sostanze biologiche di cui
all'allegato 1, se ciò avviene al seguito di una persona registrata e sotto la sua responsabilità.
Articolo 12. Nella misura in cui l'autorizzazione è rilasciata cfr. articolo 4, paragrafo 1, e la detenzione, produzione, utilizzo
o conservazione della sostanza biologica per la quale è stata concessa l'autorizzazione, ha diretta relazione con la produzione o
analisi delle armi, il Centre for Biosecurity and Biopreparedness" danese può richiedere una valutazione della sicurezza delle
persone rientranti nell'attività.
Conservazione e trasporto
Articolo 13. Le sostanze biologiche oggetto del decreto, cfr. allegato 1, devono essere conservate in modo da essere
protette da furto e abuso.
Articolo 14. Il trasporto delle sostanze biologiche di cui all'allegato 1 deve avvenire in conformità delle disposizioni vigenti
relativa al trasporto di merci pericolose. Per il trasporto su strada si applicano le disposizioni dell'Accordo europeo sul trasporto
internazionale su strada di merci pericolose (ADR) per le classi 6.1 e 6.2 (codice UN 3172, 3373, 3462 o 2900), per il trasporto
su ferrovia si applicano le disposizioni del Regolamento, relativo al trasporto internazionale delle merci pericolose per ferrovia
(RID) per le classi 6.1 e 6.2 (codice UN 3172, 3373, 3462 o 2900), per il trasporto via mare le disposizioni del codice
internazionale del trasporto via mare di merci pericolose (IMDG), per le classi 6.1 e 6.2 (codice UN 3172, 3373, 3462 o 2900) e
per il trasporto aereo le disposizioni delle Istruzioni tecniche per la sicurezza del trasporto aereo delle merci pericolose (OACI )
per le classi 6.1 e 6.2 (codice UN 3172, 3373, 3462 o 2900).
Paragrafo 2. L'entità deve garantire che i trasportatori, spedizionieri e altri utilizzati, siano a conoscenza della responsabilità
relativa al controllo delle merci in loro possesso.
Paragrafo 3. I trasportatori, spedizionieri ecc., devono garantire che le spedizioni contenenti le sostanze biologiche di cui
all'allegato 1, siano trasportate, conservate transitoriamente e consegnate al destinatario in modo tale da assicurarle contro il
furto, abuso e smarrimento nonché garantire che terzi non possano entrare in contatto con le stesse.
Sicurezza
Articolo 15. Nella richiesta di autorizzazione, cfr. articolo 4, paragrafi 2 e 3, l'entità deve redigere una valutazione della
vulnerabilità e un piano di sicurezza, da prendere in esame nella valutazione della domanda.
Paragrafo 2. Il piano di sicurezza deve comprendere:
1) procedure di registrazione delle tenute di scorta,
2) procedure relative allo smaltimento,
3) procedure relative agli incidenti,
4) un sistema di controllo dell'accesso,
5) barriere di sicurezza tecniche, compresi i sistemi di allarme, manutenzione tecnica degli allarmi ecc.,
6) valutazione di sicurezza delle persone designate, cfr. articolo 12,
7) controllo di informazioni sensibili, compresa la conservazione delle informazioni sulla tecnologia, conservazione delle
sostanze ecc. nonché del personale e delle informazioni relative alle visite (sicurezza tecnologica e dei documenti), e
8) esercitazioni o formazione.
Paragrafo 3. Il piano di sicurezza deve essere aggiornato e deve poter essere presentato al "Centre for Biosecurity and
Biopreparedness" danese su richiesta.
Registrazione e smaltimento, acquisto, vendita o altra forma di trasferimento di sostanze biologiche
Articolo 16. L'entità deve tenere un registro delle sostanze biologiche di cui all'allegato 1, di cui è responsabile. Il registro
deve essere tenuto aggiornato costantemente e comunque almeno una volta perl trimestre. Il registro e gli altri documenti
relativi all'autorizzazione devono essere conservati per almeno cinque anni dal momento del rilascio dell'autorizzazione.
Paragrafo 2. L'entità deve segnalare i dati delle consistenze delle sostanze biologiche registrate al "Centre for Biosecurity and
Biopreparedness" danese almeno una volta all'anno. I movimenti di magazzino sono registrati secondo una delle procedure
stabilite dal "Centre for Biosecurity and Biopreparedness" danese.
Paragrafo 3. L'entità deve poter presentare su richiesta del "Centre for Biosecurity and Biopreparedness" danese il registro di
cui al paragrafo 1 in qualsiasi momento.
Articolo 17. Smaltimento, acquisto, vendita o altra forma di trasferimento delle sostanze biologiche rientranti nell'allegato 1
del presente decreto devono essere notificati al "Centre for Biosecurity and Biopreparedness" danese entro 14 giorni lavorativi
dal momento dello smaltimento, acquisto, vendita o trasferimento indicando la natura, quantità e mittente o destinatario.
Paragrafo 2. L'azienda è responsabile che lo smaltimento, cfr. paragrafo 1, avvenga in tale modo che le sostanze biologiche
non possano divenire pericolose per la sicurezza degli animali.
Incidenti e smarrimento
Articolo 18. Il "Centre for Biosecurity and Biopreparedness" danese deve essere prontamente informato nei seguenti casi:
1) Furto, abuso o altro tipo di smarrimento delle sostanze biologiche di cui all'allegato 1.
2) Sospetto di fughe delle sostanze biologiche di cui all'allegato 1.
3) Sospetta o fondata presenza delle sostanze biologiche di cui all'allegato 1.
Paragrafo 2. deve essere vietato l'accesso agli intrusi a tutte le zone con presenza incontrollata di sostanze biologiche di cui
all'allegato 1, fino a che il "Centre for Biosecurity and Biopreparedness" danese non abbia adottato le misure per affrontare il
possibile pericolo.
Controllo
Articolo 19. il "Centre for Biosecurity and Biopreparedness" danese monitora affinché le disposizioni del presente decreto
siano soddisfatte.
Diritto di ricorso, sanzioni, attuazione e disposizioni transitorie
Articolo 20. È possibile presentare ricorso contro le decisioni adottate dal "Centre for Biosecurity and Biopreparedness"
danese, in conformità del presente decreto, presso il centro ricorsi per l'Agricoltura, pesca e alimentazione entro quattro
settimane dalla notifica della decisione.
Articolo 21. Salvo sanzione più elevata da parte di un’altra legislazione, è sanzionabile chi viola l'articolo 4, paragrafo 1,
articolo 5, paragrafo 2, l'articolo 6, paragrafo 3, 2. punto 2, l'articolo 8, paragrafi 1 o 4, gli articoli 9-11, gli articoli 13-14,
l'articolo 15, paragrafo 3, gli articoli 16-18 o l'articolo 22, paragrafo 2.
Paragrafo 2. La sanzione può essere elevata alla reclusione fino a 2 anni, se la violazione è commessa intenzionalmente o
per negligenza grave, e in forza della violazione:
1) ha danneggiato la salute di persone o animali, beni o ambiente o ha comportato rischi per gli stessi, ovvero che
2) ha procurato o è stata finalizzata a procurare benefici economici per gli interessati o per terzi, anche sotto forma di
risparmi.
Paragrafo 3. Le imprese, ecc. (persone giuridiche) possono essere ritenute penalmente responsabili a norma delle
disposizioni del capitolo 5 del codice penale.
Articolo 22. Il presente decreto entra in vigore il 1° luglio 2016.
Paragrafo 2. Le entità che alla data di entrata in vigore del presente decreto siano in possesso di sostanze biologiche di cui
all'allegato 1, devono al più tardi entro 6 mesi dalla messa in vigore, inviare la domanda di autorizzazione, ai sensi dell’articolo
4, paragrafi 2 e 3, qualora l'azienda desideri continuare a detenere le sostanze biologiche. In caso contrario le sostanze
biologiche devono essere distrutte in modo sicuro, ai sensi dell’articolo 17, paragrafo 2, entro la scadenza del termine
sopramenzionato di 6 mesi.
Paragrafo 3. Le entità che hanno inviato una domanda, cfr. paragrafo 2, detengono un'autorizzazione temporanea che ha
validità fino alla decisione del "Centre for Biosecurity and Biopreparedness" danese.
Allegato 1
Elenco delle sostanze biologiche soggette a controllo.
Agenti patogeni animali
A. I virus naturali, rinforzati o modificati, sotto forma di colture isolate o sotto forma di materiali, compresi i materiali vivi,
inoculati intenzionalmente o contaminati dalle colture seguenti:
1) Virus della peste equina.
2) Virus della peste suina.
3) Virus dell'influenza aviaria, che è:
a) non caratterizzato, o
b) definito nell'allegato I, punto 2, della direttiva 2005/94/CE (GU L 10 del 14.1.2006, p. 16), ed aventi elevata
patogenicità, come segue:
i) virus di tipo A con un IVPI (indice di patogenicità intravenosa) superiore a 1,2 nei polli di 6 settimane, o
ii) virus di tipo A con una sequenza genomica che codifica per molteplici amminoacidi basici a livello del sito di
clivaggio dell'emoagglutinina, analoga a quella osservata per altri virus della HPAI, indicativa del fatto che
l'emoagglutinina può essere clivata da una proteasi ubiquitaria dell'ospite.
4) Virus della febbre catarrale.
5) Virus dell'afta epizootica.
6) Virus del vaiolo caprino.
7) Virus della malattia di Aujeszky.
8) Virus di peste suina (virus Hog Cholera).
9) Virus della dermatite nodulare contagiosa.
10) Virus della malattia di Newcastle.
11) Virus della peste dei piccoli ruminanti.
12) Enterovirus porcino tipo 9 (virus dell'esantema vescicolare dei suini).
13) Virus della rabbia e tutti gli altri membri del genere Lyssavirus.
14) Virus della febbre bovina.
15) Virus del vaiolo ovino.
16) Teschovirus A.
17) Virus della stomatite vescicolosa.
B. I batteri naturali, rinforzati o modificati, sotto forma di colture isolate o sotto forma di materiali, compresi i materiali vivi,
inoculati intenzionalmente o contaminati dalle colture seguenti:
1) Mycoplasma capricolum sottospecie capripneumoniae (tipo F 38).
2) biotipo piccolo colonie)
Nota 1:
Non sono obbligatori i controlli dei vaccini.
Elementi genetici e organismi geneticamente modificati
Organismi geneticamente modificati o elementi genetici contenenti sequenze di acidi nucleici, associati a patogenicità degli
organismi di cui alle lettere A-B nell'elenco degli agenti patogeni animali di cui sopra.
Nota 1:
Gli elementi genetici comprendono gli organismi, dove il materiale genetico (la sequenza di acido nucleico) è stato modificato in
un modo da non avvenire in natura con l'accoppiamento o la ricombinazione genetica naturale, e include organismi totalmente
o parzialmente prodotti artificialmente.
Nota 2:
Gli elementi genetici comprendono fra l'altro cromosomi, genomi, plasmidi, transposoni e vettori geneticamente modificati
oppure non o totalmente o parzialmente prodotti da sintesi chimica.
Nota 3:
Nelle sequenze di acido nucleico connesse alla patogenicità di ciascuno dei microorganismi, specificati ai punti A – B dell'elenco
degli agenti patogeni animali di cui sopra, s’intende ogni sequenza propria di un specifico microorganismo e che:
1) comporta di per sé o tramite i loro prodotti trascritti o traslati un rischio significativo per la salute degli animali, o
1) è nota per rendere un microorganismo specificato o qualunque altro organismo che può essere introdotto o integrato in
altro modo più capace di arrecare gravi danni alla salute degli animali.
Note ufficiali
Il decreto incorpora le disposizioni che attuano parti della direttiva 2006/123/CE del Parlamento europeo e del Consiglio relativa ai servizi nel mercato
interno, EU-Tidende 2006, n. L 37, pagina 36. Il presente progetto di decreto è stato notificato in conformità della direttiva 98/34/CE del Parlamento
europeo e del Consiglio (direttiva sulla procedura d'informazione), come modificata dalla direttiva 98/48/CE.
1)