
Medicina di laboratorio
07/04/2006
Prof. D'Onofrio
III ora
Dopo un interrogatorio ai pochi presenti, il prof. Accenna ad un possibile compito scritto entro la
fine del secondo semestre
Ab = Anticorpo
Ag = Antigene
Introduce l'argomento del giorno, che è possibile trovare su tutti i libri, i GRUPPI SANGUIGNI..
che verrà trattato ampiamente ad esercitazione.
Le persone possono essere suddivise in gruppi a seconda degli antigeni che portano sui globuli
rossi, caratteristica ereditaria. Fino al 1900 erano stati fatti numerosi tentativi di trasfusione: tra
uomo e uomo, tra animale e uomo,.. che potevano dare conseguenze drammatiche, al punto di
essere proibite. A fine '800 si capì la presenza di antigeni di superficie che non erano comuni a tutta
la specie umana. Un altro concetto è quello di sistema Rh e sistema ABO . il termine sistema vuol
dire che gli antigeni che lo compongono sono codificati da geni alleli, quindi presenti sullo stesso
cromosoma. la trasmissione ereditaria segue le Leggi di Mendel in maniera semplice.. per esempio
A B e O sono trasmessi in maniera riconoscibile perché i geni che determinano la presenza di questi
antigeni vanno ad occupare un determinato allele, in una determinata posizione in un determinato
cromosoma che è, mi sembra, il numero 9 . I geni del sistema Rh sono su tutt'altro cromosoma, in
numero 1. Quindi una persona del gruppo A può essere indifferentemente A positivo o A negativo,
non c'è nessuna relazione tra gli antigeni di questi 2 sistemi. Nel caso in cui la persona sia AB, vuol
dire che ha ricevuto da un genitore il gene A e dall'altro il gene B. Il sist ABO viene descritto con
esperimenti di laboratori di agglutinazione crociata tra plasma e globuli rossi di vari persone intorno
al 900, il sist Rh viene descritto 40 anni dopo.
Oggi sappiamo che i gruppi sanguigni sono molto numerosi e ve ne sono alcuni più importanti dal
punto di vista clinico.
Alcuni indicati con ss : sono eritrocitari, esclusivamente presenti sui globuli rossi e difendono la
trasmissione selettiva dei geni che danno gli eritroblasti, cioè quelle cellule staminali che diventano
i precursori dei globuli rossi.
Altri sono dei gruppi che si possono definire tissutali cioè presenti sui globuli rossi, sui linfociti e
su altre cellule .
Il sistema Rh ha l'espressione di geni e quindi la presenza di antigeni in molte cellule.
Con questi sistemi si può studiare il livello di antigenicità dei globuli rossi, degli anticorpi e dei
geni che determinano l'espressione degli antigeni sulla superficie. Focalizziamo il discorso sugli
antigeni(Ag) dei gl rossi e degli anticorpi(Ab) che sono i responsabili della generazione del
conflitto.
ABO è un sistema il cui determinante antigenico è uno solo: dalla superficie sporge una struttura di
base di natura glicolipidica, presente su tutti i gl rossi di tutti i soggetti, costituita da Glc-Gal-N
acetil Glucosammina-Gal e completata da una molecola di Glc la cui estremità porta uno zucchero
esoso che determina la specificità antigenica. In particolare è la presenza e la struttura dell'ultimo
zucchero a determinare l'appartenenza ad un gruppo; nei soggetti O è assente.
L'attacco dell'ultimo zucchero è dovuto al gene: Il gene A fa attaccare l'N-acetil galattossammina, il
gene B il Gal, il gene O nessuno .
Rh invece è un polipeptide piuttosto lungo,costituito da 417 AA, che attraversa tutta la membrana
eritrocitaria 12 volte e si formano come catenelle antitetiche, qnd diversa strutturalmente differente.
Per gli Ab, nell'ambito del sistema ABO, è importante dire che esiste una immunizzazione naturale
contro gli Ag che l' organismo non ha. Se un individuo è di gr. A possiede nel siero gli Ab per l'Ag
che non ha, cioè contro B
1
Un individuo di gr O possiede gli Ab per entrambi gli Ag, perché non ha nessuno degli Ag A e B,
pertanto può essere considerato donatore universale, mentre può ricevere solo da O.
I soggetti AB possono essere considerati dei riceventi universali.
Gli Ag Rh sono esclusivamente presenti sugli eritrociti umani e il termine Rh deriva dai Rhesus, la
scimmia su cui si facevano gli esperimenti inoculando il sangue umano e vedendo quali Ab si
producevano.
Dal punto di vista genetico bisogna tener presente che A e B sono dominanti su O e codominanti
fra loro. Pertanto:
un fenotipo di gr A, nonostante possieda solo Ag A, può essere omo o eterozigote, cioè è presente
anche il gene O che è silente e non codifica per alcun Ag .
lo stesso vale per il fenotipo B.
Invece negli individui di gr. O e AB il fenotipo corrisponde al genotipo e nel secondo i 2 geni si
esprimono entrambi.
Sappiamo che il gene codifica proteine..come fa ad agire su Ag che è glucidico? Sintetizzando una
glicosil-Trasferasi che potrà agire trasferendo Gal o N-acetilgalattosammina. Il gene O, che
abbiamo definito gene inattivo, sintetizza una fucosil-Trasferasi che completa la struttura di base.
Ci sono dei soggetti geneticamente insoliti, saranno in tutto il mondo qualche migliaio, che hanno
una caratteristica: manca loro la Fucosil-trasferasi, per cui non solo sono privi dei due zuccheri
terminali, ma anche la struttura di base non si completa con il Glc, qnd la loro sostanza h non si
forma, rimane primordiale, incapace di legare gli eventuali zuccheri. Questo determina la
formazione di Ab contro la sostanza h (anti h) in grado di agglutinare e far precipitare tutti i gl rossi
di tutti i soggetti umani tranne quelli aventi lo stesso deficit.
Bisogna avere del sangue conservato in modo tale da poter dare un supporto trasfusionale.
Due parole sul sistema Rh, che è composto da un polipeptide transmembrana: i soggetti che ne
sono privi non presentano alcuna anomalia dei gl rossi, perché il loro Ag sta all’interno e non
danneggia la membrana eritrocitaria. Le vie che portarono alla scoperta furono due:
- tramite esperimenti sulle scimmie, in cui venivano inoculati gl rossi umani e si trovò, tra i
vari Ab che si producevano, un nuovo Ab che si chiamava anti-Rh.
- -Una donna partorì un figlio affetto da una “malattia emolitica del neonato”, cioè quella
malattia caratterizzata da un’emolisi………..Si sapeva che aveva una causa immunologica,
anche se il meccanismo non era ancora stato ben capito. La donna fu trasfusa col sangue del
marito ed ebbe una reazione trasfusionale, in tal modo ci si rese conto che la donna aveva un
anticorpo diretto contro un antigene ancora sconosciuto presente sui globuli rossi del marito
e del feto.
Si vide che gli studi erano sulla scia di quelli sulla scimmia e da quel momento la popolazione
mondiale fu divisa in individui Rh – e Rh+ (circa l’85%).
Adesso si è capito che non c’è un solo antigene. Quello che era l’antigene Rh, fu chiamato Ag
D, successivamente sono stati descritti altri 4 antigeni C, E, c, e, presenti con questa frequenza;
i geni che codificano questi antigeni E ed e, e lo stesso vale per C e c, sono presenti sullo stesso
locus, per cui un soggetto può essere omozigote o eterozigote. Non è stato mai descritto un Ag
corrispondente all’allele “d”, quindi non esiste un Ag che possiamo chiamare d; il gene d che
non produce l’Ag possiamo definirlo silente. Una persona può avere 5 Ag se è eterozigote sia
per C che per E. Quando si fa il gruppo Rh bisogna usare 5 anti- sieri: D,C,c,E,e; a seconda
delle positività si hanno i diversi antigeni. Ad es. un sogg. Rh-, ha il gene d,c,e. Questo gruppo
di geni che è stato trasmesso dal padre e dalla madre, sono geni che si trovano su loci collegati
tra loro molto vicini sul cromosoma, infatti oggi si ritiene che si trovino sullo stesso locus;
questi gruppetti di geni si chiamino aprioturi (?), cioè sono geni strettamente uniti tra loro. Nel
fenotipo del 13% dei sogg. Rh+ sono presenti tutti quanti i 5 Ag principali del sistema Rh,
oppure per esempio ci sono diversi tipi di combinazioni, sia più rare che più frequenti. Quando
2
noi facciamo una trasfusione di sangue dobbiamo essere molto rigorosi sull’Ag D,che è il più
immunogeno, cioè quello capace di produrre più anticorpi in chi riceve, mentre gli altri lo sono
molto meno e si cerca di mantenere la compatibilità di questi Ag, ma non è sempre possibile.
Addirittura oggi sono stati descritti 51 Ag del sistema Rh, di cui quei 5 sono di uso clinico;per
alcuni sono usate designazioni numeriche e ci rendiamo conto della complessità di questo
sistema.
Ritornando al sistema ABO, non vi ho detto, che il gruppo A principale è detto A1 e ne esiste
anche un altro detto A2, in cui c’è un’espressione minore dell’Ag A sui globuli rossi.
Proprietà degli anticorpi
Ab del sistema ABO
Sono detti NATURALI perché il soggetto li forma pochi mesi dopo la nascita (da 1 a 3) e sono
anche REGOLARI proprio perché, a seconda del gruppo, ognuno ha l’anticorpo corrispondente
all’Ag che non possiede, questo Ab è di tipo IgM.
Noi sappiamo che per definizione un anticorpo si forma in risposta a un Ag.
Sarebbe una domanda molto opportuna: se un sogg. non è mai stato trasfuso e non è mai venuto
a contatto con un determinato Ag, come fa a formare Ab contro di esso? (Perché un individuo
O forma anticorpi anti A e anti B?) Questo perché gli Ag (Gal e Glc) sono molecole molto
diffuse in natura, ad es. nei vegetali, nei pollini dell’aria, nelle pareti dei batt. che colonizzano il
nostro intestino,quindi dopo la nascita quando si viene esposti all’ambiente esterno si incontrano
questi Ag con molta facilità o Ag molto simili.In realtà non è l’Ag intero come quello che si
trova nei globuli rossi, ma è la porzione predominante, cioè quegli zuccheri che determinano la
specificità antigenica. Quindi, il contatto molto graduale, che non determina nessuna reazione
violenta o allergia, ma solo la formazione di questi anticorpi di tipo IgM che rimangono come
marcatore biologico esattamente equivalente all’Ag dei globuli rossi.
Altra proprietà di questi Ab:sono COMPLETI, cioè in grado di agglutinare i globuli rossi che
hanno Ag corrispondenti senza nessun aiuto; basta mettere in provetta o sul vetrino l’antisiero e
i globuli rossi formano ammassi molto grossolani (si vede macroscopicamente).
Altra proprietà degli Ab del sistema ABO è la CAPACITA’ DI FISSARE IL
COMPLEMENTO, agente principale dell’emolisi, che comporta la perforazione delle
membrane; in particolare è il C9 che determina la formazione della cosiddetta “attacco
membrana” che insieme a 2 Perforine forma proprio dei buchi.(????)
Dal punto di vista della “malattia emolitica del neonato” l’Ab del sistema ABO non attraversa
la placenta, il che è molto importante perché consente che una madre di gruppo 0 abbia dei figli
A,B o AB senza che gli Ab attacchino i globuli rossi del feto.
Ab del sistema Rh
Invece gli anti-Rh sono IgG, non sono naturali e si formano solo nel caso in cui si entri in
contatto con l’Ag sui globuli rossi umani attraverso due modalità: trasfusioni o incompatibilità
materna. Quindi se io trasfondo sangue Rh+ ad un soggetto Rh- il rischio di immunizzazione è
piuttosto elevato.
Dal momento che mi vergogno per il ritardo della consegna, non scrivo il mio nome e mi risparmio
i saluti…, tanto non capirete mai chi sono…!!!
3
Medicina di laboratorio – Immunoematologia
Prof. D’Onofrio
Venerdì 07/04/06
h. 11.30-12.30
Gli anticorpi completi, naturali, regolari (IgM) del sistema AB0, avendo molti siti di legame, almeno 10, sono capaci di
agglutinare i globuli rossi molto facilmente, non hanno bisogno di nessun aiuto, creano loro stessi il ponte che legandosi
agli antigeni presenti su globuli rossi diversi (sul globulo rosso gli antigeni sono un milione) crea una trama
tridimensionale che fa sì che si verifichi l’agglutinazione.
Gli anticorpi IgG che sono incompleti, hanno solo 2 siti di legame, non riescono a vincere la distanza e le forze
repulsive dovute alle cariche elettrostatiche negative che ci sono sulla membrana dei globuli rossi, non riescono a
formare questo reticolo tridimensionale e quindi a evidenziare l’agglutinazione.
Quindi se voglio sapere se c’è un anticorpo IgG, per es. di tipo anti-Rh che ha reagito con i globuli rossi, dovrò usare
qualche sistema che permette di vedere i globuli rossi che sono ricoperti di anticorpo ma non agglutinati, l’anticorpo si
lega alla membrana ma non determina agglutinazione; invece per AB0 non c’è problema, perché basta che aggiungo
l’anticorpo e i globuli rossi si agglutinano.
Per determinare l’agglutinazione visibile ho aggiunto un altro anticorpo particolare che è stato “prodotto” da un
ricercatore che si chiamava Coombs, da qui il nome Test di Coombs; questi anticorpi sono prodotti immunizzando gli
animali in laboratorio con le immunoglobuline umane, quindi sono anticorpi anti-immunoglobuline umane, e in
particolare hanno specificità contro la porzione Fc, quindi riescono a fare quel ponte che mancava per l’agglutinazione.
Quindi il siero di Coombs è l’antiglobulina, è un anticorpo anti-immunoglobuline umane, che si usa a scopi diagnostici.
Esistono due versioni del Test di Coombs: diretto e indiretto.
1) Per esempio ho un neonato, la cui madre ha prodotto le immunoglobuline anti-D (?), però non so se sui globuli
rossi del neonato c’è effettivamente questo anticorpo, quindi prendo i globuli rossi del neonato, li lavo con
soluzione fisiologica, centrifugando più volte, alla fine rimane solo quello che è legato fortemente alla
membrana con legami di tipo antigene-anticorpo e a questo punto aggiungo una goccia del reagente che
determina l’agglutinazione. L’anti-immunoglobulina si lega all’immunoglobulina sull’antigene, determinando
l’agglutinazione. Questo è il test di Coombs diretto: prendo i globuli rossi, ci aggiungo l’anti-globulina e vedo
l’agglutinazione.
2) Il test di Coombs indiretto si verifica in quanto io non vado a cercare un anticorpo sui globuli rossi, ma lo vado
a cercare nel siero, che ancora non ha reagito. Facendo lo stesso esempio di prima, prima del parto io posso
cercare nella madre se ha prodotto questo anticorpo, però non sta sui globuli rossi, che sono Rh-, ma sta nel
siero. Questo test di Coombs indiretto è fatto da tutte le donne Rh- che hanno una gravidanza. Quindi si deve
evidenziare che gli anticorpi non sono legati, quindi devo fornire in laboratorio l’antigene, cioè dei globuli
rossi Rh+. Quindi prendo il siero dai pazienti da testare, lo aggiungo a globuli rossi Rh+ che ho come reagenti
di laboratorio, ricostruisco così, se c’è l’anticorpo, la situazione precedente; a questo punto aggiungo l’antiglobulina, dopo aver lavato il tutto e così ottengo una agglutinazione.
Il diretto serve per vedere sui globuli rossi se c’è l’anticorpo, l’indiretto serve per vedere nel siero se c’è l’anticorpo
libero che può poi, però, legarsi ai globuli rossi.
Tra l’altro nella donna si può anche fare un test quantitativo: voi sapete cos’è una titolazione? Si riduce la
concentrazione dell’anticorpo, diminuendo il plasma e ad esempio posso dire che al secondo mese aveva un test di
Coombs indiretto positivo 1:16, se vedo che al quarto mese ha un test di Coombs positivo 1:532, quindi molto più
diluito, è un segno grave, perché vuol dire che la donna sta aggravando la sua immunizzazione e quindi il feto è Rh+.
L’antigene da temere più di tutti per l’immunogenicità è l’Rh D, nel 70% dei casi se uno fa una trasfusione
incompatibile si forma un anticorpo. Al secondo posto c’è il Kell, che è un altro sistema, molto simile all’Rh; poi c, E, e
hanno una frequenza di immunizzazione molto bassa.
Non si devono mai trasfondere emazie Rh+ a soggetti Rh-, per non compromettere il futuro trasfusionale e il futuro
ostetrico se si tratta di donne in età fertile. Se arriva un paziente gravissimo, ad esempio reduce da un incidente stradale,
e c’è una richiesta di sangue urgentissima, alle donne si dà sangue 0 Rh- , agli uomini sangue 0 Rh+.
Se io trasfondo sangue Rh+ a un soggetto Rh– c’è un sistema per evitare che si immunizzi, lo stesso lo si fa per evitare
la malattia emolitica del neonato: si fa un’iniezione di immunoglobuline anti-D, le quali vanno a coprire gli antigeni D e
prevengono l’immunizzazione. Questo si fa anche nella donna Rh- che ha avuto un figlio Rh+.
Prima di fare una trasfusione devo sempre fare una ricerca degli anticorpi irregolari, andare a cercare se il paziente ha
oltre agli anticorpi naturali degli anticorpi irregolari, che si formano solo in alcuni soggetti, per es. i trasfusi o donne che
hanno avuto una gravidanza.
Sistema Rhesus: regole trasfusionali
Il rischio di alloimmunizzazione è elevato: non si devono trasfondere emazie D + a soggetti D-, per
non compromettere:
- il futuro trasfusionale del paziente
- il futuro ostetrico delle donne in età fertile
4
Gli eventuali errori possono essere corretti entro 72 ore con Ig anti-D, anche in caso di trasfusione
di concentrati piastrinici o granulocitari contaminati da emazie.
La compatibilità CcEe è più problematica sul piano pratico: è necessaria soprattutto per donne
giovani e politrasfusi
La ricerca degli anticorpi irregolari (anti-Rh e altri) è la regola prima per ogni trasfusione, seguita
dalla prova di compatibilità eritrocitaria
Organizzazione servizio immunotrasfusionale
a)
attività di produzione: sono volte a garantire la costante disponibilità di sangue, emocomponenti ed
emoderivati
b) attività di servizio
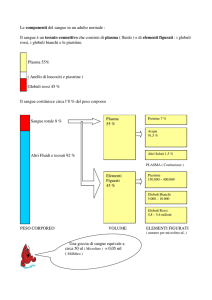
Oggi non si usa mai il sangue intero: quando noi doniamo il sangue (una sacca di 450ml), la sacca viene centrifugata e
separata almeno nelle sue tre principali componenti (globuli rossi, piastrine e plasma). Mancano i globuli bianchi, che
sono un problema per le trasfusioni, perché danno delle immunizzazioni che possono essere dannose, quindi devono
essere eliminati attraverso la leucodeplezione. La medicina moderna fa una terapia mirata, cioè dà al paziente solo
quello di cui ha bisogno (gli mancano i globuli rossi e dà solo i globuli rossi, gli mancano le piastrine e gli do solo le
piastrine, per evitare grandi emorragie in caso di piastrinopenia, il plasma per evitare carenze di fattori della
coagulazione). Un’altra cosa che si può fare è trattare questi emocomponenti per cercare di eliminare eventuali agenti
patogeni presenti in essi.
Fondamenti della moderna medicina trasfusionale
frazionamento efficace e totale per terapia mirata
leucodeplezione spinta
irradiazione
inattivazione dei patogeni
Il sangue si raccoglie nelle sacche che sono di materiale plastico di alta qualità, dove vi sono circuiti chiusi, ci sono più
di una sacca legate tra loro da questi tubi in cui passano il sangue e i vari componenti che ci interessano, ad esempio io
prendo una sacca, la centrifugo, in modo tale che rimanga il plasma ricco di piastrine nella parte alta, dopodiché si fa
passare questo attraverso il tubo, così avremo da una parte il sangue con i globuli rossi e dall’altra il plasma con le
piastrine. Tutto questo avviene in totale sterilità, non c’è nessuna apertura in questo circuito.
Un altro esempio è costituito da tre sacche collegate tra loro. Per separare i globuli rossi da plasma e piastrine si utilizza
lo stesso meccanismo prima descritto, poi si procede ad un’ulteriore centrifugazione del plasma con le piastrine al fine
di separare le piastrine dal plasma e far passare quest’ultimo nella terza sacca. Quindi, avrò globuli rossi, plasma e
piastrine.
Tra globuli rossi e plasma c’è un piccolo strato biancastro, detto Buffy Coat, in cui ci sono piastrine e globuli bianchi. A
seconda della velocità di centrifugazione, le piastrine possono trovarsi nel Buffy Coat o nel plasma.
Quando faccio passare lo strato dei globuli bianchi, ad un certo punto mi blocco in modo che faccio questa riduzione del
contenuto del globuli bianchi. Quindi è importante notare che gli emocomponenti sono leucoridotti.
Vediamo ora i prodotti che otteniamo dopo una donazione di sangue.
Il primo sono i globuli rossi concentrati, eventualmente leucodepleti ed irradiati. Sono concentrati, quindi hanno un
valore totale di emoglobina di 45g; l’ematocrito, che normalmente è 45%, è diventato 65-75%. questi globuli rossi si
conservano a 4°C in un frigorifero che si chiama emoteca. Il tempo di conservazione dipende dal tipo di nutriente o
anti-coagulante che io metto, in media 35 giorni; si aggiungono degli anti-coagulanti che tolgono il calcio e poi sostanze
che servono a formare l’ATP, in modo che il globulo rosso mantenga il suo patrimonio energetico, in questo caso la
conservazione può arrivare fino a 42 giorni.
Globuli rossi concentrati
Hb > 45g
HCT 65-70%
Emolisi > 0,8
Conservazione: 4oC ± 2
35 giorni (42 giorni)
Abbiamo dei trattamenti speciali per i globuli rossi: si tolgono i globuli bianchi filtrando (i globuli rossi vengono
deleucocitati), si possono irradiare. La filtrazione si fa quando introduco questi diversi componenti, specialmente i
globuli rossi, posso mettere un filtro che trattiene ancora di più i globuli bianchi.
5
Globuli rossi: trattamenti speciali
Deleucocitati
Filtrati
Irradiati
Lavati
- proteine < 0,3 g/unità
- conservazione < 24 ore
Congelati
-glicerolo
-conservazione 10 anni
-per fenotipi rari, scorte, autotrasfusione
I globuli bianchi non hanno alcuna utilità, anzi sono dannosi, perché possono essere causa di reazioni in persone che
fanno molte trasfusioni e soprattutto in soggetti immuno-depressi. La filtrazione può essere fatta nel momento in cui
separo i diversi componenti oppure in cui trasfondo, mettendo un filtro nelle sacche.
Filtrazione
Pre-storage, in linea
In laboratorio
Al letto del malato
Vediamo adesso i vantaggi della leucodeplezione. Essa serve a prevenire diverse reazioni, la principale è la
alloimmunizzazione anti-HLA (i sistemi HLA sono tutti diversi tra i vari individui, tranne nei fratelli e nei gemelli). In
pratica si possono sempre produrre degli anticorpi anti-HLA contro i globuli bianchi e questi sono i responsabili di
reazioni febbrili in future trasfusioni. Se un paziente ha degli anticorpi anti-HLA (sono presenti ad esempio antigeni
anche sulle piastrine) e reagiscono contro le piastrine che si trasfondono, diventa refrattario alla trasfusione piastrinica.
Un’altra cosa che fanno i globuli bianchi quando sono dentro la sacca è di produrre citochine, che possono produrre
delle reazioni febbrili. L’ultimo vantaggio è la riduzione delle infezioni da cytomegalovirus, questo ha la caratteristica
di risiedere all’interno dei leucociti. Questa infezione è molto comune, però in soggetti con normali difese immunitarie
dà una lieve reazione, una sindrome febbrile che neanche viene diagnosticata, invece, nei pazienti immuno-depressi,
trapiantati, bambini prematuri questa infezione può dare delle polmoniti e delle infezioni generalizzate.
Vantaggi della leucodeplezione
riduzione del rischio di alloimmunizzazione anti-HLA
riduzione dal rischio di sviluppare refrattarietà piastrinica
riduzione delle reazioni trasfusionali febbrili da citochine
prevenzione delle infezioni (CMV)
L’altra cosa che si fa è irradiare. Una volta tolti i globuli bianchi con la filtrazione alcuni rimangono ancora. L’obiettivo
è di scendere sotto 1 milione di globuli bianchi per sacca, però quei pochi che rimangono possono essere ancora
eliminati, perché sempre se vengono somministrati a soggetti immuno-depressi, che non hanno la capacità di eliminare
gli antigeni estranei, possono dar luogo a GVHD (graft versus host) (?); in questo caso la trasfusione di sangue può
fungere come un trapianto perché apporta dei linfociti, che possono dare una reazione contro il ricevente.
Quindi la leucodeplezione riduce questa possibilità ma non la abolisce. Questa può essere abolita irradiando, utilizzando
un irradiatore specifico con il cesio, e i globuli bianchi vengono uccisi o bloccati.
Vantaggi dell’irradiazione
prevenzione della GVHD trasfusionale
la leucodeplezione la riduce ma non la abolisce
verso una irradiazione globale degli emocomponenti
Oltre a togliere i globuli bianchi e ad irradiarli, posso lavare i globuli rossi. Una delle possibili reazioni alla trasfusione
è di tipo allergico: il paziente fa una trasfusione e gli viene l’orticaria (è la tipica reazione IgE, mast cellule, basofili);
quindi è legata ad una immunizzazione del ricevente contro le proteine plasmatiche. Per lavare, quindi per togliere il
plasma in maniera completa, si utilizza la soluzione fisiologica, si centrifuga, si rimuove tutto quello che viene sopra e
si rifà questa procedura in modo da raccogliere tutte le proteine che stanno in cima.
Si possono anche congelare i globuli rossi, per aumentare la loro durata di conservazione, che può durare in questo
modo più di 10 anni. Questo può essere molto utile in alcuni casi, ad esempio per avere una scorta di sangue 0 negativo,
o nel caso dei soggetti Bombay, che possono essere trasfusi solo con il loro sangue, che non abbia neanche la sostanza
di base AB0.
6
Vediamo ora le piastrine, che si ottengono per separazione dal sangue intero. Ma c’è un’altra modalità di ottenerle che
si chiama aferesi, anziché donare il sangue intero, vengono donate solo le piastrine; ciò non dà nessun disturbo e le
piastrine si riformano immediatamente, perché c’è una riserva nella milza che è già pronta. La raccolta da separatore
cellulare è migliore perché riduce la possibilità di infezione. Se un soggetto deve essere trasfuso e ha solo un
concentrato da sangue intero (concentrato standard), ne devo trasfondere 6-8 unità per una dose se è un adulto; se
invece è una sacca da separatore cellulare, la dose è una sacca. Se faccio ad una persona 8 unità diverse, ho 8 possibilità
di utilizzazione, perché gli antigeni HLA di questi 8 operatori sono diversi; se invece ho una sacca unica che ha un
donatore, è ovvio che le possibilità di utilizzazione sono minori.
I trattamenti sulle piastrine sono più o meno gli stessi che si fanno sui globuli rossi. La cosa importante è che le
piastrine non si conservano a freddo, ma a 22-24°C, in agitazione; infatti, c’è una emoteca che ha dei piani rotanti, che
si agitano continuamente perché le piastrine, se restano ferme, tendono ad aggregarsi tra loro.
Piastrine da Buffy coat o da aferesi
Sangue fresco o PRP (no!)
Concentrate
Pool di 5-8 unità (>2,5 x 10e11)
Filtrate
Conservazione: 22-24oC agitazione
5 giorni
L’ultimo componente di cui parliamo è il plasma. Possiamo ottenerlo da una sacca di sangue singola o dal separatore
cellulare. Per mantenere il plasma bisogna congelarlo immediatamente, per preservare l’attività dei fattori della
coagulazione. Il plasma contiene albumina, immunoglobuline, fattori della coagulazione e gli inibitori. Dopodiché si
può tenere il sangue in ospedale congelato oppure lo si può cedere all’industria, che provvederà al frazionamento per
ottenere l’albumina, le immunoglobuline e i concentrati di diversi fattori della coagulazione, il complesso
protrombinico, fibrinogeno.
Il plasma congelato si può conservare a varie temperature, da -25 a -80°C, fino a 3 anni.
Il crio-precipitato è un prodotto che si otteneva dopo il congelamento del plasma, utilizzato in passato per trattare
l’emofilia, perché molto ricco del fattore VIII. Se alcune ore dopo averlo congelato si scongela immediatamente, si
ottiene un precipitato che non si rimette in soluzione, ed è molto ricco in proteine.
Plasma
PFC (fresco congelato)
Crioprecipitato (FVIII, vW, fibrinogeno, FXIII)
Frazionamento industriale:
- Albumina
- Immunoglobuline
- FVIII
- Complesso protrombinico (FII, VII, IX, X)
- Fibrinogeno, FVII, FXIII
- Inibitore (ATIII, Pr C, Pr S)
Conservazione: da -25o a -80oC
da 12 mesi fino a 3 anni
Giovanna Nardella
(per il cambio di ore con Nasuto)
Gli schemi inseriti nel testo sono stati mostrati a lezione dal professore, spiegano solo più brevemente quello che lui ha
detto.
la lezione di giovedì 6 aprile (ore 10,30-12,30) non si è tenuta, quindi niente sbob! un grazie a Daniela Bernardo che
mi ha chiesto di fare cambio con lei. Un salutone-e andate a votare! Giada
7
8







![MANCA LA PRIMA PARTE [IN ATTESA DI MARCHESINHO] [cical](http://s1.studylibit.com/store/data/000089912_1-3149b4229dde4d130c370bb4e7c60117-300x300.png)