ITIS “G.Galilei”
Lab. Biochimica
ELETTROFORESI
GENERALITÀ
L’elettroforesi è un metodo analitico elettrochimico che sfrutta l’azione di un campo elettrico
applicato che riesce, in particolari condizioni, ad influenzare il comportamento di ioni o molecole
ionizzate.
Agendo con un opportuno campo elettrico su sostanze aventi una io più cariche elettriche, si nota la
loro migrazione verso il polo eteronomo (le positive verso il catodo, le negative verso l’anodo).
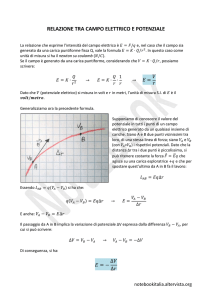
F K *Q *
E
d
(1)
l’equazione (1) si può considerare valida, in termini di approssimazione,
se prendiamo in esame un mezzo omogeneo.
F esprime la forza esercitata dal campo elettrico ed è proporzionale alla differenza di
potenziale applicata (E) ed inversamente proporzionale alla distanza (d) tra i due elettrodi.
Q rappresenta al quantità di carica elettrica
K è una costante che tiene conto delle caratteristiche del mezzo di propagazione e della
temperatura alla quale si opera.
Il mezzo di propagazione è in generale costituito da un supporto umido (carta, amido, agar, acetato
di cellulosa, …).
La velocità di migrazione dipende dalla resistenza presentata dal supporto, dalla forza di attrazione
del campo elettrico e dalla natura del composto che migra.
Inglobando in un fattore di proporzionalità (f) tutte le cause precedentemente esposte che
concorrono in senso positivo o negativo alla velocità di migrazione, otteniamo che per una certa
temperatura la velocità è espressa dall’equazione (2)
V
Q E
*
f d
(2)
Se consideriamo costanti in condizioni sperimentali temperatura, caratteristiche del supporto,
potenziale elettrico e distanza tra gli elettrodi, vediamo che la velocità di migrazione dipende
esclusivamente dalla quantità di carica e questa risulta elemento determinante per la separazione
elettroforetica.
Per “carica elettrica” si intende la differenza in valore assoluto tra due cariche elettriche
eteronime indotte (si possono avere centri positivi o negativi, o entrambi).
A questo riguardo anche molecole apparentemente neutre come proteine, ormoni, anticorpi
posseggono una carica netta. Rapportando la carica netta al peso molecolare si ottiene uno dei
fattori determinanti la separazione elettroforetica.
Ricordiamo che la velocità di migrazione è legata al coefficiente di attrito “f” e quindi la
separazione risulterà dipendente anche dal supporto elettroforetica impiegato.
ELETTROFORESI DELLE PROTEINE
Un posto di primaria importanza, tra le molteplici applicazioni del metodo elettroforetica, spetta
all’analisi delle proteine. La migrazione e separazione dipende da diversi fattori, comunque
l’influenza maggiore viene esercitata dal valore del pH del mezzo.
Le proteine sono molecole complesse costituite da numerosi amminoacidi uniti tra di loro da legami
polipeptidici (- CO – NH -) che sono i responsabili della reazione “al biureto”, sfruttabile
spettrofotometricamente per il loro dosaggio analitico.
La contemporanea presenza di gruppi amminici (basici) e carbossilici (acidi) rende le proteine
composti di natura anfotera capaci di reagire sia in ambiente alcalino che acido.
1
ITIS “G.Galilei”
Lab. Biochimica
A seconda delle condizioni di pH potrà risultare accentuata la forma cationica (-NH3+) o la forma
anionica (-COO-)
Esiste quindi un determinato valore di pH in corrispondenza del quale si avrà parità statistica delle
dissociazioni (punto isoelettrico), tale punto è coincidente con il valore di carica netta = 0 ed è una
caratteristica chimico fisica di ogni proteina.
Con un valore di pH più basso di quello isoelettrico si avrà una prevalenza di dissociazione
cationica, pertanto la carica netta avrà valore positivo e la proteina migrerà verso il catodo (polo
negativo).
Avendo un valore di pH superiore al punto isoelettrico, la dissociazione prevalente è quella anionica
e la proteina migrerà verso l’anodo (polo positivo).
A parità di condizioni sperimentali, ogni proteina presenta una propria velocità caratteristica di
migrazione che è tanto maggiore quanto più lontano il suo punto isoelettrico risulta dal suo valore di
pH del mezzo elettroforetica. Si deve comunque considerare che tale velocità dipende anche dalla
forma e dalle dimensioni delle proteine stesse.
Mantenendo costanti le condizioni di pH, di tensione, di supporto, di temperatura, la velocità di
migrazione, come abbiamo già detto, è funzione della quantità di carica totale.
V
Q E
*
K *Q
f d
2