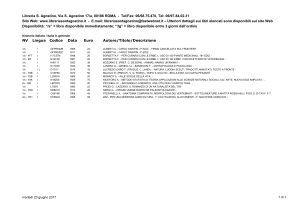
“CORSO DI LAUREA IN: SCIENZE NATURALI”
“Disciplina” Chimica Generale ed Inorganica
“ANNO ACCADEMICO” 2011/2012
Docente: Prof.
Brunetti Bruno
Dipartimento di Chimica, III piano, stanza 352 tel 0649913942
e-mail
[email protected]
Studenti target:
Livello dell’Unità: introduttivo
Pre-requisiti: basi di matematica e fisica
Crediti: 6
Descrizione dei contenuti
Struttura atomica e configurazione elettronica. Tabella periodica degli elementi.
Raggio ionico e covalente, energia di ionizzazione ed affinità elettronica.
Formula minima bruta e di struttura di molecole.
Ossidi, anidridi, idrossidi, acidi e sali e relativa nomenclatura.
Reazioni chimiche e bilanciamento della massa. Reazioni di ossido-riduzione: bilanciamento carica e
massa.
Concetto di mole. Stechiometria delle reazioni chimiche. Determinazione del reagente in eccesso o in
difetto.
Lo stato gassoso. Equazione di stato del gas ideale. Trasformazioni isoterme, isocore e isobare. Cenni di
Termodinamica. Reazioni di combustione. Proprietà colligative delle soluzioni.
Equilibrio chimico e costante di equilibrio
Equilibrio chimico in soluzione acquosa: acidi, basi, idrolisi, sistemi tampone.
Solubilità e prodotto di solubilità
Celle elettrochimiche.
Competenze da sviluppare e Risultati di apprendimento attesi
Lo studente dovrebbe acquisire le basi della chimica in soluzione e di equilibrio. Comprensione dei
concetti di mole e concentrazione. Capacità di calcolare una diluizione, il pH derivante da un semplice
equilibrio acido base, le concentrazioni in un semplice sistema all’equilibrio, la forza elettromotrice di
una comune cella elettrochimica
CONTENUTO
( CFU)
6
Ore in aula
Lezioni
frontali
48
Ore studente a Ore studente Verifiche del
casa
totali
profitto
scitto + orale
Valutazione finale
Testi consigliati
Martin S. Silberberg: CHIMICA, Ediz. McGraw-Hill
John C. Kotz : CHIMICA, , Ediz. EdiSES
Marcello Giomini: STECHIOMETRIA, Ediz. EdiSES
Mario Schiavello Leonardo Palmisano: ELEMENTI DI CHIMICA, Ediz. EdiSES
“CORSO DI LAUREA IN: SCIENZE NATURALI”
“Disciplina” Chimica Generale ed Inorganica
“ANNO ACCADEMICO” 2011/2012
Docente: Prof.
Brunetti Bruno Dipartimento di Chimica, III piano, stanza 352 tel
e-mail: [email protected]
Studenti target:
Livello dell’Unità: introduttivo
Pre-requisiti: basi di matematica e fisica
Crediti: 6
0649913942
Descrizione dei contenuti
Atomic structure and electronic configuration. Periodic table of elements.
Covalent and ionic radius, ionization energy and electron affinity.
Minimum, Molecular and structural formula of molecules.
Oxides, anhydrides, hydroxides, acids and salts and their nomenclature.
Chemical reactions and mass balance. Redox reactions: mass and charge balance.
Mole. Stoichiometry of chemical reactions. Determination of the reagent in excess or defect.
The gaseous state. Equation of state of ideal gas. Transformations isotherms, isochores and isobars.
Principles of thermodynamics. Combustion reactions. Colligative properties of solutions.
Chemical equilibrium and equilibrium constant
Chemical equilibrium in aqueous solution: acids, bases, hydrolysis, buffer systems.
Solubility and solubility product
Electrochemical cells.
Competenze da sviluppare e Risultati di apprendimento attesi
The student should acquire the basics of chemistry of the solutions and of the chemistry of equilibrium .
He must understand the concepts of mole and concentration and must acquire the capability to calculate a
dilution, the pH resulting from a simple acid-base equilibrium, the concentrations in a simple
heterogeneus or omogeneous equilibrium, the electromotive force of a common electrochemical cell
CONTENUTO
( CFU)
6
Valutazione finale
Testi consigliati
Lezioni
frontali
Ore in aula Ore studente Ore
a casa
studente
totali
48
Verifiche
profitto
scitto + orale
del
Martin S. Silberberg: CHIMICA, Ediz. McGraw-Hill
John C. Kotz : CHIMICA, , Ediz. EdiSES
Marcello Giomini: STECHIOMETRIA, Ediz. EdiSES
Mario Schiavello Leonardo Palmisano: ELEMENTI DI CHIMICA, Ediz. EdiSES