APPARATO RESPIRATORIO
Funzioni dell'apparato respiratorio
1)
2)
3)
4)
5)
scambio di sostanze gassose fra atmosfera e sangue
regolazione del pH corporeo (eliminazione della CO2)
protezione da patogeni inalati
vocalizzazione
determinazione di perdita d'acqua e di calore
Generalità: il metabolismo aerobico dipende dal rifornimento di O2 e nutrienti e dalla rimozione di
CO2. Gli organismi unicellulari diffondono dall'ambiente esterno, gli organismi pluricellulari
necessitano invece di un apparato respiratorio per captare l'O2 e di un sistema cardiocircolatorio che
funzioni da vettore. Perché sia possibile lo scambio le superfici debbono essere ampie ed umide; ciò
può causare tuttavia disidratazione e danni meccanici. L'epitelio respiratorio internalizzato permette
la preventiva umidificazione ed filtrazione dell'aria, ma rende più difficile il contatto dell'aria con
l'epitelio di scambio.
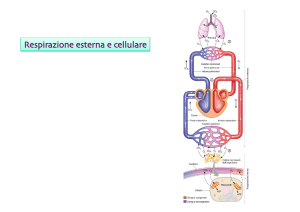
Con la parola respirazione indichiamo due processi:
la respirazione cellulare, un processo di trasformazione che avviene a livello cellulare, dove da
un substrato ad alta energia si passa ad un substrato a più bassa energia, secondo lo schema:
A + O2 ------> B + CO2 + H2O + energia
la respirazione esterna, consistente nello scambio di gas fra l'ambiente e le cellule
dell'organismo.
Negli organismi superiori avviene con quattro processi integrati:
tra atmosfera e polmoni
tra polmoni e sangue
trasporto del gas nel sangue (ciò richiede la perfetta integrazione tra l'apparato respiratorio e
l'apparato cardiocircolatorio)
tra sangue e cellule
---
Anatomia funzionale dei distretti dell'apparato respiratorio
L'apparato respiratorio comincia con le cavità nasale ed orale, per continuare con la faringe, la
laringe, la trachea, le varie generazioni di bronchi, i bronchioli, i bronchioli terminali e i bronchioli
respiratori. Queste strutture, che comprendono fino alla 16ma generazione, costituiscono il sistema
di conduzione, con esclusiva funzione di trasporto. Le pareti di trachea e bronchi hanno cartilagine
nelle loro pareti e relativamente poca muscolatura liscia. Sono ricoperte da un epitelio ciliato che
contiene ghiandole mucose e sierose. Le ciglia sono presenti fino ai bronchioli respiratori, la
cartilagine e le ghiandole sono assenti già a livello dei bronchioli; lo spessore della muscolatura
liscia aumenta sempre di più fino al livello dei bronchioli terminali, per poi diminuire anch'esso.
Le rimanenti 7 generazioni, composte anatomicamente da dotti alveolari, sacchi alveolari e alveoli,
costituiscono il sistema di scambio. Questo è l'unica sede degli scambi respiratori. La sezione
totale delle vie aeree passa da 2,5 cmq nella trachea a 11.800 cmq negli alveoli, con riduzione
drastica della velocità del flusso polmonare. Ci sono circa 300 milioni di alveoli nell'uomo e l'area
totale delle pareti alveolari in contatto con i capillari in entrambi i polmoni è di circa 70 mq.
Vediamo nel dettaglio la struttura della superficie di scambio, costituita dalla membrana alveolocapillare. Il suo spessore è di circa 0,5 micron, ma in alcuni punti può arrivare addirittura a 0,1
micron.
Essa è costituita da 4 strati, che dall'interno all'esterno sono:
1) velo liquido, trasuda dai capillari – umidifica le cellule e permette la loro sopravvivenza. La
sua presenza causa una tensione superficiale fra aria ed acqua, poiché le molecole d'acqua
tendono a diminuire la superficie di interfaccia. Questo determina una forza che tende a far
collassare l'alveolo.
2) Epitelio alveolare, costituito da tre tipi di cellule:
1. pneumociti di I tipo, molto sottili, che si dispongono sulla superficie alveolare;
2. pneumociti di II tipo, cellule più spesse, caratterizzate dai corpi multilamellari ricchi di
surfattante;
3. macrofagi, con la funzione di fagocitare le sostanze estranee che siano sfuggite al
sistema di conduzione.
3) Membrana basale, sottilissima, costituita dalle membrane basali dell'epitelio e dell'endotelio
fuse assieme
4) Endotelio capillare. Gli alveoli sono circondati da capillari polmonari per l'80-90% della
loro superficie.
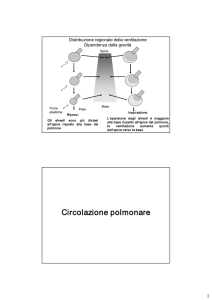
Circolazione polmonare
Non è un circolo distrettuale. Funzioni:
porta il sangue venoso a contatto con gli alveoli
filtra il sangue (blocca e rimuove i piccoli emboli)
metabolizza ormoni vaosattivi (angiotensina I -->angiotensina II; inattivaz.selettiva:
bradichinina, serotonina, alcune prostaglandine)
funzione di serbatoio (volume totale di 500 ml, di cui 70-80 ml nei capillari).
È in serie con il circolo sistemico. Non è un circolo distrettuale. Riceve tutto il sangue pompato dal
cuore destro. I suoi rami decorrono in stretto rapporto con le ramificazioni dell'albero bronchiale,
garantendo un ottimo rapporto ventilazione/perfusione.
È un circolo a bassa pressione, grazie alla bassa resistenza (1/10 di quella sistemica) e elevata
distensibilità dei suoi vasi. Arterie, arteriole e venule sono dotate di scarsa muscolatura liscia. I vasi
del letto capillare sono brevi e formano una lamina quasi continua.
Profilo pressorio:
pressione arteriosa media: 13 mmHg
pressione venosa media:
6,7 mmHg
pressione letto capillare:
10 mmHg (una pressione >25 mmHg causa edema per le forze di Starling)
pressione media atrio destro: 2 mmHg
Resistenze polmonari e gittata cardiaca:
L'aumento della gittata cardiaca – senza un aumento della pressione di spinta – abbassa le resistenze
del circolo polmonare. Ciò avviene per regolazione passiva causata dai fenomeni del reclutamento
capillare e della distensione capillare (che riguarda i capillari già perfusi). In tal modo si minimizza
il carico di lavoro del cuore destro, si mantiene bassa la pressione capillare (prevenzione
dell'edema), la velocità del sangue nei capillari viene mantenuta e aumenta la superficie di scambio.
Resistenze polmonari e volumi polmonari:
Le cicliche variazioni del volume polmonare durante l'atto respiratorio influenzano il calibro dei
vasi alveolari e dei vasi extra-alveolari. Si può affermare che
un'inspirazione diminuisce il calibro dei capillari alveolari (aumento della resistenza) ed
aumenta il calibro dei vasi extra-alveolari (diminuzione della resistenza)
un'espirazione aumenta il calibro dei capillari alveolari (diminuzione della resistenza) e
diminuisce il calibro dei vasi extra-alveolari (aumento della resistenza).
La resistenza totale al flusso risente quindi della variazione della resistenza a livello alveolare ed
extra-alveolare. Il comportamento globale delle resistenze è il seguente: la resistenza è minima per
volumi polmonari intorno al volume corrente, è massima invece al volume residuo (per l'elevata
resistenza dei vasi extra-alveolari) e alla capacità polmonare totale (per l'elevata resistenza dei vasi
alveolari).
Resistenze polmonari e sostanze endogene o farmaci:
Vasocostrittori:
serotonina, catecolamine α-adrenergiche, istamina, leucotrieni, endotelina, angiotensina,
trombossani
Vasodilatatori:
adenosina, catecolamine β-adrenergiche, acetilcolina, prostacicline, bradichinina
Resistenze polmonari e SNA:
Il circolo polmonare possiede una ricca innervazione simpatica, di scarsa importanza.
Resistenze polmonari e PO2:
Ipossia alveolare e ipossiemia venosa causano vasocostrizione delle arteriole polmonari, dirottando
il sangue verso gli alveoli più ventilati. Ipercapnia e acidosi aumentano la vasocostrizione.
Scambio di fluidi nei capillari polmonari:
1) pressione interstiziale del capillare (entrata di liquido)
2) pressione colloido-osmotica 25mmHg (entrata di liquido)
3) tensione superficiale del velo di liquido intralveolare: tende ad abbassare la pressione
interstiziale (tendendo a collassare l'alveolo, facendo staccare l'epitelio dall'endotelio)
4) pressione alveolare: tende ad innalzare la pressione interstiziale
Edema polmonare: presenza di liquido negli alveoli trasudato dal plasma.
Cause:
aumento pressione interstiziale (stenosi mitralica, insufficienza ventricolare sinistra)
aumento tensione superficiale (perdita di surfactant)
diminuzione pressione colloido-osmotica (digiuno, denutrizione)
aumentata permeabilità del capillare (reazioni infiammatorie, danno vascolare polmonare)
Conseguenze:
difficoltà scambi gassosi (ipossia e ipercapnia)
ostruzione piccole vie aeree (aumento resistenza)
riduzione compliance polmonare (aumento lavoro respiratorio)
Circolazione bronchiale
Circuito ad alta resistenza e pressione, i suoi vasi non entrano in contatto con gli alveoli. Funzioni:
distribuire il sangue alle vie di conduzione fino ai bronchioli terminali
riscaldare e umidificare l'aria inspirata
Il flusso è l'1% della gittata cardiaca. Il ritorno venoso è garantito per metà dalle vene bronchiali,
tributarie delle vene azygos, per metà da anastomosi con le vene polmonari: si forma così uno shunt
artero-venoso che contribuisce ad abbassare la PO2 del sangue arterioso.
--Funzioni del sistema di conduzione
1) via di passaggio dell'aria
2) riscaldamento dell'aria esterna alla temperatura corporea
(previene il danneggiamento degli alveoli)
3) aggiunta di vapore acqueo a saturazione
(impedisce la disidratazione dell'epitelio e modifica la composizione dell'aria che raggiunge
gli alveoli. La conseguenza è un abbassamento della pressione parziale dell'ossigeno,
secondo la legge di Dalton: in una miscela gassosa ciascun gas esercita una pressione
parziale proporzionale alla sua concentrazione percentuale
Ptot = PO2 + PCO2 + PN2 + ...
Per cui, essendo la concentrazione dell'acqua a saturazione pari al 6,2% della miscela
gassosa, essa esercita una pressione parziale pari a 760 * 6,2% = 47 mmHg. La pressione
4)
5)
6)
7)
8)
9)
totale effettiva a disposizione dei gas respiratori scende così a 760 – 47 = 713 mmHg e la
PO2 dopo umidificazione diventa di 713 * 20,9% = 149 mmHg con una riduzione di 10
mmHg rispetto a quella ambientale)
filtrazione di materiale estraneo
(grazie alla presenza di cellule ciliate e cellule mucipare caliciformi. Le cellule mucipare
secernono un muco misto che intrappola le particelle estranee e si forma così un nastro
trasportatore fluido – grazie al battito delle cellule ciliate – che dalla trachea e dalla laringe
si dirige verso la faringe)
controllo del flusso aereo
la differenza di pressione necessaria per vincere le resistenze al flusso ( R ) obbedisce alla
formula di Hagen-Poiseuille:
ΔP = F * R
La resistenza dipende da fattori anatomici (calibro dei vasi) e funzionali (tipo di
respirazione).
La respirazione buccale permette di ridurre ad un decimo il gradiente pressorio che è
necessario si stabilisca, con notevole riduzione del lavoro dei muscoli respiratori.
Il controllo della resistenza attraverso i bronchi e i bronchioli è effettuato mediante
variazioni del tono della muscolatura liscia bronchiale.
Il parasimpatico efferente ha un effetto di tipo costrittore attraverso la liberazione del suo
mediatore chimico, l'acetilcolina.
L'ortosimpatico ha invece effetto opposto, broncodilatatore, tramite la liberazione di
noradrenalina (alcuni recettori non innervati possono trovarsi sulle terminazioni
colinergiche, impedendo il rilascio di acetilcolina). Un'ulteriore innervazione - non
colinergica e non adrenergica - che causa broncodilatazione ha come mediatore chimico il
VIP. Anche l'anidride carbonica ha un effetto broncodilatatore: zone iperventilate hanno un
tono bronchiale più elevato, consentendo di aumentare il flusso aereo nelle sedi ipoventilate.
Regolazione della pressione sulla membrana del timpano
Controllo della fonazione
controllo della funzione olfattiva
azione detergente dei seni paranasali
***
Meccanica respiratoria
Affinché un certo volume d'aria si possa muovere è necessario che si sviluppi una differenza di
pressione. Poiché la pressione dell'aria ambientale si mantiene costante, per inspirare ed espirare
sarà necessario realizzare pressioni alveolari negative o positive rispetto alla pressione ambientale.
L'aria si muoverà dal distretto a pressione più alta al distretto con pressione minore ed il flusso
aereo dipenderà dalla differenza di pressione e dalla resistenza secondo la legge di HagenPoiseuille:
F = ΔP / R
dove R dipende da
lunghezza e calibro dei condotti
tipo di respirazione
tipo di flusso
Se:
Pamb – Palv > 0
Pamb – Palv < 0
Pamb – Palv = 0
si ha INSPIRAZIONE
si ha ESPIRAZIONE
NON vi è FLUSSO
Le variazioni della Palv rispetto alla Pamb si realizzano fisiologicamente mediante variazioni della
capacità polmonare. Infatti, per la legge di Boyle
p*V=k
se aumenta il volume a disposizione dei gas respiratori, la pressione si deve ridurre (inspirazione);
l'inverso accade invece nell'espirazione.
Il volume polmonare viene modificato variando il volume della gabbia toracica. Il volume del
torace a sua volta viene modificato grazie all'azione del muscoli respiratori.
Cavità pleurica: i polmoni sono separati dalla superficie interna del torace e da quella toracica del
diaframma da due foglietti pleurici: la pleura viscerale e la pleura parietale. Le due pleure si
continuano l'una nell'altra, per cui delimitano una cavità chiusa. Tale cavità, praticamente virtuale, è
occupata da un sottilissimo velo liquido, il liquido pleurico.
Il liquido pleurico permette il reciproco scivolamento fra le due pleure e il trascinamento del
polmone da parte del torace. Esso ha un volume di 3-4 ml ed una composizione simile al plasma
(con minor concentrazione proteica). Viene prodotto per filtrazione a livello della pleura parietale;
le proteine non attraversano l'endotelio capillare – da cui la minor concentrazione proteica.
Il processo di filtrazione è descritto dalla legge di Starling, che prende in considerazione la
pressione oncotica e la pressione idrostatica, descrivendo il flusso tra l'interstizio pleurico ed il cavo
pleurico.
Il ricambio totale avviene in 10 ore circa, grazie al riassorbimento effettuato in larga parte dagli
stomi linfatici che si aprono direttamente a livello della cavità pleurica e comunicano con un'estesa
rete di lacune linfatiche sottomesoteliali. Questo è anche il principale meccanismo di controllo del
volume del liquido pleurico, poiché il flusso è direttamente proporzionale al volume del liquido
pleurico. Ogni aumento di filtrazione è dunque controbilanciato da un aumento di drenaggio,
mentre quando il volume è ridotto al minimo il flusso linfatico si arresta. La condizione di
idrotorace si presenta solo nel caso in cui la funzione pleurica sia danneggiata.
La pressione intrapleurica o pressione di Donders è negativa rispetto a quella atmosferica, di 3
mmHg a riposo e di 6 mmHg al termine dell'inspirazione. La pressione è negativa poiché polmone e
torace hanno un volume diverso dal volume di equilibrio: il torace tende all'espansione, mentre il
polmone tende al collasso e la pressione pleurica diventa negativa. In caso di patologia o traumi si
può avere la condizione di pneumotorace: se entrano in contatto la cavità pleurica e il sistema di
conduzione (pneumotorace interno) o la cavità pleurica e l'ambiente esterno (pneumotorace esterno)
il polmone collassa e il torace si espande assumendo la tipica forma a botte. Prima dell'avvento
degli antibiotici il pneumotorace era utilizzato per la cura della tubercolosi (per ridurre l'apporto di
ossigeno al battere).
--Sequenza di eventi alla base dell'ingresso e dell'uscita d'aria dai polmoni
1) i mm. inspiratori si contraggono
2) la cavità toracica si espande (trascina il polmone e lo distende)
3) la pressione endopleurica diventa più negativa perchè la pressione sulla superficie esterna
del polmone diminuisce (maggiore tendenza a separare i due foglietti pleurici)
4) i polmoni si espandono (comportamento passivo: sono i muscoli respiratori a contrarsi)
5) la pressione alveolare diventa subatmosferica per la legge di Boyle
6) l'aria entra nei polmoni finchè la pressione alveolare non eguaglia la Patm
nota: il polmone non è in grado di cambiare il proprio volume come il cuore, perché un organo
deputato allo scambio di gas non è compatibile con una parete muscolare
Muscoli respiratori:
inspiratori
diaframma
scaleni
intercartilaginei parasternali
sternocleidomastoidei (inspirazione forzata)
intercostali esterni (inspirazione forzata)
espiratori
addominali (espirazione forzata)
intercostali interni (espirazione forzata)
L'espirazione tranquilla è un processo passivo: la forza retroattiva del polmone è più grande di
quella espansiva del torace alla fine dell'inspirazione
Movimenti del torace:
1) spostamento del diaframma: il diaframma si contrae e la sua cupola si sposta verso il basso
con un'escursione di 1.2 cm nell'inspirazione tranquilla e fino a 10 cm durante l'esercizio
fisico. Lo spostamento del diaframma modifica l'altezza della cassa toracica con un aumento
di volume che è di circa 300 cc (2500 cc durante esercizio). Durante la respirazione
tranquilla oltre il 60% di variazione di volume può essere attribuito alla sola contrazione del
diaframma.
2) Variazione dell'inclinazione del piano costale: i muscoli intercostali esterni, facendo perno
sulle vertebre, modificano l'inclinazione del piano costale in senso più orizzontale. Si ottiene
così un aumento del diametro antero-posteriore del torace.
3) Spostamento laterale delle coste: le coste ruotano lateralmente, facendo fulcro sulle faccette
costo-vertebrali, descrivendo il cosiddetto “movimento a manico di secchio”: aumenta il
diametro trasverso del torace.
Variazioni della pressione intrapleurica e intrapolmonare (alveolare)
Come già detto, la pressione intrapleurica è di circa -2,5 mmHg a riposo e di -6 mmHg al termine
dell'inspirazione. L'esercizio fisico modifica notevolmente questi valori, portando la pressione
intrapleurica fino a -30 mmHg al termine di un atto inspiratorio.
Per la legge di Hagen-Poiseuille, affinché una certa quantità d'aria possa entrare all'interno del
pomone è necessaria una differenza di pressione, tra l'interno del polmone stesso e l'ambiente.
La pressione che si registra all'interno del polmone prende il nome di pressione intrapolmonare (o
alveolare).
In eupnea la Palv:
assume valore zero:
prima che inizi l'inspirazione
al termine dell'inspirazione
al termine dell'espirazione
è negativa (- 1 mmHg) durante l'inspirazione
è positiva ( + 1 mmHg) durante l'espirazione
in eupnea la durata dell'inspirazione è leggermente minore della durata dell'espirazione, per cui il
flusso (flusso = volume / tempo) inspiratorio è leggermente maggiore. Di conseguenza anche la
differenza di pressione che si deve instaurare per creare quel flusso sarà maggiore in valore assoluto
rispetto all'espirazione.
---
Volumi e capacità polmonari e loro misura
Lo strumento necessario per misurare i volumi e le capacità polmonari è lo spirometro. Esso
consiste di una campana cilindrica, graduata, mobile e molto leggera, munita di un pennino che
scrive su carta applicata ad un dispositivo rotante a velocità controllata.
La campana cilindrica si muove in un serbatoio pieno d'acqua (serve a isolare i gas respirati
dall'ambiente esterno). Un sistema di tubi a grossa sezione (e quindi a bassa resistenza), una pinza
nasale e un boccaglio per connettere l'apparato respiratorio del soggetto con l'interno della campana
completano l'apparecchio. Quando il soggetto inspira, la campana si sposta verso il basso ed il
pennino verso l'alto; viceversa durante l'espirazione.
Volumi statici del pomone:
l'aria contenuta nei polmoni può essere suddivisa in quattro differenti volumi:
1) volume corrente VC
2) volume di riserva inspiratoria VRI
3) volume di riserva espiratoria VRE
4) volume residuo VR
Il volume corrente è il volume d'aria che il soggetto inspira o espira ad ogni atto respiratorio.
Generalmente ammonta a 0.5 litri e comprende l'aria che entra negli alveoli (0.35 l) e l'aria che
rimane nel sistema di conduzione (0.15 l)
Il volume di riserva inspiratoria è il volume che un soggetto può introdurre con una inspirazione
forzata al termine di una inspirazione tranquilla. Ammonta a circa 2 – 3 litri in un soggetto normale
adulto.
Il volume di riserva espiratoria è il volume che un soggetto può espirare con una espirazione
forzata al termine di una espirazione tranquilla. Nell'adulto normale ammonta a circa 1 – 1,5 litri.
Il volume residuo è il volume d'aria che resta all'interno dei polmoni dopo una espirazione forzata.
Si forma alla nascita con il primo atto inspiratorio e dipende dalle forze elastiche del polmone e del
torace, dalla forza delle muscolatura espiratoria e dalle strutture mediastiniche. Esso ammonta a
circa 1 litro.
La somma di due o più volumi prende il nome di capacità. La capacità polmonare totale CPT è la
somma dei quattro volumi pomonari:
CPT = VRI + VC + VRE + VR
La capacità vitale indica invece la somma di volume corrente, volume di riserva inspiratoria e
volume di riserva espiratoria.
CV = VRI + VC + VRE
La capacità inspiratoria è pari a:
CI = VRI + VC
La capacità funzionale residua è pari a:
CFR = VR + VRE
Mentre i volumi della capacità vitale possono essere misurati direttamente con lo spirometro, per la
misura del volume residuo bisogna ricorrere ad un metodo indiretto: il metodo della diluizione di un
gas inerte.
Il gas adoperato
non deve essere tossico
deve essere facilmente misurabile
deve potersi mescolare facilmente con gli altri gas respiratori contenuti nel polmone
deve superare la membrana alveolo capillare
non deve essere metabolizzato dal tessuto polmonare
un gas che presenta tali caratteristiche è l'elio.
Si fa respirare al soggetto una miscela di elio a concentrazione nota, contenuta in uno spirometro.
Calcolando la concentrazione finale di elio sarà possibile determinare il VR. Infatti:
la quantità iniziale è pari a
Qi = Vi * Ci
la quantità finale è pari a
Qf = (Vi + Vp) * Cf
poiché l'elio non può attraversare le membrana alveolo capillare, la quantità rimarrà costante (Qf =
Qi), per cui eguagliando le due precedenti equazioni si ottiene
Vp = Vi (Ci – Cf) / Cf
ed essendo il valore di Vp pari a
Vp= VC + VRE + VR
è facile ricavare il valore di VR, poiché VRE e VC sono misurabili direttamente.
In clinica vengono utilizzati i cosiddetti volumi dinamici. Il più importante di questi è il volume
espirato massimo in un secondo (VEMS) o FEV1 (forced expiratory volume in 1 second). Si tratta
a rigore di un flusso, poiché indica un volume su un tempo. Per misurarlo si richiede al soggetto di
effettuare la manovra di Tiffenau, ossia una espirazione forzata, alla massima velocità possibile,
dopo un'inspirazione massimale. Il volume d'aria espirato viene di solito confrontato con la capacità
vitale per normalizzare i dati: il VEMS è circa l'80-90% della CV in condizioni fisiologiche.
Tale misura serve a valutare l'ostruzione delle vie aeree, per cui in caso di patologie ostruttive quali
l'asma, la capacità vitale può essere normale, mentre il VEMS, notevolmente ridotto (frutto di
un'aumentata resistenza).
Il sistema polmone torace come corpo elastico
La curva pressione-volume in rilasciamento del sistema toraco-polmonare permette di calcolare la
compliance (distensibilità) e il lavoro polmonare. Si tratta di una curva passiva e statica (aria ferma,
nessuna contrazione muscolare).
Per ricavarla si utilizzano:
uno spirometro, che permette di valutare il volume inspirato o espirato
un manometro
un rubinetto a tre vie, che consente di connettere i pomoni alternativamente alla pompa o al
manometro.
Si richiede quindi al soggetto di inspirare quantità d'aria sempre maggiori e di rilasciare i muscoli
respiratori, a bocca e glottide aperta. Con il manometro si calcolano le pressioni raggiunte e le si
inseriscono in un grafico assieme ai relativi volumi:
Si ottiene così la curva pressione volume del sistema toraco-polmonare. Essa permette di calcolare
la compliance del sistema, ossia la variazione di volume alla variazione di pressione unitaria (1
mmHg) in un corpo elastico. Maggiore è la compliance minore sarà il lavoro respiratorio, e
viceversa.
Dalla analisi della curva si nota che:
al volume della CFR il sistema torace-polmone è all'equilibrio: Pamb = Palv
al di sopra di questo volume il sistema tende a spingere fuori l'aria (con una leggera pressione se
V = CV, una pressione maggiore se V = CPT)
al di sotto di questo volume il sistema tende ad espandersi
la compliance è diversa a seconda dell'intervallo di volumi in cui la misura viene effettuata: la
compliance è massima ai volumi intermedi, mentre diminuisce a volumi alti e bassi. La normale
respirazione richiede quindi un lavoro minore, perché avviene nell'intervallo ottimale di volumi.
(Una congestione polmonare provoca diminuzione della compliance, mentre l'enfisema è
caratterizzato da un aumento.)
Curva di rilasciamento del polmone:
per conoscere quale sia il contributo di ciascuna delle due componenti (polmone e torace) occorre
fare un'ulteriore rilevazione sperimentale; occorre valutare la curva in rilasciamento del polmone da
solo, cioè senza il contributo del torace. Infatti, conoscendo la curva elastica delle due componenti
assieme (T + P) e quella del solo polmone (P) dalla loro differenza si potrà ricavare anche quella del
torace.
Per costruire la curva del polmone è necessario ricavare i seguenti parametri:
pressione generata dal polmone, pari a Palv – Pintrapleurica
volume del polmone
Il volume del polmone è misurabile direttamente con uno spirometro, mentre la pressione
intrapleurica può essere calcolata con due differenti metodiche. La metodica cruenta consiste
nell'inserire nello spazio pleurico un ago collegato ad un manometro; la metodica incruenta si
avvale invece di un palloncino esofageo, che misura le pressioni esofagee, molto vicine a quelle
pleuriche.
Con le medesime procedure per la costruzione della curva polmone torace in rilasciamento se ne
può costruire una della sola componente polmonare. Da tale curva possiamo ricavare che il
polmone in condizioni fisiologiche è sempre al di sopra del suo volume di equilibrio, per cui:
tende a collassare: genera pressioni positive;
tende a spingere fuori l'aria;
tende ad un volume di equilibrio minore del volume residuo.
Conoscendo la curva del polmone e la curva del sistema toraco-polmonare è possibile ricavare per
semplice differenza la curva del torace in rilasciamento, dalla cui analisi osserviamo che :
il torace è all'equilibrio al 75% della CV;
sotto tale volume tende ad espandersi, generando pressioni negative;
sopra tale volume tende a collassare, generando pressioni positive.
Inoltre è da notare come alla CFR, volume di equilibrio del sistema toraco-polmonare, la tendenza
del torace ad espandersi sia perfettamente controbilanciata dalla tendenza del polmone a collassare.
Relazione tensione lunghezza dei muscoli respiratori (curve dei massimi e minimi respiratori):
In generale, quanto maggiore è la lunghezza iniziale di un muscolo, tanto maggiore sarà la forza che
è in grado di sviluppare. Il sistema toraco-polmonare è costituito in modo tale che quando i polmoni
si riempiono, la muscolatura inspiratoria si accorcia – mentre la muscolatura espiratoria si allunga.
Viceversa, quando i polmoni si svuotano, la muscolatura espiratoria si accorcia e quella inspiratoria
si allunga. Pertanto la muscolatura inspiratoria potrà sviluppare la sua massima forza al termine di
una espirazione massimale e viceversa, la muscolatura espiratoria potrà sviluppare la sua massima
forza al termine di una inspirazione forzata.
Mediante alcune manovre sperimentali è possibile misurare la curva tensione lunghezza della
muscolatura inspiratoria ed espiratoria dell'uomo. Per costruire la curva dei massimi e dei minimi
respiratori si necessita di uno spirometro, un manometro e un rubinetto a tre vie.
Si richiede al soggetto di effettuare la manovra di Valsalva: un'inspirazione massimale, seguita da
una manovra espiratoria forzata. Con il manometro si misura la pressione alveolare raggiunta: il
volume polmonare non cambia in maniera rilevante, mentre aumenta notevolmente la pressione in
seguito alla manovra espiratoria. Selezionando volumi via via minori con lo spirometro, si
otterranno pressioni pressioni sempre più piccole, fino ad arrivare ad una pressione pari a 0 per un
volume pari al solo VR.
Stesso tipo di studio può essere effettuato sulla muscolatura inspiratoria tramite la manovra di
Müller. Si richiede al soggetto di espirare profondamente, si collega il boccaglio con il manometro
e si richiede di effettuare un'inspirazione forzata. Il risultato sarà un brusco abbassamento della
pressione alveolare.
Riportando i dati ottenuti in un grafico si ottiene la curva seguente:
Dall'analisi del grafico si nota che:
alla CPT la forza dei muscoli inspiratori è pari a 0, la forza dei muscoli espiratori è pari a 100120 mmHg
al VR la forza dei muscoli inspiratori è pari a 80-100 mmHg, la forza dei muscoli espiratori è
pari a 0
a volumi intermedi, maggiore è il volume, maggiore è la forza dei muscoli espiratori, minore la
forza dei inspiratori.
Bisogna tuttavia notare che questa pressione misurata, è dovuta in parte alla forza elastica generata
dal sistema toraco-polmonare. Pertanto il reale effetto dell'azione muscolare va ricavato sottraendo
algebricamente il contributo di torace e polmone, riportato nella curva delle pressioni in
rilasciamento toraco-polmonare.
Da notare che da questa curva si può calcolare anche la capacità lavorativa della muscolatura
respiratoria, perché il prodotto di una pressione (forza / superficie) per un volume determina un
lavoro (forza * spostamento).
---
Caratteristiche meccaniche del polmone isolato
Rimuovendo i polmoni dal corpo e insufflandoli con aria o soluzione salina è possibile studiare le
caratteristiche meccaniche del polmone isolato. Si tratta di creare una curva pressione volume per il
polmone: bisogna ricavare le relazioni esistenti fra volume d'aria contenuto nel polmone e pressione
che è necessario applicare per raggiungere il volume desiderato.
Il grafico che si ottiene è il seguente
Dalla figura si nota subito che:
riempendo il polmone con aria si ottiene un ansa di isteresi: a parità di pressione applicata il
volume d'aria è maggiore nel ciclo di desuflazione
riempendo il polmone con una soluzione salina non si ha l'ansa d'isteresi, e a parità di volume si
necessita una pressione minore rispetto all'aria.
Quindi:
la compliance con soluzione salina è maggiore della compliance con aria. L'aria deve vincere infatti
anche la tensione superficiale, a differenza della soluzione salina che elimina l'interfaccia aria-acqua.
La forza retrattile del polmone è generata per la maggior parte dalla tensione superficiale. La tensione
superficiale è maggiore di quella elastica.
La tensione superficiale è minore di quanto ci si aspetti per un'interfaccia aria-acqua delle dimensioni
della membrana alveolo-capillare. Deve esistere qualcosa che la abbassi ( si tratta del surfattante)
la tensione superficiale presente nel polmone è maggiore a volumi grandi che a volumi piccoli ( a volumi
grandi la concentrazione di surfattante è minore)
la curva con aria presenta un'ansa di isteresi per i seguenti motivi:
reclutamento alveolare: nell'espansione alveolare vengono reclutati gli alveoli più grandi e
successivamente quelli più piccoli. Il polmone si comporta come se non fosse lo stesso
corpo elastico durante il ciclo respiratorio.
Viscosità tissutale: forza che si manifesta all'allungamento di un tessuto biologico, per cui la
pressione inizialmente raggiunta decade in maniera progressiva ed esponenziale.
Elasticità tissutale: gli alveoli si comportano come strutture elastiche, per cui quanto
maggiore è l'aumento di volume ΔV, tanto maggiore sarà la forza di reazione elastica ΔP
che tende a riportarli alle dimensioni originarie. Tuttavia gli alveoli non sono dei corpi
elastici perfetti, per cui questa relazione non è lineare come nella legge di Hooke.
Presenza di surfattante: responsabile principale dell'ansa di isteresi. La concentrazione di
surfattante, in realtà non è uguale durante l'insuflazione e la desuflazione. Durante la
desuflazione, infatti, la concentrazione di surfattante aumenta, ma una parte di esso non si
trova più in superficie, dispersosi in profondità sotto forma di micelle. Quando il polmone
riprende ad espandersi, la parte di surfattante che è stata momentaneamente allontanata fa
aumentare la tensione superficiale. Tutto il surfattante ritorna in superficie solo alla massima
espansione polmonare.
Il surfattante è un agente tensioattivo prodotto dagli pneumociti di II tipo dell'epitelio alveolare. I
tipici corpi multilamellari, organuli avvolti da membrana – contenenti spire di fosfolipidi, sono
formati in queste cellule e secreti nel lume alveolare per esocitosi. Il surfattante è costituito per il
62% da dipalmitoilfosfatidilcolina: due code di palmitato ed una colina unite ad una molecola di
glicerolo. Le due code di palmitato formano la testa apolare della molecola e si dispongono verso il
gas respiratorio; la colina, unita al glicerolo grazie al gruppo fosfato, si dispone verso la superficie
liquida.
Azioni del surfattante:
1) abbassa la tensione superficiale all'interfaccia aria-acqua
2) abbassa la tensione superficiale in modo inversamente proporzionale all'ampiezza
3) agisce in maniera meno efficace durante la insuflazione
La presenza del surfattante è fondamentale per il mantenimento dell'equilibrio tra alveoli grandi ed
alveoli piccoli. Secondo la legge di Laplace
ΔP=2T/r
la pressione distendente è inversamente proporzionale al raggio. Se la tensione superficiale rimane
costante, gli alveoli piccoli avranno una pressione maggiore. Si crea così un gradiente di pressione
per cui tutta l'aria viene presa dagli alveoli più grandi a pressione minore. La presenza del
surfattante scongiura questo evento, poiché la concentrazione del surfattante è maggiore negli
alveoli più piccoli, in modo da abbassare la tensione superficiale proporzionalmente al raggio. Si
crea così un equilibrio fra gli alveoli più grandi e quelli più piccoli.
---
Lavoro respiratorio
In fisiologia, il lavoro per la respirazione è determinato dal prodotto di una pressione per un
volume:
L=P*V
ma i fattori che collaborano a determinarlo sono tre in totale, distinguibili in:
1) lavoro di tipo elastico
2) lavoro di tipo dinamico
3) lavoro di tipo viscoso
Il lavoro di tipo elastico costituisce il 65% del lavoro totale. È il lavoro svolto per vincere le
resistenze elastiche alla distensione del sistema toraco-polmonare, insieme alla tensione
superficiale.
Oltre al lavoro elastico la muscolatura respiratoria deve vincere la resistenza R che l'aria incontra
nel passare attraverso il sistema di conduzione: cioè la resistenza al flusso aereo, che è tanto più
elevata quanto maggiore è la velocità del flusso.
Bisogna inoltre aggiungere la resistenza viscosa presente nei tessuti, quella cioè che i lobi
polmonari – variando il loro volume – incontrano nello scivolare contro i foglietti pleurici. Non è
molto elevata in eupnea (circa 7% del lavoro respiratorio), ma va tenuta comunque in
considerazione.
Il lavoro elastico può essere calcolato conoscendo la curva di rilasciamento toraco-polmonare:
Il lavoro è indicato graficamente dall'area ABC. Per introdurre il VC il lavoro viene compiuto solo
durante l'inspirazione: durante l'espirazione (tratto AB) si ha un ritorno passivo delle strutture
elastiche. Dalla figura è inoltre evidente che
un aumento della compliance diminuisce il lavoro elastico. Per ottenere un volume pari è infatti
necessario sviluppare una ΔP minore (l'area ABC diminuisce)
una riduzione della compliance aumenta il lavoro elastico, viceversa. Ciò accade ad esempio
nella fibrosi polmonare o nelle malattie di tipo restrittivo
un'inspirazione forzata provoca un aumento notevole del lavoro elastico
un'espirazione forzata richiede lavoro elastico. L'inspirazione che ne segue per ritornare alla
posizione di equilibrio sarà passiva per ritorno elastico.
Per calcolare lavoro dinamico e viscoso è necessario costruire una curva pressione volume
dinamica durante l'inspirazione:
La resistenza di attrito ai movimenti dell'aria fa sì che i cambiamenti della pressione intrapleurica
precedano le variazioni del volume polmonare. L'area AXBA rappresenta il lavoro fatto per vincere
la resistenza delle vie aeree e la viscosità dei polmoni.
Bisogna ricordare che il flusso aereo turbolento richiede una quantità di energia superiore. Durante
la respirazione normale solo parte del flusso è turbolento.
Il lavoro è influenzato dalla compliance toraco polmonare e condizioni patologiche che la alterano
portano alle seguenti modifiche:
la congestione polmonare e la fibrosi interstiziale dei polmoni fanno diminuire la compliance,
causando un AUMENTO DEL LAVORO
l'enfisema causa un aumento della compliance, con DIMINUZIONE DEL LAVORO.
Per quanto riguarda il costo energetico del lavoro respiratorio, esso può essere calcolato grazie al
consumo di ossigeno dei muscoli respiratori. A riposo i mm. respiratori consumano l'1% circa
dell'ossigeno utilizzato dal corpo. Questa percentuale sale di poco durante l'esercizio fisico: si arriva
al 3%. Durante l'iperventilazione volontaria si può arrivare fino al 30%.
Si calcola che il rendimento energetico dei muscoli respiratori sia molto basso (10% contro un
20% della muscolatura scheletrica).
A parità di ventilazione alveolare, il lavoro respiratorio può cambiare: alta frequenza e basso
volume corrente causano un aumento del lavoro elastico; viceversa una frequenza respiratoria bassa
e un volume corrente elevato causa un aumento del lavoro dinamico per aumento della resistenza
all'aria.
***
Scambi gassosi
Pressioni parziali dei gas
Secondo la legge di Dalton, in una miscela di gas, ciascun gas esercita una pressione parziale
proporzionale alla sua concentrazione percentuale. Conoscendo quindi le percentuali dei gas
contenuti nell'aria ambientale è possibile ricavare le loro pressioni parziali:
gas
%
mmHg
N2
78
593
O2
21
159
CO2
0.03
0.3
argon
0.9
7
gas
%
mmHg
neon
0.002
0.02
elio
0.0005
0.004
In altitudine, la composizione percentuale rimane identica, tuttavia le pressioni parziali
diminuiscono, poiché la pressione ambientale si riduce. A 2000 m la pressione parziale
dell'ossigeno scende a 120 mmHg, senza che tale modifica venga avvertita dall'organismo. A 10000
m, la pressione ambientale scende a circa 198 mmHg e la pressione parziale dell'ossigeno è di circa
40 mmHg – misura non compatibile con la vita.
Nei passaggi dall'aria ambientale fino ai tessuti, la miscela gassosa respiratoria subisce notevoli
modificazioni nella pressione parziale che i gas sono in grado di esercitare in essa:
distretto
O2
CO2
N2
H2 O
Aria inspirata
160
0,3
600
0
Aria tracheale
150
0,3
563
47
Area alveolare
100
40
573
47
Aria espirata
116
28
569
47
Sangue arterioso
100
40
573
47
Tessuti
40
46
573
47
Analizziamo ora le varie modifiche distretto per distretto:
Aria ambientale-aria tracheale:
L'aria viene saturata di vapor acqueo, con una significativa riduzione delle pressioni parziali di
azoto (da 600 a 563) ed ossigeno (da 160 a 150). La pressione parziale dell'anidride carbonica, già
molto bassa non viene influenzata significativamente.
Aria tracheale-aria alveolare:
Il volume dell'aria alveolare coincide, al termine di un'espirazione tranquilla, alla CFR: 2-2,5 l. A
livello degli alveoli l'aria viene continuamente arricchita di anidride carbonica e impoverita di
ossigeno. L'aria che viene immessa ad ogni ciclo respiratorio (350 ml, pari ad 1/7 della CFR), fa
variare di poco le pressioni parziali dei gas, che sono di 40 mmHg per l'anidride carbonica, e di 100
mmHg per l'ossigeno. L'aria alveolare ha un notevole effetto volano sulle pressioni parziali dei gas:
le escursioni sono nell'ordine dei 2-3 mmHg a riposo e di 4-5 mmHg sotto sforzo.
Aria alveolare-aria espirata:
L'aria espirata contiene, a riposo, per circa un terzo del suo volume (150 ml) aria proveniente dal
sistema di conduzione (aria tracheale). È pertanto logico aspettarsi che l'aria espirata si riavvicini ai
valori pressori dell'aria ambientale: aumentano le pressioni parziali di azoto e ossigeno, diminuisce
quella dell'anidride carbonica.
Aria alveolare- sangue arterioso:
Il valore della pressione parziale dell'anidride carbonica è uguale per il sangue arterioso e per l'aria
alveolare.
La pressione parziale dell'ossigeno invece presenta dei valori diversi: 100 mmHg per l'aria
alveolare, 95 mmHg per il sangue arterioso. Questa discrepanza è dovuta allo shunt fisiologico: una
parte di sangue venoso raggiunge le cavità cardiache di sinistra. Questo sangue proviene da alveoli
poco ventilati, dalle vene di Tebesio, dal circolo refluo bronchiale ed ha l'effetto di abbassare la
pressione parziale dell'ossigeno nel sangue arterioso.
In caso di attività muscolare questa differenza si assottiglia. L'esercizio fisico porta ad un
miglioramento della ventilazione, per cui vengono perfusi anche alveoli che normalmente non lo
sono: la pressione parziale dell'ossigeno può così aumentare.
Sangue arterioso-tessuti-sangue venoso:
Vi sono notevoli differenze fra le pressioni parziali dei gas a livello del sangue arterioso e dei
tessuti. I tessuti infatti utilizzano ossigeno e producono anidride carbonica a seconda delle loro
esigenze metaboliche. Ogni tessuto utilizza una quantità di ossigeno (e rilascia una quantità di
anidride carbonica) variabile per cui le pressioni parziali dei gas a livello del sangue venoso variano
da distretto a distretto. Effettuando un prelievo venoso a livello dell'arteria polmonare è possibile
però calcolare i valori pressori medi per il sangue venoso misto: la pressione parziale dell'ossigeno
scende a 40 mmHg e la pressione parziale dell'anidride carbonica sale a 46 mmHg.
---
Scambio gassoso a livello alveolo-capillare
Il processi di scambio dei gas respiratori, tra aria alveolare e sangue venoso, obbedisce alle leggi
della diffusione passiva e pertanto dipende dalle
caratteristiche della membrana alveolo capillare
caratteristiche dei gas che si devono scambiare
Le caratteristiche della membrana alveolo-capillare sono rappresentate essenzialmente da
spessore della membrana. È dell'ordine di 0,5 – 1 micron in condizioni fisiologiche (in caso di
fibrosi, edema interstiziale, edema alveolare può aumentare notevolmente). Concorrono a
formare lo spessore della membrana:
tensioattivo polmonare
epitelio alveolare
liquido interstiziale
endotelio capillare
superficie di scambio. Non si tratta della semplice superficie della membrana, poiché bisogna
escludere le zone ventilate ma poco perfuse. Tale superficie si estende per 70-100 mq.
I gas respiratori che si scambiano a livello alveolare passano attraverso due fasi distinte: una fase
gassosa (aria alveolare) ed una fase liquida (membrana alveolo-capillare e sangue). Le
caratteristiche dei gas respiratori sono descritte da due leggi differenti: la legge di Graham e la legge
di Henry.
Legge di Graham (riguarda la velocità di diffusione di un gas in una miscela gassosa)
la pressione che un gas esercita in una miscela gassosa è data dall'energia cinetica delle sue
molecole, cioè da
P = 1 / 2 m v²
dove m è il peso molecolare del gas e v è la velocità con cui si muovono le molecole di gas nella
miscela gassosa. Tale espressione può anche essere riscritta nella forma
2p
v=
m
la velocità di una molecola di gas è inversamente proporzionale alla radice quadrata del suo peso
molecolare. Ciò spiega perché l'ossigeno (PM: 32) si muove meglio dell'anidride carbonica (PM:44)
all'interno dello spazio alveolare.
A causa della legge di Graham deriva anche la considerazione che a seguito di un arresto
respiratorio è più semplice rifornire di ossigeno l'aria alveolare, che asportare l'anidride carbonica
che lì si produce.
Legge di Henry
la quantità di gas che si scioglie fisicamente in un liquido (e che quindi non si lega chimicamente
con esso) dipende dalla pressione parziale del gas
Q=KP
dove K è il coefficiente di solubilità del gas nel liquido.
KO2 = 0,00244 ml/100 ml sangue/ mmHg
KCO2 = 0,0592
KN2 = 0,00155
pertanto alle pressioni parziali esistenti in vivo, i gas fisicamente disciolti nel sangue sono:
0,3 ml O2 / 100 ml di sangue (con PO2 = 100 mmHg)
3,0 ml CO2 / 100 ml di sangue (con PCO2 = 46 mmHg)
0,8 ml N2 / 100 ml di sangue (con PN2 = 573 mmHg)
In condizioni fisiologiche la CO2 si scioglie 20 volte meglio dell'O2: l'ossigeno infatti si muove
meglio attraverso la membrana alveolo capillare, ma la CO2 si scioglie più rapidamente.
La diffusione polmonare per l'O2 è indicata da numero-indice DLO2. La diffusione di O2
ubbidisce alla legge di Fick, per cui la DLO2 si può dedurre dalla legge di Fick:
Vgas = A * D (P1-P2) / T
Vgas: volume che passa in un minuto (flusso)
A: area della lamina
T: spessore della lamina
D: costante di diffusione (solubilità / PM)
Se con DL indichiamo A*D/T, avremo:
DLO2 = Vossigeno / PO2 alv - PO2 sangue
Sostituendo i valori dell'ossigeno consumato al minuto (240 ml) e della differenza di pressione
parziale di O2 fra aria alveolare e sangue (60 mmHg), otteniamo una DLO2 di 4 ml O2 / min *
mmHg (come si vede la DLO2 ha le dimensioni dell'inverso di una resistenza, ossia di una
conduttanza).
In realtà la DLO2 calcolata sperimentalmente è di circa 20 – 30 ml / min * mmHg. La differenza fra
il valore attenuto applicando la formula e quello osservato è data da:
ΔP fra il distretto alveolare e capillare, che varia da un valore iniziale di 60 mmHg per arrivare a
0 dopo soli 0,25 s. la media integrata è di 15 mmHg.
il tempo di transito è di circa 0.75 s, e quindi va moltiplicato per il complemento 4/3, per
ottenere il valore corretto per l'unità di tempo.
In caso di esercizio fisico il valore della DLO2 può salire fino a 65 ml / min * mmHg, a causa
dell'aumentata superficie di scambio
dell'aumento del flusso ematico nel pomone (è sfruttata tutta la lunghezza del capillare
polmonare)
In caso di fibrosi polmonare la DLO2 diminuisce per la ridotta superficie di scambio.
--Trasporto dell'O2
Alla pressione parziale dell'O2 esistente nell'aria alveolare la quantità totale di O2 che si può estrarre
da 100 ml di sangue normale ossigenato ammonta a circa 20 ml.
Questa quantità può essere distinta in due frazioni:
frazione fisicamente disciolta (0,3 ml O2 /100 ml sangue)
frazione legata all'emoglobina (19,5 ml / 100 ml sangue)
La frazione fisicamente disciolta dipende – secondo quanto stabilito dalla legge di Henry – dalla
pressione parziale e dal coefficiente di solubilità dell'ossigeno.
La quantità trasportata fisicamente disciolta, non è sufficiente. Il sangue venoso, che ha una
pressione di 40 mmHg contiene disciolti 0,12 ml di O2 per ogni 100 ml di sangue. La quantità
trasportata è quindi di 0,3 - 0,18 = 0,18 ml O2 per 100 ml di sangue, incompatibile con lo
svolgimento dei processi metabolici vitali.
La frazione legata all'emoglobina dipende da tre fattori:
a) concentrazione del'Hb nel sangue
b) PO2 cui il sangue è esposto a livello alveolare
c) affinità dell'Hb per l'O2
L'emoglobina è una molecola globulare, costituita da quattro monomeri. Questo sono formati a loro
volta da un gruppo eme ed una catena polipeptidica (alfa, beta, delta). L'eme è un complesso
costituito da una porfirina e da un atomo di ferro ferroso. Ciascuno dei 4 atomi di ferro può legare
reversibilmente una molecola di O2. Il ferro resta bivalente (poiché l'O2 si lega con legame di
coordinazione e non di valenza) per cui la reazione costituisce una ossigenazione, non una
ossidazione.
Un grammo di emoglobina contiene in vivo 1,34 ml di O2. La concentrazione dell'Hb nell'uomo è di
15 g / 100 ml di sangue (14 g / 100 ml nella donna) ad una PO2 di 100 mmHg (aria alveolare).
La quantità di ossigeno trasportata dall'emoglobina è quindi di 1,34 ml / g * 15 g / 100 ml = 20 ml
di ossigeno trasportato per 100 ml di sangue.
La quantità ceduta ai tessuti è data dalla differenza artero-venosa del contenuto di ossigeno
nell'emoglobina: 20 ml O2 /100ml di sangue arterioso – 15 ml O2 /100 ml di sangue venoso = 5 ml
di O2 vengono ceduti ai tessuti.
Il consumo di ossigeno a riposo è di 250 ml/min. Il cuore ne consuma 11,4, il cervello 6,2, la cute 2,5.
La struttura quaternaria dell'Hb determina la sua affinità per l'O2. Quando l'emoglobina capta O2 le
due catene β si muovono l'una verso l'altra; quando O2 è ceduto, esse si allontanano. Il movimento
delle catene è associato ad una modificazione nella posizione dei gruppi eme, che - captando O2 passano da uno stato T (teso, ridotta affinità per O2) ad uno stato R (rilasciato, maggiore affinità per
l'O2).
La curva di dissociazione dell'ossiemoglobina – che mostra la percentuale di saturazione in O2
dell'emoglobina in funzione di PO2 – ha una caratteristica forma sigmoidale (a S italica).
Questo perché la molecola modifica la propria affinità per l'O2. Infatti, quando il primo eme capta
O2, viene favorito lo stato R in un secondo eme, che capta O2 e a sua volta l'ossigenazione del
secondo eme aumenta l'affinità del terzo e così via, per cui l'affinità della quarta molecola è di
molto superiore a quella per la prima.
L'affinità dell'emoglobina per l'ossigeno è definita dal valore della P50, ossia la pressione parziale
di ossigeno a cui metà dell'emoglobina è saturata. In condizioni normali il valore della P50 è di 28
mmHg. L'emoglobina è completamente satura a pressioni di ossigeno comprese fra 80 e 100
mmHg; sotto i 70 mmHg la curva di dissociazione diventa molto più ripida: per ogni mmHg in
meno vi è una differenza notevole di O2 legato.
I fattori che influenzano l'affinità dell'emoglobina per l'ossigeno sono:
aumento della temperatura
aumento della PCO2 ematica
diminuzione del pH
aumento della concentrazione di 2,3 DPG
I primi tre fattori si hanno in un tessuto qualsiasi che si trovi in attività, l'aumento della DPG si
verifica invece solo dopo un lungo esercizio in quota.
L'influenza della variazione della PCO2 ematica è spiegata dall'effetto Haldane:
una maggiore PCO2 sposta a destra l'equilibrio di massa della reazione:
HHbO2 + CO2 ↔ HbCO2 + O2 + H
la CO2 infatti, legandosi alla parte globinica dell'emoglobina mediante legame carboaminico, riduce
l'affinità dell'Hb per l'ossigeno, che può essere ceduto ai tessuti in quantità maggiore.
La diminuzione del pH diminuisce l'affinità per l'ossigeno secondo quanto stabilito dall'effetto
Bohr. La desossiemoglobina lega H molto più facilmente dell'ossiemoglobina: l'aumento della
concentrazione di ioni H facilita dunque la cessione di O2 e la formazione di HHb secondo la
reazione
HbO2 + H ↔ HHb + O2
Il 2,3 difosfoglicerato è un fosfato che si forma dalla 3-fosfogliceraldeide prodotta nella glicolisi. È
un anione che si lega alle valine terminali delle due catene β della desossiemoglobina, stabilizzando
lo stato T e spostando a destra l'equilibrio della reazione
HbO2 + 2,3DPG ↔ Hb-2,3DPG + O2
La mioglobina è una proteina contenente ferro che si trova nella muscolatura striata, sia cardiaca
che scheletrica. È più abbondante nei muscoli ricchi di fibre rosse (contrazione lenta) che nei
muscoli ricchi di fibre bianche. La sua struttura è molto simile a quella di uno dei quattro monomeri
che formano la molecola dell'emoglobina. La sua curva di dissociazione non è a S italica, come per
l'emoglobina, ma a ramo di iperbole. La mioglobina per la sua struttura monomerica non può
godere della cooperatività positiva che caratterizza l'emoglobina.
Per le sue caratteristiche, la mioglobina ha la funzione di cedere ossigeno ai tessuti in condizioni di
ipossia. In condizioni di riposo (PO2 tissutale = 40 mmHg) la mioglobina è satura al 95%, tuttavia
una contrazione prolungata può fare calare drasticamente la PO2 tissutale (ipossia) e la mioglobina
cede l'ossigeno legato.
Nel corpo sono presenti piccole quantità di monossido di carbonio, CO, che è un prodotto di scarto
del metabolismo ed è usato dal cervello come messaggero chimico. Quantità maggiori possono
essere molto pericolose: l'emoglobina reagisce con una elevata affinità per il CO, di circa 210 volte
superiore a quella per l'O2, formando carbossiemoglobina, COHb. Un'atmosfera satura per lo 0,1%
di CO può già essere fatale: il 50% dell'emoglobina è saturo con CO. Inoltre concorrono i seguenti
fattori aggravanti:
il CO è un gas incolore, inodore, non irritante
la COHb ha lo stesso colore rosso vivo della HbO2 per cui non si ha cianosi
la PO2 a livello arterioso rimane normale ed i glomi aortici e carotidei non stimolano la
respirazione.
La CO non si dissocia facilmente dall'emoglobina
la COHb sfavorisce la dissociazione dell'HbO2 in Hb e O2
Trasporto CO2
L'attività metabolica dei tessuti produce CO2 come prodotto terminale dell'ossidazione di vari
substrati. Tutta la CO2 prodotta provoca un aumento della pressione parziale di CO2 a 46 mmHg
circa in un soggetto a riposo (quindi 6 mmHg in più del sangue arterioso)
Le forme in cui la CO2 può essere contenuta nelle cellule sono tre:
gas fisicamente disciolto
in forma idratata
carboamino-composto, legata a proteine cellulari
Solo la CO2 fisicamente disciolta può passare dalle cellule al sangue. Le proteine infatti non
possono attraversare la membrana cellulare, mentre la permeabilità di HCO3 è trascurabile.
La quantità fisicamente disciolta di CO2 trasportata è stabilita dalla legge di Henry:
Q = K P = 0,065 ml / 100 ml /mmHg * 46 mmHg = 2,98 ml / ml di sangue venoso
Q = K P = 0,065 ml / 100 ml /mmHg * 40 mmHg = 2,62 ml / ml di sangue venoso
per un trasporto di CO2 pari a 0,36 ml / 100ml, insufficiente a smaltire i 200 ml di CO2 prodotti
ogni minuto dall'organismo. La CO2 che – per una gradiente pressorio – attraversa la membrana
cellulare e si trasferisce nel plasma, sposta a sinistra l'equilibrio di massa delle reazioni di
formazione dei carboamino-composti e dello ione bicarbonato:
Pr + CO2 <-----> Pr-CO2
CO2 + H2O <-----> H2CO3 <------> HCO3 + H
La CO2 che penetra nel plasma si trova anch'essa in tre forme:
fisicamente disciolta (5% della CO2 totale)
in forma idratata (4%) (la reazione di formazione non è catalizzata da alcun enzima – l'anidrasi
carbonica non è presente nel plasma)
legata a proteine plasmatiche(1%)
L'aumento della PCO2 plasmatica crea un aumento del gradiente di pressione fra plasma (PCO2 =
46 mmHg) e globulo rosso (PCO2 = 40 mmHg), per cui la CO2 fisicamente disciolta attraversa la
membrana del globulo rosso. All'interno dell'eritrocita la CO2 si trova sotto forme:
fisicamente disciolta (5% della CO2 totale)
in forma idratata (63%)
legata all'emoglobina (carboamino-emoglobina, 21%)
La reazione di idratazione nel globulo rosso,
CO2 + H2O <-----> H2CO3 <------> HCO3 + H
è molto rapida, rispetto a quanto osservato nel plasma. Ciò avviene per due motivi:
la presenza dell'enzima anidrasi carbonica, che aumenta la velocità di reazione di 13000 volte
la sottrazione dei prodotti HCO3 e H.
Il protone infatti viene tamponato dall'emoglobina, formando HHb e favorendo il passaggio di
O2 ai tessuti (effetto Bohr). L'HHb a parità di pH, lega un numero maggiore di H (i suoi gruppi
imidazolici si dissociano di meno). L'HHb è un acido più debole e quindi un tampone migliore
dell'ossiemoglobina. Se l'emoglobina si desossigenasse semplicemente il pH aumenterebbe a
7,7. Legando ioni H rimane invece invariato.
Il bicarbonato HCO3 per gradiente di concentrazione attraversa la membrana e passa nel plasma,
essendo la membrana dell'eritrocita molto permeabile agli anioni e poco ai cationi. Il passaggio
di bicarbonato, non accompagnato dal concomitante passaggio di cariche positive nella stessa
direzione, crea uno squilibrio di campo elettrico, per cui lo ione Cl – abbondante nel plasma –
passa all'interno dell'eritrocita. Tuttavia il Cl è più osmoticamente attivo del bicarbonato, per cui
una certa quantità d'acqua entra all'interno del globulo rosso, rigonfiandolo.
Parte della CO2 si lega all'emoglobina formando carboamino-emoglobina:
Hb-NH2 + CO2 <-----> Hb-NH-COOH
in realtà la carboamino-emoglobina è quasi del tutto dissociata in
Hb-NH-COOH <-----> Hb-NH-COO + H
per cui si formazione di ioni H che vengono tamponati dall'emoglobina e favoriscono l'effetto Bohr.
La curva di dissociazione dell'Hb
non ha una fase di plateau. Il sangue non si satura di CO2. Inoltre la quantità di CO2 contenuta nel
sangue è sempre maggiore di quella di O2.
Ventilazione e rapporto ventilazione-perfusione
La ventilazione è definita come il volume d'aria che in un minuto penetra o fuoriesce dal sistema
respiratorio. Si tratta sostanzialmente di un flusso, e lo si indica con la lettera V'. distinguiamo tre
tipi di ventilazione:
ventilazione polmonare (V')
ventilazione alveolare (V'A)
ventilazione dello spazio morto (V'D)
La ventilazione polmonare è sempre la somma delle altre due. La ventilazione polmonare è data
dal volume corrente per la frequenza respiratoria:
V' = VC * RR (respiratory rate)
Si ottiene così il flusso desiderato. A rigore, andrebbe sottolineato che la ventilazione inspiratoria e
la ventilazione espiratoria non sono uguali: il volume di O2 consumato è solitamente differente da
quello di CO2 prodotta1. Tuttavia, per ragioni pratiche non si tiene conto di questa piccola
differenza.
La ventilazione polmonare può essere aumentata incrementando la frequenza respiratoria, il volume
corrente, oppure entrambi i parametri.
La ventilazione alveolare è il volume di aria esterna (fresca) che entra in contatto di scambio
gassoso con i capillari polmonari in un minuto. Una parte significativa dell'aria che entra nel
sistema respiratorio non scambia gas con i capillari: si tratta dell'aria contenuta nel sistema di
conduzione (aria dello spazio morto anatomico, in serie) e dell'aria contenuta negli alveoli poco
perfusi (aria dello spazio morto fisiologico, in parallelo).
1 Il quoziente respiratorio, rapporto fra volume di anidride carbonica prodotta / minuto e volume di ossigeno
consumato / minuto è – in condizioni di riposo – pari a 200 ml / 250 ml = 0,8. Ventilazione inspiratoria e
ventilazione espiratoria coincidono solo quando il quoziente respiratorio è pari ad 1.
La ventilazione alveolare in un soggetto normale a riposo è
(VC – VD) * RR = 500ml – 150ml * 12 = 4,2 l
La ventilazione dello spazio morto è quel volume d'aria che viene introdotto nel sistema
polmonare in un minuto e che non scambia gas con il sangue. Il suo volume può essere calcolato
conoscendo la PCO2 dell'aria espirata (PECO2 ), la PCO2 del sangue arterioso (PaCO2 ) e il volume
corrente (VC). Il volume corrente, moltiplicato per la PCO2 dell'aria espirata, è uguale alla PCO2
del sangue arterioso moltiplicata per la differenza fra volume corrente e spazio morto, più la PCO2
dell'aria inspirata (PICO2 ) moltiplicata per lo spazio morto (equazione di Bohr2):
PECO2 * VC = PaCO2 * (VC – VD) + PICO2 * VD
Il termine PICO2 * VD è molto piccolo e può essere trascurato. Risolvendo l'equazione per VD si
ottiene la formula per calcolare il volume dello spazio morto fisiologico:
VD = VC (PaCO2 – PECO2) / PaCO2
L'equazione può essere utilizzata per calcolare il volume dello spazio morto anatomico, sostituendo
la PCO2 del sangue arterioso con la PCO2 dell'aria alveolare3.
Sotto il profilo funzionale è molto importante stabilire quanto della ventilazione spetti allo spazio
morto e quanto alla ventilazione alveolare. Infatti è possibile modificare la respirazione in due modi
diversi, ossia cambiando frequenza respiratoria o il volume corrente. Una modificazione della
frequenza respiratoria fa incrementare la ventilazione dello spazio morto in proporzione maggiore
rispetto alla ventilazione alveolare. Un aumento del volume corrente, al contrario, fa aumentare
soltanto la ventilazione alveolare, mantenendo costante quella dello spazio morto. Per questo
motivo durante l'attività fisica è conveniente respirare più profondamente che aumentare la
frequenza respiratoria.
Aria alveolare e fattori che influenzano il suo volume e la sua composizione:
L'aria alveolare è quel volume d'aria che entra in rapporto di scambio gassoso con il sangue
contenuto nei capillari alveolari.
Il suo volume è molto variabile. In condizioni di riposo esso oscilla fra la capacità funzionale
residua, a fine espirazione, e la CFR più il volume d'aria che penetra nella zona di scambio
alveolare alla fine dell'inspirazione. Durante l'esercizio muscolare si hanno escursioni respiratorie
molto più ampie, per cui le modificazioni dell'aria alveolare possono aumentare notevolmente.
La composizione dell'aria alveolare cambia in rapporto alle variazioni di volume e al continuo
passaggio di O2 e CO2 che avviene attraverso la membrana alveolo-capillare. All'inizio dell'atto
inspiratorio si nota un aumento della PCO2 e una diminuzione della PO2, a differenza di quanto ci si
potrebbe aspettare. Ciò perché la prima aria proviene dallo spazio morto in serie. Successivamente,
quando la prima aria “fresca” raggiunge i polmoni, la PCO2 diminuisce e la PO2 aumenta. Al
termine dell'espirazione il processo si inverte: PCO2 aumenta e PO2 diminuisce a causa di due
fattori: il continuo scambio di O2 e CO2 attraverso la membrana alveolo-capillare e la diminuzione
del volume alveolare dovuto all'espirazione.
Le variazione della composizione dell'aria alveolare possono essere rappresentate dallo schema
seguente:
2 Tale equazione è un'applicazione del principio della diluizione. Tenere presente inoltre che le pressioni parziali dei
gas sono proporzionali alla loro concentrazione, per la legge di Dalton.
3 PACO2 , è la PCO2 degli ultimi 10 ml di gas espirato. È una media di gas da differenti alveoli, senza riferimento alla
loro perfusione. Ciò a differenza della PaCO2 , che è il gas equilibrato con i soli alveoli perfusi, ed è di consguenza –
in individui con alveoli non perfusi – maggiore di PACO2 .
I fattori che influenzano le modificazioni dell'aria alveolare sono:
la ventilazione alveolare. Un suo aumento provoca un aumento della PO2 e una diminuzione
della PCO2 .
Il consumo di O2 : se aumenta, la PAO2 diminuisce
la produzione di CO2 : se aumenta, anche PACO2 aumenta
la PIO2 : se aumenta, aumenta PAO2
la pressione barometrica, che influenza secondo la legge di Dalton PIO2
i volumi di fine inspirazione e fine espirazione.
Rapporto ventilazione perfusione.
Il rapporto ventilazione perfusione mette in correlazione il volume di aria alveolare e del flusso
sanguigno polmonare.
Il rapporto ventilazione/perfusione medio è dato da:
V'A / Q'
cioè ventilazione alveolare fratto flusso sanguigno polmonare. In condizioni normali questo
rapporto è pari a 4,20 l / 5,25 l = 0,8. Si tratta di un dato questo che deriva dalla combinazione di
una serie di rapporti ventilazione/perfusione parziali, che oscillano fra 3 e 0,3.
Vediamo le cause della non uniforme ventilazione, quelle della non uniforme perfusione e poi
consideriamo come varia il rapporto ventilazione-perfusione.
Le cause della non uniforme ventilazione sono:
1) rigidità delle strutture bronchiali
2) pressione distendente gli alveoli (pressione transmurale)
3) tensioattivo polmonare
4) forma del polmone
1. Le strutture bronchiali sono rigide e sfavoriscono quindi la distensione delle parti apicali
del polmone che sono in contatto con esse. Inoltre si distendono più le parti esterne del
polmone che non quelle interne, poiché la forza traente è applicata alla periferia del
polmone.
2. La pressione transmurale non è uniforme: al termine dell'espirazione essa è -5 mmHg
all'apice del polmone e quasi 0 alla base. Ciò a causa del peso del polmone, che esercita una
pressione crescente man mano che ci si avvicina alla base. Gli alveoli che si trovano alla
base del polmone per questo motivo sono meno distesi in condizioni di riposo, mentre gli
alveoli apicali sono più distesi. Gli alveoli apicali hanno quindi una compliance ridotta e si
espandono di meno. Questo fenomeno può essere eliminato ponendo il soggetto sdraiato
3. il tensioattivo polmonare è più concentrato negli alveoli basali, per cui facilita una
variazione di volume maggiore.
4. La forma del polmone influisce sulla distribuzione della ventilazione. Il pomone è infatti
assimilabile ad un cono, per cui – anche se il flusso si potesse distribuire a tutti li alveoli in
parti uguali – una maggior quantità d'aria sarebbe convogliata alle basi.
Durante l'esercizio fisico la differenza di ventilazione tende comunque ad attenuarsi per l'aumento
di profondità dell'atto respiratorio.
I fattori che modificano la perfusione sono due:
1) fattore ortostatico
2) distensibilità del polmone
1. Il circolo polmonare ha valori di pressione molto bassi: 25 mmHg sistole, 8 mmHg diastole,
13 mmHg di media. Questi valori risentono molto della pressione idrostatica, per cui ogni
cm di dislivello dal piano della valvola tricuspide corrisponde a 0,78 mmHg di differenza. I
valori pressori misurati alla base saranno quindi molto più alti di quelli misurati all'apice del
polmone (21 mmHg di media contro 5 mmHg di pressione media). Questo provoca
ovviamente una maggiore perfusione alla base, rispetto alle porzioni apicali. Il soggetto che
dalla posizione ortostatica passa alla posizione supina avrà invece un flusso sanguigno
distribuito in maniera molto più omogenea.
2. Le cicliche variazioni del volume polmonare durante l'atto respiratorio influenzano il calibro
dei vasi alveolari e dei vasi extra-alveolari. Si può affermare che
- un'inspirazione diminuisce il calibro dei capillari alveolari (aumento della resistenza) ed
aumenta il calibro dei vasi extra-alveolari (diminuzione della resistenza)
- un'espirazione aumenta il calibro dei capillari alveolari (diminuzione della resistenza) e
diminuisce il calibro dei vasi extra-alveolari (aumento della resistenza):
La resistenza totale al flusso risente quindi della variazione della resistenza a livello alveolare ed
extra-alveolare. Il comportamento globale delle resistenze è il seguente:
come si vede la curva assomiglia ad una parabola: la resistenza è minima per volumi polmonari
intorno al volume corrente, è massima invece al volume residuo (per l'elevata resistenza dei vasi
extra-alveolari) e alla capacità polmonare totale (per l'elevata resistenza dei vasi alveolari).
Sia ventilazione dunque che perfusione aumentano in valore assoluto dall'apice alla base. Tuttavia
la crescita della perfusione è molto più marcata rispetto a quella della ventilazione, per cui il
rapporto ventilazione/perfusione varia da 3 (all'apice) a 0,3 (base polmonare). Vediamo adesso
come queste modifiche influenzano la composizione gassosa del sangue arterioso. Disegniamo un
diagramma in cui riportiamo in ascissa PO2 ed in ordinata PCO2 del sangue arterioso.
Il punto A indica la situazione di un'ostruzione alveolare: la ventilazione è nulla, per cui non si
hanno scambi gassosi e PO2 e PCO2 restano quelle del sangue venoso.
Il punto B rappresenta quello che accade alla base del polmone (rapporto ventilazione/perfusione =
0,3). C è un punto a metà del polmone (ventilazione/perfusione 0.8), D è l'apice del polmone
(ventilazione/perfusione = 3), E è la condizione limite di un alveolo molto ventilato e pochissimo
perfuso. Passando da B a E la composizione gassosa del sangue arterioso si avvicina sempre di più
a quella dell'aria alveolare.
***
Equilibrio acido-base
Il pH di una soluzione è uguale a
-log [H]
Il pH fisiologico è pari a 7,4; il suo valore può oscillare di poco fra 7,38 e 7,42. Variazioni fra 7,0 e
7,7 sono comunque compatibili con la vita.
Il pH intracellulare è lievemente più acido di quello plasmatico, grazie all'azione di un scambiatore
Na-H.
Il pH va mantenuto costante per vari motivi:
gli enzimi hanno un pH ottimale di funzionamento e una sua modificazione può alterare il
metabolismo
variazioni di pH possono produrre modificazioni della struttura terziaria dei canali di
membrana. A livello del sistema nervoso questo si traduce in minore eccitabilità dei neuroni in
caso di acidosi (convulsioni, disorientamento, coma) o in una maggiore eccitabilità dei neuroni
in caso di alcalosi (intorpidimento, formicolii, tetania)
alterazioni della [K]: l'acidosi fa aumentare la concentrazione di potassio, l'alcalosi la fa
diminuire. Ciò provoca alterazioni a livello dei tessuti eccitabili, come per esempio il tessuto
cardiaco.
Le fonti di acidi del nostro organismo sono due: gli acidi organici (acidi gassi, intermedi del ciclo
di Krebs, acido lattico: si ionizzano e cedono H) e la CO2 che si idrata e genera ioni H (si tratta della
fonte più significativa).
Le fonti di basi sono poche: si tratta della frutta e dei vegetali, che contengono anioni e generano
HCO3.
I meccanismi che controllano il pH dei liquidi corporei sono:
sistemi tampone
meccanismi respiratori
meccanismi renali
L'importanza di questi meccanismi è diversa, e diverso è anche il loro tempo di intervento: i sistemi
tampone agiscono immediatamente, i meccanismi respiratori nel giro di minuti, i meccanismi renali
richiedono invece ore o addirittura giorni.
I sistemi tampone sono acidi deboli, parzialmente dissociati a pH fisiologico, in grado di legare H
quando [H] cresce e viceversa di cederlo quando [H] diminuisce.
Ecco i più importanti:
pK
H2PO4 /HPO4
6,8
H2CO3 /HCO3
6,1
Proteina / proteina 6,0
Hb / HHb
8,2
HbO2 /HHbO2
6,6
L'equazione di Henderson-Hasselbach descrive i cambiamenti di pH conseguenti all'aggiunta di
H o di OH ad una soluzione con tampone:
pH = pK + log [A] / [HA]
dove K è la costante di dissociazione della soluzione:
K = [H][A]/[HA]
Se la forma indissociata e la forma dissociata sono presenti ad egual concentrazione, pH = pK.
Il pK è pertanto un pH particolare, in cui l'acido è presente per il 50% in forma dissociata e per il
50% in forma indissociata.
L'efficacia di una coppia tampone è data:
dal pK della coppia. Più è vicino al pH della soluzione in cui si trova, maggiore sarà il potere
tamponante.
dalla concentrazione della coppia. Maggiore è la concentrazione della coppia, più molecole
saranno disponibili ad accettare (o cedere) H.
Il sistema tampone più importante è quello del bicarbonato, poiché si trova ad elevate
concentrazioni, ed in più reagenti e prodotti sono controllati anche dalla funzione respiratoria e
renale
CO2 + H2O <-----> H2CO3 <------> HCO3 + H
in caso di aumento di pH,
il sistema respiratorio elimina più CO2 , H2CO3 diminuisce e HCO3 e H si riassociano;
il rene produce più HCO3 , si forma H2CO3 e ciò porta ad un aumento della CO2 che viene eliminata
dal sistema respiratorio.
Per l'equazione di Hendeson-Hasselbach
pH = pK + log [HCO3] / [H2CO3] = 6,1 + log 26mEq/litro / 1,3mEq/litro = 7,4
Il rapporto [HCO3] / [H2CO3] è uguale a 20. Un suo aumento corrisponde ad una alcalosi, una
diminuzione ad una acidosi. Esistono dunque condizioni in cui a parità di pCO2 il sangue può essere
alcalino, neutro, acido: a PCO2 costante si può variare il pH variando la concentrazione di ioni
bicarbonato. È così possibile costruire curve iso-PCO2 :
I diagrammi di Davenport sono dei grafici che mettono in rapporto HCO3 , pH e pCO2. Vengono
utilizzati per diagnosticare alterazioni dell'equilibrio acido-base: la misura del pH non è sufficiente,
in quanto non ci può dire da sola se ci troviamo in condizioni normali o in condizioni di
alcalosi/acidosi compensata.
I diagrammi di Davenport sono costituiti da tre zone verticali e due zone orizzontali, che
individuano quattro quadranti: acidosi metabolica e respiratoria, alcalosi metabolica e respiratoria:
Tracciamo adesso delle iso-PCO2 nei diagrammi di Davenport: 30, 40, 50 mmHg. Supponiamo che
un soggetto si trovi in B: si troverà in condizioni di acidosi e, essendo la PCO2 normale, si tratterà
di acidosi metabolica. Analogamente, un soggetto che venga a trovarsi in C sarà in condizioni di
alcalosi metabolica, poiché la PCO2 è a valori fisiologici. Le cause di queste variazioni di pH non
sono imputabili alla funzione respiratoria e quindi a problemi metabolici (v. avanti cause)
Poiché la variazioni di pH sono poco tollerate dall'organismo, entrano in azione dei meccanismi di
compenso che riportano il pH all'interno del range fisiologico:
nel caso del soggetto che si trova in B, essendo la variazione di pH dovuta a cause di tipo
metabolico, il meccanismo di compenso sarà respiratorio. L'eccesso di ioni H stimola i centri
respiratori, con conseguente iperventilazione. L'iperventilazione provoca l'eliminazione di
notevoli quantità di CO2 , portando la PCO2 a valori inferiori. Il pH di conseguenza si innalza e
torna verso valori di normalità (acidosi metabolica compensata, punto B')
nel caso del soggetto in C, analogamente, il meccanismo di compenso sarà respiratorio. La
ridotta concentrazione di ioni H stimola in maniera minore i centri respiratori per cui si andrà
incontro a ipoventilazione, con conseguente accumulo di CO2. Il pH di conseguenza diminuisce
e ci si sposta verso un valore diverso della PCO2, passando dal punto C al punto C' (alacolosi
metabolica compensata).
Successivamente entreranno anche in gioco meccanismi renali che permetteranno di riportare i
valori della PCO2 a livelli normali. Il rene infatti è in grado di produrre ione bicarbonato e di
eliminarlo se questo è in eccesso. Nel caso dell'acidosi metabolica il rene produrrà ione bicarbonato,
riportando la PCO2 a 40 mmHg e facendo così cessare l'iperventilazione. Al contrario, nel caso
dell'alcalosi metabolica, il rene eliminerà il bicarbonato in eccesso, permettendo alla PCO2 di
riportarsi ai valori normali (fine dell'ipoventilazione).
Altre due condizioni di alcalosi ed acidosi non compensata sono quelle dei soggetti che si trovano
in D e in E. In questo caso la PCO2 non è normale, per cui è evidente che la variazione di pH è
dovuta alla funzione respiratoria. Il meccanismo di compenso dovrà necessariamente essere di tipo
metabolico:
il soggetto in D è in condizioni di acidosi respiratoria. Il rene produrrà ioni bicarbonato in
quantità, permettendo di riportare il pH a valori normali. La PCO2 rimane comunque elevata
finché non sarà possibile eliminare le condizioni patologiche che hanno prodotto
l'ipoventilazione
il soggetto in E è in condizioni di alcalosi respiratoria. Il rene risponde eliminando gli ioni
bicarbonato in eccesso, permettendo di riportare il pH a valori normali. Tuttavia la PCO2 rimane
bassa, finché il sistema respiratorio non è in grado di riprendere la normale ventilazione.
Cause di acidosi ed alcalosi:
acidosi metabolica: diabete scompensato, diabete acidificante, insufficienza renale (mancata
eliminazione di acidi tramite le urine), diarrea (perdita di basi)
alcalosi metabolica: vomito (perdita acidi), aggiunta ai liquidi corporei di anti-acidi
acidosi respiratoria: ipoventilazione (patologia polmonare, barbiturici --> inibizione dei centri
del respiro), edema (riduzione scambi gassosi)
alcalosi respiratoria: iperventilazione (ipossia da grandi altezze, cause psichiatriche, ansia)
Emoglobina ed equilibrio acido-base.
L'emoglobina si comporta come coppia tampone in due diverse forme:
pK
Hb / HHb
8,2
HbO2 /HHbO2
6,6
La molecola dell'emoglobina contiene 38 radicali istidinici; i relativi gruppi imidazolici possono
reagire con gli idrogenioni nel seguente modo:
Nel sangue arterioso, la frazione maggiore presente è quella dell'ossiemoglobina dissociata (HbO2),
pari al 83,4%, la sua forma indissociata è presente per il 13,6%. La ripartizione fra forma dissociata
e indissociata è diversa per la desossiemoglobina: forma dissociata (Hb ) 0,5% e forma indissociata
(HHb) 2,5%. Ciò si spiega con i differenti pK delle due coppie tampone.
Quando il sangue arterioso arriva ai tessuti e cede l'ossigeno (il 25% del patrimonio in O2) l'Hb che
si forma funziona da accettore di H, prodotto dalla idratazione del CO2:
HHbO2 ------> O2 + Hb
+ ---> HHb
CO2 + H2O <-----> H2CO3 <------> HCO3 + H
In questo modo l'effetto dell'entrata in circolo della anidride carbonica, che porterebbe ad un
notevole calo del pH, viene minimizzato dalla presenza di notevoli quantità di emoglobina non
ossigenata. La frazione di HHb passa dal 2,5% al 22%
Controllo della respirazione
Il nostro organismo è in grado di modificare la ventilazione polmonare, variando frequenza e
profondità del respiro, in modo da mantenere costante la pressione parziale di CO2 nel sangue
arterioso (40 mmHg).
Il tipi di controllo agiscono a livelli diversi:
1) controllo volontario
2) controllo emozionale
3) controllo automatico
1. metabolico (per mantenere costante PO2 , PCO2 e pH del sangue arterioso)
2. meccanico dovuto all'azione di recettori che valutano la distensione del polmone
Il controllo volontario permette di variare in maniera cosciente la frequenza di respirazione o il
volume corrente. Permette di interrompere il respiro, iperventilare e di coordinare la respirazione
nel corso di attività motorie volontarie (ad esempio dare un colpo di tosse volontario).
L'interruzione volontaria del respiro dopo un certo tempo viene sopraffatta dal controllo
involontario. Il momento in cui l'inibizione volontaria del respiro cessa è il punto di rottura. Esso
è determinato dall'aumento della PCO2 alveolare e dalla diminuzione della PO2. Vari fattori
possono spostare in avanti il punto di rottura (rimozione dei glomi aortici e carotidei,
iperventilazione, respirazione di O2 puro, fattori meccanici e fattori psicologici). Il centro di
integrazione che sovrintende al controllo volontario è nella corteccia cerebrale, probabilmente nella
corteccia motoria. Si è osservato sperimentalmente che l'animale decorticato perde il controllo
volontario, ma non quello automatico. Le vie efferenti sono separate sia da quelle del controllo
automatico (centri bulbo-pontini) sia dalla via cortico-spinale.
Il controllo emozionale è dovuto all'attività del sistema limbico. (:::::::::::::::::::::::::::::::::::::::)
Il controllo automatico metabolico ha i suoi centri di integrazione a livello bulbare:
il gruppo respiratorio dorsale si trova dorsalmente al nucleo del tratto solitario, in prossimità
dell'emergenza dell'XI paio di nervi cranici. È costituito principalmente da neuroni I, ossia neuroni
che scaricano durante l'inspirazione. I neuroni di questo gruppo ricevono afferenze dalle vie aeree e
dai glomi aortici e carotidei che terminano nel nucleo del tratto solitario.
il gruppo respiratorio ventrale è una lunga colonna di neuroni che si estende attraverso il nucleo
ambiguo e il nucleo retroambiguo (sito ventralmente innerva i mm. scheletrici respiratori). Contiene
neuroni di tipo I e neuroni di tipo E (neuroni espiratori, solitamente silenti, divengono attivi quando
aumenta la ventilazione).
La genesi della scarica respiratoria sembra essere localizzata nel bulbo, dal momento che la respirazione
continua – anche se in maniera irregolare – dopo la sezione a livello del ponte. Distruzioni selettive del
nucleo dorsale o del nucleo ventrale non aboliscono il respiro. Un nucleo di cellule pace-maker non è
ancora stato individuato, anche se osservazioni sperimentali sul ratto neonato hanno dimostrato che nel
complesso pre-Bottzinger esistono delle cellule che scaricano ritmicamente.
A livello del ponte sono presenti due centri:
il centro pneumotassico, rostrale. Non è attivo spontaneamente, ma quando viene attivato va ad
inibire il
centro apneustico, caudale, che è continuamente attivo e la cui azione è quella di attivare il centro
inspiratorio bulbare.
Con la tecnica delle sezioni a diversi livelli è possibile ricavare delle informazioni sulla funzione dei
centri e dei loro collegamenti.
Un animale decerebrato (sezione tra il ponte e l'encefalo) non ha controllo volontario ed emozionale del
respiro, ma solo quello automatico. Il suo tracciato spirometrico è normale, tuttavia se tagliamo le
afferenze vagali il respiro diventa più profondo e meno frequente. Il nucleo del tratto solitario infatti non
viene attivato e non può inibire ciclicamente il centro inspiratorio e il centro apneustico. Il centro
apneustico può attivare così più a lungo il centro inspiratorio (aumento dell'ampiezza e diminuzione
della frequenza respiratoria).
Un taglio a livello del ponte, al di sotto del nucleo parabranchiale, interrompe il collegamento fra centro
pneumotassico e il centro apneustico. Venendo meno l'azione inibente del centro pneumotassico, il
centro apneustico può esercitare più a lungo la sua funzione: il respiro diventa più profondo e meno
frequente. Se però vengono recisi anche i nervi vaghi, il centro apneustico non viene inibito in alcun
modo, per cui esso ecciterà in modo continuo il centro inspiratorio. Il risultato sarà una lunga e profonda
inspirazione, interrotta da brevi atti espiratori (respiro apneustico) verosimilmente causati dall'ipossia e
dall'ipercapnia.
Un animale bulbare (sezione fra bulbo e ponte) presenta un respiro spasmodico (gasping). Questa
sezione dimostra che il il ritmo respiratorio si genera a livello del bulbo.
L'animale spinale alto, con una sezione a livello midollare di C1-C5 non può respirare autonomamente,
essendo interrotta completamente la via efferente. Una sezione midollare al di sotto di C5 si trova al di
sotto dell'emergenza del nervo frenico, per cui l'animale può respirare normalmente.
La genesi del ritmo respiratorio avviene nel centro bulbare. Le ipotesi al momento sono due:
la più accreditata sostiene che essa avvenga per l'azione dei neuroni del pre-Bottzinger complex che
scaricano ritmicamente e generano scariche ritmiche nei nervi frenici.
l'ipotesi dell'“inibizione dell'inspirazione” sostiene invece che un gruppo di neuroni (gruppo A) è
tonicamente attivo. Questo gruppo eccita i motoneuroni dei mm. inspiratori, ma anche i neuroni del
gruppo B. Questi ultimi sono eccitati anche da impulsi vagali provenienti da recettori di stiramento
del polmone; la loro eccitazione attiva i neuroni del gruppo C, che agiscono a feedback negativo sul
gruppo A, inibendolo.
I centri respiratori ricevono afferenze da:
lobo limbico
corteccia encefalica
chemocettori bulbari centrali: PCO2
chemocettori carotidei e aortici: PO2 , pH
meccanocettori del polmone
La via efferente è divisa in quattro componenti:
1) dalla corteccia cerebrale agli alfa motoneuroni spinali, senza passare per i centri respiratori
bulbo pontini. Questa via si trova nelle porzioni posteriori dei cordoni laterali
2) vie bulbo-spinali che si collocano nei cordoni laterali del midollo spinale, in vicinanza
dell'emergenza delle radici anteriori.
3) dal nucleo ambiguo ai muscoli della laringe e dell'albero tracheo-bronchiale
4) via per il controllo fine della forza sviluppata dai muscoli respiratori
I recettori della via afferente si trovano si nel distretto polmonare, che in zone extrapolmonari.
I recettori polmonari sono:
1) recettori da stiramento (meccanocettori ad adattamento lento)
2) recettori per stimoli irritativi (meccanocettori ad adattamento rapido)
3) recettori J
Questi recettori trasferiscono i loro messaggi lungo la via vagale afferrente.
1. recettori da stiramento: sono situati all'interno della muscolatura liscia dei bronchi e
scaricano tonicamente. Ne esistono di due tipi: da insufflazione e da desufflazione. Lo
stimolo è una notevole variazione del volume polmonare. La risposta che provocano è un
inibizione dell'insufflazione (recettori da insufflazione) o della desufflazione (recettori da
desufflazione); per questo motivo si dice che la loro funzione è di regolazione. I centri a cui
proiettano sono quelli bulbo-pontini. Non si tratta di recettori fondamentali per la
respirazione, ma controllano il modo di respirare: la sezione delle afferenze vagali provoca
una scarica del nervo frenico più prolungata
2. recettori per stimoli irritativi: si trovano tra le cellule epiteliali delle vie aeree. Sono
stimolati da stimoli irritativi (gas nocivi, pollini) o da un'iperinflazione polmonare. Si tratta
di recettori ad adattamento rapido (scarica transitoria delle fibre efferenti). Le risposte che
danno questi recettori sono: tosse, broncocostrizione e secrezione di muco. I centri a cui
proiettano non sono del tutto noti (solo in parte si tratta dei centri bulbari)
3. recettori J: si trovano vicino ai vasi ematici dei bronchi e dei polmoni. Sono stimolati dall'edema
e dalla presenza di sostanze come l'istamina, la bradichinina e le prostaglandine. Sono responsabili
di una risposta che prevede respiro frequente e superficiale, costrizione laringea e apnea.
I recettori extrapolmonari sono:
1) glomi
2) pressocettori nel sistema cardiovascolare: i tensocettori negli atri e nelle grandi vene aumentano
la respirazione, i tensocettori dell'arco aortico e del seno carotideo, al contrario, se vengono
stimolati da un aumento pressorio, deprimono la respirazione.
3) Meccanocettori dei muscoli e degli organi muscolo-tendinei di Golgi: tendono ad aumentare la
ventilazione all'inizio di un lavoro muscolare
4) nocicettori cutanei: aumentano la ventilazione
5) nocicettori viscerali: deprimono la ventilazione (il movimento del diaframma infatti aumenta la
pressione addominale)
6) termocettori centrali e periferici. I calocettori danno aumento della frequenza respiratoria e
riduzione delle profondità respiratoria. I frigocettori diminuiscono la profondità respiratoria. Gli
animali usano la respirazione per controllare la temperatura corporea: un'iperventilazione
superficiale porta ad un'evaporazione dell'acqua dalle vie aeree (perdita di calore) e ad una
ridotta perdita di CO2 (viene ventilato molto lo spazio morto, riducendo l'alcalosi).
Chemocettori centrali e perifierici
I recettori sensibili all'O2 alla CO2 e agli H sono localizzati in due zone diverse: nel sistema nervoso
centrale e nelle grandi arterie.
I chemocettori centrali sono localizzati a livello bulbare, nella superficie ventrale, lateralmente alle
piramidi, vicini all'emergenza dei nervi vago e glossofaringeo. Tali recettori sono sensibili alla
concentrazione di H nel LCS e nel liquido interstiziale cerebrale. Lo stimolo adeguato per questi
recettori è rappresentato da un aumento della PCO2 del sangue arterioso: H e HCO3 non
attraversano la bariera emato-encefalica, a differenza della CO2 che la supera con facilità. La CO2
che entra nel liquor va subito ad idratarsi, facendo aumentare così anche la concentrazione di H e
HCO3 . All'interno del LCS non è presente l'enzima anidrasi carbonica, per cui tale reazione
procede solo per equilibrio di massa; l'assenza di proteine all'interno del LCS impedisce poi che gli
ioni H neoformati vengano tamponati. CO2 e H superano poi la membrana cellulare del recettore e
vanno ad aumentare la concentrazione intracellulare di H (i recettori possiedono l'anidrasi
carbonica, per cui la reazione è più veloce), stimolando i recettori ad attivare i centri respiratori
bulbari.
La latenza della risposta alla CO2 (alcuni minuti) è dovuta al tragitto che la CO2 deve percorrere per
raggiungere i recettori. Anche la sottrazione allo stimolo ha un periodo di latenza uguale. Se si
applica una soluzione a pH acido sui chemocettori, la latenza sarà invece di pochi secondi.
I chemocettori periferici sono localizzati nel circolo aortico sistemico a livello della biforcazione
della carotide comune (glomi carotidei) e dell'arco dell'aorta (glomi aortici). Da questi recettori
parte la via afferente costituita dal nervo di Hering per i glomi carotidei (IX paio) e dal nervo
cardio-aortico per i glomi aortici (X paio).
I glomi sono costituiti da due tipi cellulari:
cellule di primo tipo, con funzione recettoriale, sono in contatto con le fibre efferenti.
Contengono vescicole di catecolamine (sopratutto dopamina) che vengono liberate per esocitosi
in seguito allo stimolo.
cellule di secondo tipo, similgliali, che hanno funzione di sostegno.
Il flusso sanguigno che raggiunge i glomi è elevato: circa 2000 ml / 100 g / min (tanto per fare un
paragone il cuore riceve 80 ml / 100 g / min), tale da soddisfare il consumo di O2 soltanto con
l'aliquota fisicamente disciolta nel sangue. I glomi sono sensibili al fabbisogno di O2 ed hanno una
latenza rapida: un aumento della percentuale di ossigeno (>21%) porta all'ipoventilazione; una
diminuzione non porta alcun effetto nell'intervallo compreso fra 21% e 10%4; al di sotto del 10%
l'organismo inizia ad iperventilare.
Meccanismo di risposta a variazioni della PO2: Le riduzione della pressione parziale di ossigeno
provoca la chiusura di alcuni canali del K. Le cellule si depolarizzano e ciò porta all'apertura di
canali del Ca voltaggio sensibili. Il calcio entra nella cellula, genera potenziali d'azione e libera il
neurotrasmettitore tramite esocitosi. Il neurotrasmettitore va ad eccitare le terminazioni nervose
afferenti.
Il funzionamento dei glomi spiega anche perché non si iperventili nelle condizioni di anemia e di
avvelenamento da CO: in entrambi i casi diminuisce la quantità di O2 legato all'emoglobina, non
quella fisicamente disciolta. I glomi non rilevano pertanto alcuna anomalia. Un flusso ematico
ridotto (come nel caso dell'ipotensione) provoca un'iperventilazione, anche se la PO2 arteriosa ha un
valore normale.
I glomi sono sensibili anche a variazioni della PaCO2 e del pH. Variazioni piccole (+3mmHg) della
pressione arteriosa della CO2 portano rapidamente ad aumento della ventilazione, che cresce
linearmente all'aumentare della PCO2 arteriosa. Se associamo all'ipercapnia anche l'ipossia
otteniamo una risposta maggiore. Anche una riduzione piccola del pH (0,05 unità) porta
rapidamente ad iperventilazione. Entrambe le risposte al pH e alla PCO2 sono rapide, a differenza di
quanto accade nei chemocettori centrali.
Riassunto controllo automatico metabolico:
4 Non si ha alcuna modificazione perché la diminuzione della percentuale di O 2 disciolto nel sangue fa aumentare la
frequenza cardiaca. Il consumo di ossigeno nei recettori dunque non si abbassa perché la diminuzione dell'ossigeno
viene compensata dall'aumento della frequenza cardiaca.
1)
2)
3)
4)
5)
chemocettori centrali e periferici
vie afferenti viscero-sensitive: IX e X
centri bulbari
vie efferenti bulbo-spinali: motoneuroni alfa
effettori: mm. inspiratori ed espiratori
Controllo del calibro bronchiale
controllo nervoso:
il contingente parasimpatico bronchiale (broncocostrittore) è costituito da fibre efferenti del
nucleo dorsale del vago, che raggiungono la muscolatura dei bronchi. Il parasimpatico afferente
comprende probailmente i recettori J e i recettori da stimoli irritativi. La liberazione del
mediatore acetilcolina provoca broncocostrizione, per cui questo effetto può essere prevenuto
con la somministrazione di atropina.
la componente ortosimpatica bronchiale (broncodilatatrice) è costituita da fibre pregangliari che
si portano al ganglio stellato e al ganglio cervicale medio, da cui fuoriescono fibre postgangliari che giungono alla muscolatura liscia dei bronchi e dei relativi vasi sanguigni. La
stimolazione simpatica provoca la liberazione di noradrenalina, che va ad agire sui recettori
beta2, con conseguente broncodilatazione. L'uso di beta-bloccanti provoca bronco costrizione.
innervazione non colinergica e non adrenergica, mediata (probabilmente) dal VIP, che ha un
effetto broncodilatatore
A causare broncocostrizione sono anche sostanze ad azione anafilattica e i leucotrieni, la sostanza P
e l'adenosina, ed anche un abbassamento della temperatura provoca broncocostrizione.
È da ricordare che il calibro bronchiale ha un ritmo circadiano che prevede una massima costrizione
verso le 6 ed una massima dilatazione verso le ore 18. Questo spiega perché gli attacchi d'asma
sono molto più frequenti al mattino.
Aggiustamenti respiratori durante l'esercizio fisico
Durante l'esercizio fisico aumenta il consumo di O2
da 250 ml/min a 4000 ml/min
e la produzione di CO2 e calore.
da 200 ml/min a 8000ml/min
È necessario portare più O2 ai tessuti e rimuovere più CO2. La frazione di estrazione di O2 dai
muscoli aumenta
la PO2 scende da 40 a 25 mmHg nel sangue venoso--->più O2 entra in circolo (aumento gradiente)
Il sistema cardiocircolatorio aumenta la gittata cardiaca e aumenta il flusso ematico relativo ai
muscoli.
Da 5,5 l/min a 15-18 l/min (normali) 30-40 l/min (atleti)
Anche la ventilazione aumenta.
Da 6 l/min a 120-160 l/min
Consumo di O2 e carico di lavoro
Esiste un rapporto lineare fra consumo di O2 e carico di lavoro, fino a carichi di lavoro massimali
oltre i quali il consumo di O2 non aumenta più. Il livello del lattato, invece, continua a salire. Il
lattato è prodotto nei muscoli per glicolisi anaerobica poiché la resintesi aerobica delle riserve di
energia non può tenere il passo con la loro utilizzazione. Si contrae quindi un debito di ossigeno: al
termine del lavoro il respiro non ridiscende ai livelli basali finchè non vengono risintetizzati ATP e
fosfocreatina. Il lattato in seguito viene convertito a glicogeno e per un 20% ossidato a livello
muscolare a CO2 e H2O.
Ventilazione e carico di lavoro
Se osserviamo la ventilazione durante lo svolgimento di un esercizio fisico notiamo che: all'inizio
della prova si ha un aumento brusco della ventilazione, dovuto a stimoli psichici e stimoli dei
propriocettori muscolari ed articolari. In seguito la ventilazione aumenta gradualmente fino a
raggiungere un plateau ventilatorio, se l'esercizio non è intenso, altrimenti la ventilazione aumenta
in funzione del tempo, anche se il carico di lavoro rimane costante. Al termine dell'esercizio la
ventilazione subisce una brusca diminuzione (anch'essa dovuta a stimoli di natura psichica e
propriocettiva), per poi diminuire gradatamente.
I fattori che determinano l'aumento della ventilazione sono:
aumento di K plasmatico dovuto ad attività motoria, che stimola i chemocettori periferici
aumento delle fluttuazioni della PCO2 , che stimolano i centri respiratori
sembra essere in gioco anche la PO2, visto che respirando ossigeno puro, la ventilazione si
riduce del 10-20%
L'aumento della ventilazione viene ottenuto con un aumento del volume corrente (da 0,5l fino a 3 l)
e della frequenza respiratoria (da 12 a 50 atti/min). Un'aumentata ventilazione prende il nome di
iperpnea, condizione che va distinta dall'iperventilazione. Per riconoscere se l'accresciuta
ventilazione è definibile come iperpnea o iperventilazione, è sufficiente valutare l'equivalente
ventilatorio del consumo di ossigeno.
Questo parametro è ricavabile dal rapporto V'/V'O (rapporto fra ventilazione e consumo di
ossigeno) e risponde alla domanda: quanti litri vengono ventilati per ogni litro di O2 consumato?
In condizioni di riposo è di 6/0,25 = 24 l / O2. Il suo valore non varia per esercizi moderati, mentre
durante esercizi intensi aumenta: si parla allora di iperventilazione. La quantità d'aria ventilata è
infatti superiore a quella necessaria per le esigenze metaboliche: l'estrazione di ossigeno
diminuisce5.
E così, mentre l'estrazione di ossigeno non comporta spese energetiche (diffusione passiva
attraverso la membrana alveolo-capillare), l'aumentata ventilazione richiede un extra consumo di
ossigeno, che potrebbe essere risparmiato. Gli atleti sono in grado di mantenere il loro equivalente
ventilatorio del consumo di ossigeno per lavori più intensi rispetto a soggetti meno allenati: ciò
produce un risparmio di energie.
Per aumentare la ventilazione è possibile modificare
la frequenza respiratoria, che può passare da 12 atti a 50 atti al minuto. L'aumento della
frequenza è ottenuto, soprattutto negli atleti, con un reclutamento della muscolatura espiratoria.
L'espirazione attiva permette di ridurre la fase espiratoria, che diventa quasi uguale a quella
inspiratoria, aumentano la frequenza.
il volume corrente, che può variare da 0,5 fino a 3 litri. A parità di ventilazione, gli atleti
tendono ad aumentare più il volume corrente che la frequenza respiratoria. Tale comportamento
è più efficace, perché permette di ridurre la ventilazione dello spazio morto. Inoltre l'aumentato
volume corrente ha dei vantaggi anche dal punto di vista dello scambio gassoso. Il rapporto di
diluizione fra volume corrente e aria contenuta nei polmoni aumenta, e ciò consente di avere un
gradiente di PO2 e di PCO2 superiore, che favorisce maggiormente gli scambi (in pratica più
aria “fresca” entra nei pomoni)
Modifiche all'aumento progressivo del carico di lavoro
la ventilazione, come visto, aumenta fino a un plateau
la PO2 arteriosa rimane costante o aumenta di poco
la PCO2 arteriosa rimane costante o diminuisce di poco
il consumo di O2 aumenta linearmente con il carico di lavoro
la produzione di CO2 aumenta proporzionalmente al carico di lavoro
la PO2 tissutale scende
5 L'equivalente ventilatorio del consumo di ossigeno (V'/V'O) è l'inverso dell'estrazione di ossigeno a livello
polmonare. Il consumo di ossigeno (V'O) è dato dal prodotto della ventilazione (V') per la differenza di ossigeno
inspirato ed espirato: V'O = V' (O insp – O esp). Da cui V/V'O = 1/(O insp – O esp)
più CO2 si libera dai tessuti e man mano che scende la PO2 l'emoglobina cede più ossigeno
L'acido lattico che viene prodotto in proporzione al carico di lavoro viene tamponato dalla maggiore
produzione di CO2 - che sostiene l'ipeventilazione (produzione di CO2 e ventilazione aumentano
proporzionalmente, per cui la PCO2 arteriosa e alveolare si modificano di poco: tamponamento
isocapnico). L'iperventilazione produce un aumento della PO2 arteriosa. Un ulteriore accumulo di
acido lattico porta a una ventilazione eccessiva rispetto all'accumulo di CO2 per cui la PCO2
arteriosa scende. La riduzione della PCO2 arteriosa provoca un compenso respiratorio dell'acidosi
metabolica causata dall'eccesso di acido lattico.
Fatica. La fatica è un fenomeno complesso e poco conosciuto. Sembra che contribuiscano
all'insorgere della sensazione di fatica:
impulsi dai propriocettori
affetto dell'acidosi sul cervello
deplezione del glicogeno muscolare
Il senso soggettivo di stanchezza sembra essere collegato al consumo di ossigeno e non al lavoro
effettivo in kgm/min. Le contrazioni prolungate provocano dolore per il rilascio della sostanza P,
che non può essere allontanata finché il muscolo è in ischemia dovuta alla contrazione. Quando il
muscolo si rilascia la sostanza P viene eliminata nel torrente ematico. Il senso di irrigidimento nei
muscoli sembra essere dovuto all'accumulo di liquido interstiziale.
***
Ipossia
L'ipossia è la deficienza di O2 a livello tissutale. Viene distinta tradizionalmente in quattro tipi di
ipossia:
ipossia ipossica, nella quale la PO2 è ridotta
ipossia anemica, in cui PO2 è normale, ma è ridotta l'emoglobina disponibile per il trasporto di O2
ipossia stagnante o ischemica, in cui il flusso ematico è troppo limitato
ipossia istotossica, in cui i tessuti non possono utilizzare l'O2 fornito a causa di agenti tossici
Il primo organo a risentire degli effetti dell'ipossia è il cervello. I neuroni responsabili delle funzioni
più elevate sono più sensibili all'ipossia: una lieve ipossia dà alterata capacità di giudizio,
confusione, eccitamento, disorientamento, perdita della nozione del tempo, cefalea. Talora si
riscontrano anche anoressia, nausea, vomito, tachicardia, ipertensione. Il soggetto iperventila in
maniera proporzionale al grado di ipossia. Un altro segno caratteristico di alcuni tipi di ipossia è la
cianosi, ossia la comparsa di un colorito blu scuro nelle zone dove la cute è sottile (mucosa, lobo
orecchio, letto ungueale). Tale fenomeno è dovuto alla presenza di una quantità superiore di
emoglobina ridotta, che ha un colore diverso dall'ossiemoglobina. È bene notare che in caso di
ipossia anemica non si ha cianosi, poiché il contenuto totale di emoglobina è basso. Non si ha
cianosi nemmeno nell'avvelenamento da CO2 poiché la carbossiemoglobina ha un colore rosso vivo
e maschera il colore dell'emoglobina ridotta. Anche in caso di ipossia istotossica non si ha cianosi,
poiché la quantità di emoglobina ridotta è normale.
Ipossia ipossica
Può essere dovuta all'esposizione a quote elevate, oppure a patologie di tipo respiratorio (fibrosi
polmonare, alterazione del rapporto ventilazione / perfusione, fatica dei mm. respiratori,
pneumotorace) o di tipo cardiaco (shunt artero-venosi, come foro di Botallo aperto).
La PO2 scende salendo in quota: a 3000 metri la PO2 è di 60 mmHg, i glomi vengono stimolati ed
iniziano a far aumentare la ventilazione. L'aumentata ventilazione porta ad abbassamento della
PCO2 e conseguente alcalosi respiratoria. A 3700 m si hanno i primi sintomi ipossici, come
l'irritabilità, e a 5500 m i sintomi diventano seri. Sopra i 6000 m le persone non acclimatate perdono
coscienza (PO2 dell'aria < 40 mmHg). Respirando O2 puro si possono prevenire i sintomi
dell'ipossia. L'unico fattore limitante è la pressione barometrica totale. A 10400 m la pressione
barometrica è di 187 mmHg, per una pressione alveolare di O2 pari a 100 mmHg e PCO2 e PH2O
invariate. Sopra i 14000 m la PO2 scende al di sotto di 40 mmHg anche respirando ossigeno puro,
per cui sopravviene la perdita di coscienza.
L'abbassamento della PO2 è anche il responsabile del cosiddetto mal di montagna. È un malessere
che si sviluppa 8-24 ore dopo l'arrivo in altitudine, dura dai 4 agli 8 giorni e i suoi sintomi sono:
cefalea, irritabilità, insonnia, mancanza di fiato, nausea, vomito. A causa dell'abbassamento della
PO2 arteriosa si può avere un aumento della pressione, che può portare alla trasudazione di liquidi
nel tessuto cerebrale, con conseguente edema. Se il soggetto svolge dei lavori pesanti nei primi tre
giorni dall'arrivo in quota è anche possibile che si sviluppi un edema a livello polmonare.
Il fenomeno dell'acclimatazione è una serie di reazioni che l'organismo mette in atto per permettere
la sopravvivenza in quota. L'iniziale iperventilazione viene limitata dall'alcalosi respiratoria dovuta
alla caduta di PCO2 . L'affinità per l'ossigeno diminuisce (nonostante l'alcalosi) per l'aumento di
produzione di 2,3 bisfosfoglicerato. Aumenta la secrezione di eritropoietina (prima aumenta
prontamente, poi diminuisce un po'), causando policitemia. Aumentano anche il numero di
mitocondri e la quantità di mioglobina presente nei muscoli.
Ipossia anemica
È dovuta alla carenza di emoglobina. Normalmente non si ha alcun sintomo se non nei casi più
gravi (ad esempio se il 2,3 BPG aumenta, la carenza di emoglobina non è sostenibile). Gli individui
affetti da ipossia anemica possono avere delle difficoltà durante l'esercizio fisico.
Ipossia stagnante
Un'ipotensione prolungata può provocare ipossia, per la lentezza della circolazione. L'ipossia
stagnante è tipica del cuore e dei reni in caso di shock. L'insufficienza cardiaca congestizia porta in
ipossia anche il fegato ed il cervello.
Ipossia istotossica
Si osserva nei casi di avvelenamento da cianuro. Il cianuro inibisce le citocromossidasi, impedendo
ai tessuti l'utilizzo di ossigeno. Come antidoti si somministrano nitriti o blu di metilene; questi
formano metaemoglobina, la quale reagisce con il cianuro formando cianmetaemoglobina,
composto non tossico. Ovviamente questo trattamento è limitato dalla quantità di metaemoglobina
che si può formare senza pericolo.
Ipercapnia
L'ipercapnia è la ritenzione di CO2 nei tessuti. Può essere causata da squilibri nel rapporto
ventilazione-perfusione o da inadeguata ventilazione alveolare. Non è frequente in caso di fibrosi,
poiché la CO2 diffonde meglio dell'O2 . I sintomi sono: iperventilazione, sintomi cerebrali come
confusione, ottundimento del sensorio, coma. Si ha acidosi respiratoria, parzialmente bilanciata
dalla produzione di HCO3 da parte del rene.
Ipocapnia
L'ipocapnia è il risultato di un'iperventilazione. Può essere causata da alterazione degli stati emotivi
o da disturbi psichici. La PCO2 arteriosa si abbassa fino a 15 mmHg e la PO2 alveolare si alza fino a
120 mmHg. L'ipocapnia ha effetto costrittorio sui vasi cerebrali; l'ischemia cerebrale causa un senso
di vertigine, confusione. La gittata cardiaca aumenta e i vasi periferici si costringono. Tuttavia la
pressione rimane normale o aumenta di poco, per l'effetto deprimente il centro vasomotore della
CO2 . Altro segno è l'alcalosi respiratoria, che porta a escrezione maggiore di HCO3. L'alcalosi dà
anche tetania6.
6 L'alcalosi dà diminuzione della [H] plasmatica, per cui ioni H si staccano da alcune proteine plasmatiche. Gli ioni H
vengono sostituiti da ioni Ca, per cui – pur rimanendo la quantità di calcio plasmatico invariata – diminuisce il
valore di Ca ionizzato. Ciò causa un effetto eccitatorio su cellule nervose e muscolari (la permeabilità al sodio
cresce): la coneguenza diretta è la tetania.
Perché durante l'esercizio fisico aumenta la concentrazione di potassio?
N2 prodotto?