Reumatologia 20/11/07
h. 8:30-10:30
Prof. Ferraccioli
OSTEOATROSI
E’ la malattia che più frequentemente dà dolore muscolo-scheletrico nella comunità, è un processo
che viene definito infiammatorio-degenerativo: personalmente preferisco definirla come una
malattia nella quale l’infiammazione molecolare si associa all’ infiammazione cellulare. La
caratteristica di questa malattia è che esiste un target ben preciso rappresentato dalla cartilagine, la
quale non è altro che un “cuscinetto” che serve ad attutire tutti gli insulti di tipo fisico durante la
normale mobilità del nostro apparato scheletrico. Una volta colpita la cartilagine, il processo si
estende all’osso subcondrale, il quale subisce le conseguenze di questi ripetuti insulti sulla
cartilagine e alla fine si ha uno scompenso globale dell’articolazione. Se la malattia ha delle
caratteristiche di aggressività particolare, ci può essere il coinvolgimento della membrana sinoviale
che fa emergere la sinovite con l’infiammazione cellulare.
Le caratteristiche cliniche sono dolore, disabilità, deformità, come in tutte le malattie che
colpiscono l’apparato muscolo-scheletrico.
Oltre il 75% dei malati reumatici sono affetti da osteoartrosi.
Si dice che esiste un rapporto preciso tra comparsa dei sintomi legati all’osteoartrosi ed età del pz:
questo perché da un punto di vista strumentale, andando a vedere le RX della popolazione in studi
epidemiologici, è emerso che fra i soggetti >75 aa l’80% ha segni strumentali e radiologici di
osteoartrosi. Che ci sia quindi un incremento notevolissimo di quello che è il danno sulla
cartilagine, che ci sia un importante riflesso negativo sull’osso subcondrale, è dimostrato da questi
dati. Questo è anche il motivo per cui la malattia viene considerata a livello globale come la
principale causa di invalidità cronica nei paesi sviluppati.
I fattori sistemici che aggravano il danno artrosico sono:
L’età, con l’avanzare della quale c’è un progressivo depauperamento della cartilagine
L’obesità, il cui nesso è facile da capire per le articolazioni sottoposte a carico come le
ginocchia e le anche, ma difficile per le mani o le spalle: la spiegazione sta nel fatto che
l’obesità è una malattia infiammatoria, gli adipociti producono cellule dell’infiammazione,
sono una sorta di riserva continua di molecole dell’infiammazione, quindi non fanno altro
che aggravare la malattia sottostante.
Predisposizione genetica, per cui si conoscono intere famiglie dove a un certo punto della
vita insorgono le manifestazioni deformanti tipiche della malattia
Sesso femminile, più colpito rispetto al maschile come quasi sempre nelle malattie
infiammatorie
Malattie endocrine
Dismetabolismi, ad es. dismetabolismo dell’acido urico
Esistono poi dei fattori locali, il più importante dei quali da un punto di vista epidemiologico è il
sovraccarico funzionale e compartimentale a livello delle articolazioni: ad es. soggetti con
varismo delle ginocchia, spesso calciatori, avranno un sovraccarico compartimentale soprattutto sul
lato mediale. Queste situazioni anatomiche finiscono con l’alterare la dinamica articolare, il che
porta a un aggravamento della malattia.
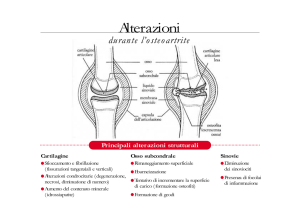
Il danno sulla cartilagine è facilmente evidenziabile con una RX dell’articolazione colpita: c’è un
assottigliamento della cartilagine che si traduce radiologicamente in una riduzione dell’interlinea.
1
Facendo una RM possiamo osservare la caratteristica fibrillazione della cartilagine e alterazioni
della struttura. Quando la cartilagine cede, gli insulti traumatici sull’articolazione finiscono per
riverberarsi sull’osso subcondrale e si formano così i geodi: questi rappresentano delle mancanze di
struttura ossea, provocate dalle microfratture verificatesi in loco, e sono l’elemento caratteristico
dell’artrosi erosiva. Essendoci una frammentazione della cartilagine e dell’osso subcondrale, è
estremamente probabile che parte del materiale possa cadere all’interno dell’articolazione, indurre
un’attivazione dei macrofagi presenti, seppure in piccola quantità, all’interno del compartimento
articolare, e scatenare una flogosi locale, determinando così la comparsa di sinovite. Questo però è
l’aspetto meccanico del processo infiammatorio, una volta che è stata già indotta la frammentazione
di questa cartilagine, ma in realtà la malattia ha come momento primario la cosiddetta
infiammazione molecolare che si verifica all’interno della cartilagine: i condrociti sono malati e
producono più molecole dell’infiammazione che non sono adeguatamente controllate dalle
molecole anti-infiammatorie. La principale molecola che viene prodotta in eccesso dai condrociti è
l’IL-1ß, la quale non viene antagonizzata localmente dal suo naturale antagonista che è l’IL-1R
antagonista.
Come alterazioni biochimiche nella cartilagine artrosica troviamo idrofilia, ossia c’è più acqua:
l’acqua è fondamentale, si aggancia ai proteoglicani e dà elasticità alla struttura della matrice. Nel
momento in cui essa aumenta, mi indica che la cartilagine sta perdendo efficienza dal punto di vista
dell’elasticità, tant’è che alla fine avremo una riduzione dei cross-link tra le molecole di collagene,
un’aumentata estraibilità dei proteoglicani che diventano molto più fragili nelle loro interazioni,
infine una riduzione dell’acido ialuronico e delle proteine di matrice, tra cui l’osteocalcina che serve
a mantenere fisse le varie molecole di proteoglicani e di collagene. Se si fa il confronto tra la
cartilagine senile e quella artrosica, si trova che in molte delle varie alterazioni biochimiche ci sono
sostanziali differenze; con l’avanzare dell’età ci sarà una sovrapposizione delle alterazioni, alcune
modificazioni possono embricarsi e controregolarsi. La malattia emerge quando le alterazioni
biochimiche tipiche della malattia artrosica finiscono con l’avere il sopravvento su quelle tipiche
dell’invecchiamento.
Ripetendo: la cellula malata nell’artrosi è il condrocita, che va incontro all’alterazione delle sue
funzioni, per cui c’è una modificazione della matrice cartilaginea con un eccesso di sintesi della
IL-1ß. I geni che vengono immediatamente indotti sono quelli delle MMP, quindi c’è una
progressiva degradazione della cartilagine stessa mediata dalle MMP. Poi si può sovrapporre una
seconda fase dell’infiammazione, dovuta al fatto che i detriti osteo-cartilaginei che precipitano
all’interno dell’articolazione possono attivare i sinoviociti.
Commenta la quarta slide a pag.2 della presentazione sull’Osteoartrosi disponibile presso Non
Solo Copie: da un punto di vista macroscopico si vede una testa femorale, che normalmente
assomiglia a una palla da biliardo quindi è perfettamente traslucida e liscia, e che in seguito
all’artrosi diventa rugosa, la superficie viene “grattugiata”, c’è una perdita della cartilagine che
dovrebbe rappresentare quella che è la palla da biliardo. Nel momento in cui la cartilagine non
sopporta più gli urti, chi ne risente è l’osso subcondrale, che dovrebbe reagire tentando di ispessirsi,
diventando sclerotico: si parla infatti di osso eburneizzato. Quando c’è tutto quest’insulto, la
cartilagine tenta di reagire costruendo dei micronoduli, che rappresentano il tentativo del condrocita
di rigenerare. Ma si sa che il condrocita ha una vita molto lenta e quindi anche la sua capacità di
rigenerare è molto limitata.
Nella slide successiva si vede una cartilagine che dal punto di vista anatomopatologico presenta
ormai delle alterazioni strutturali: ci sono delle cellule ben stratificate sovrapposte a cellule molto
frammentate da molto contenuto senza matrice ed è stata persa la struttura di sostegno fondamentale
del condrocita, cioè i proteoglicani e il collagene. Se si va a vedere la cartilagine di un pz operato di
protesi, si trova completamente distrutta e sovvertita, soprattutto la struttura delle proteine di
matrice. La perdita di basofilia della struttura attorno al condrocita implica il riassorbimento della
2
struttura dei proteoglicani e se mancano questi ultimi viene persa anche la capacità di aggregare
acqua. In quel caso la cartilagine diviene secca e va facilmente incontro alla frammentazione.
Altra slide: si possono osservare all’istologia delle aree vuote, dei veri “fantasmi cellulari”, che
dimostrano come nella degradazione della cartilagine c’è una perdita in rapporto sia al numero di
cellule sia alla loro funzione.
Nonostante alterazioni di questo genere, l’articolazione tenta di sopravvivere agli insulti fisici a cui
quotidianamente è sottoposta durante il movimento attraverso l’allargamento della superficie
d’impatto, creando i cosiddetti osteofiti: nelle zone che non sono sottoposte a particolari stress di
tipo meccanico, l’osso allarga la superficie di distribuzione del carico con queste strutture, cercando
di distribuire meglio in altre sedi l’impatto dello stress fisico. Ciò porta all’aumento dello spessore
dell’osso subcondrale nelle sedi che non sono oggetto della formazione dei geodi, determinando la
sclerosi dell’osso subcondrale che si verifica proprio sotto quelle zone dove c’è la frammentazione
della cartilagine. Nel momento in cui precipitano i frammenti all’interno del cavo si ha una sinovite
reattiva perché arrivano monociti e macrofagi che vanno a colonizzare la membrana sinoviale:
questa si stratifica progressivamente e vi compaiono noduli di cellule dell’infiammazione cronica.
A quel punto la sinovite diventa cronica e di conseguenza dal punto di vista del processo
infiammatorio si automantiene. A documentare ciò, nella slide a pag.4 (che però nelle fotocopie è in
b/n quindi non è il massimo…) si vede proprio un focus di cellule linfoidi, con linfociti e
plasmacellule: ritroviamo infatti anche B cellule e plasmacellule all’interno di una malattia che in
realtà è poco flogistica come l’osteoartrosi. Nella slide seguente ci sono dei villi formatisi
all’interno della struttura articolare. Quindi la sinovite, quando diventa cronica, è molto simile a
quella presente nell’AR o nell’artrite psoriasica, eccetto che per la pluristratificazione della
membrana sinoviale.
Se tutto parte con la malattia del condrocita che finisce per coinvolgere l’osso subcondrale, in fasi
avanzate possiamo avere questa sinovite cronica che è molto fastidiosa, non tanto per l’aggressività
della proliferazione della membrana sinoviale, come succede nel pz che ha l’AR, ma soprattutto
perché c’è la necrosi dell’osso sottostante la cartilagine, cosa che rende quest’articolazione
estremamente fragile, ossia incapace di reggere il carico che normalmente è in grado di sopportare.
Alla fine insieme alla sinovite avremo piccoli focolai di osteonecrosi che alterano completamente la
meccanica e che finiscono con l’amplificare il processo di degradazione della cartilagine stessa.
Quest’ultima viene infatti nutrita in parte dal liquido sinoviale formato dalla membrana sinoviale
normale, il quale in questo caso sarebbe alterato, e in parte viene nutrita dall’apporto di sostanze che
vengono dall’osso subcondrale: di conseguenza la degradazione originerà sia dall’interno che
dall’esterno.
Nella terza slide a pag.5 si vede la bilancia che oggi si tenta di rimettere in sesto: l’artrosi è una
malattia che porta a un’importante degradazione quindi si sta cercando di capire quali sono le vie
attraverso le quali a questa degradazione si contrapponga un aumento dell’attività sintetica dei
condrociti residui. Questo è oggetto degli intensi studi che stanno facendo le varie industrie
farmaceutiche, alla ricerca di farmaci capaci soprattutto di aumentare la capacità sintetica del
condrocita. Certamente è necessario antagonizzare le molecole proinfiammatorie che sono
enormemente stimolate in loco e trovare la chiave di volta per indurre i condrociti residui a
funzionare in maniera sovrannormale. E’ un po’ l’equivalente di quello che si tenta di fare a livello
del rene laddove c’è l’IR, ossia cercare di utilizzare i nefroni residui in modo da farli funzionare di
più.
Il quadro clinico dell’artrosi delle mani è caratterizzato dalla presenza di nodosità
facilmente riconoscibili, che rappresentano l’iperproduzione di osso che tenta di allargare la
superficie dell’articolazione colpita: i noduli di Heberden sono situati a livello delle IFD,
quelli di Bouchard a livello delle IFP, mentre a livello del pollice c’è la cosiddetta
rizoartrosi, ossia una vera e propria protrusione dell’articolazione trapezio-metacarpale.
Quest’ultimo evento porta a un’evidente deformità della mano a tendenza artrosica, definita
3
appunto “mano quadrata” per questo suo aspetto. Dal punto di vista epidemiologico, l’artrosi
delle mani colpisce di solito donne di mezza età e ha un andamento intermittente nella
maggior parte dei casi. La radiologia dimostra chiaramente la presenza di fenomeni erosivi
che si accompagnano a fenomeni osteoproduttivi. Il pz ha una dolorabilità che in seguito lo
porta alla limitazione funzionale dell’articolazione colpita. Quest’ultima, oltre a presentare
deformità, è pure tumefatta a causa del processo che, evolvendo, determina la comparsa
della sinovite.
In merito all’artrosi dell’anca si deve ricordare che il dolore all’anca compare quando il pz
sale le scale e viene evocato durante la extrarotazione. Quindi per porre il sospetto
dell’interessamento dell’anca, basta chiedere al pz se sente dolore in regione coxofemoraleinguinale durante la salita delle scale, e dal punto di vista semeiologico verificare se durante
il movimento della extrarotazione il pz riesce a portare l’anca a 90° o no, e se non riesce a
farlo bisogna sospettare l’artrosi dell’anca in maniera forte.
Per quanto riguarda l’artrosi del ginocchio il comportamento è diverso: infatti il pz sente
dolore alla discesa delle scale e quando flette il ginocchio. Molto spesso comprimendo la
rotula contro i condili femorali sentiamo dei veri e propri scrosci articolari, i quali sono
direttamente proporzionali all’entità della degradazione della cartilagine sottopatellare. A
quel punto va fatta una RX a supporto della diagnosi e eventualmente un’ecografia per
vedere se c’è versamento. Questo può essere in realtà identificato anche con la sola
semeiotica, grazie al segno del ballottamento rotuleo.
Nell’artrosi cervicale il pz ha difficoltà nella rotazione laterale e nella flessione del collo e
ciò è dovuto alla presenza di osteofitosi a livello delle articolazioni uncovertebrali che sono
quelle che consentono il movimento della flessoestensione.
Nell’artrosi lombare, le articolazioni più colpite sono quelle posteriori, le interapofisarie, e
bisogna cercare di verificare se cosesiste con la spondiloartrosi anche l’interessamento del
disco, perché potrebbe esserci concomitantemente un buldging discale o un’ernia discale.
Perciò è necessario sempre ricercare semeiologicamente i segni della cruralgia e della
sciatalgia.
Nel sospetto di artrosi nelle RX bisogna cercare:
la riduzione della rima articolare, perché è espressione diretta del riassorbimento della
cartilagine
l’ampliamento della superficie di carico attraverso l’allargamento osteofitario
la presenza di irregolarità del margine osseo con l’eventuale sclerosi sottocondrale
talvolta calcificazioni periarticolari, formati da depositi di pirofosfato di calcio o di
idrossiapatite
la tumefazione dei capi articolari come già visto a livello dei noduli, espressione della
sinovite che li accompagna
Nella prima slide a pag.7 si vede l’RX di un’articolazione coxo-femorale: si osserva l’interlinea
molto ridotta a livello della testa femorale ma ciò che balza agli occhi è la sclerosi dell’acetabolo,
dimostrazione del fatto che l’osso sta tentando di reagire all’insulto. L’altra cosa che compare è un
piccolo tetto osteofitario ma soprattutto la presenza di un geode ormai fissurato e che ha lasciato lì
probabilmente il tessuto sinoviale e il liquido intrarticolare.
4
A seguire RX di un classico ginocchio artrosico: l’interlinea è completamente sovvertita, ci sono
osteofiti a livello delle spine tibiali, c’è dell’osso aggiuntivo, la cartilagine praticamente non esiste
più e c’è un’importante sclerosi. Questo ginocchio a livello semeiologico avrà degli scrosci
importanti e sarà destinato, con l’avanzare del tempo e la progressione del danno, ad andare
incontro a una sostituzione protesica poiché non riuscirà più a flettersi.
RX della colonna: presenza di grossolani osteofiti, ben diversi dai sindesmofiti visti nelle
spondiloartriti sieronegative.
Nel momento in cui abbiamo la diagnosi clinica e quella radiologica, dobbiamo avere delle altre
informazioni a livello di imaging: questo perché se ad es. c’è una sinovite, dobbiamo conoscerne
l’entità e sapere se è penetrata all’interno dell’articolazione, come succede nell’AR cronica o
psoriasica. A quel punto può essere utile la RM. Questa infatti permette intanto lo studio diretto
della cartilagine, ma soprattutto permette di capire quanto danno c’è all’osso subcondrale, vedere la
presenza di edema osseo e di lesioni meniscali e legamentose non visibili invece con l’RX. Quindi
abbiamo informazioni dirette e più complete, soprattutto a livello del ginocchio, anche su quelle
strutture non dimostrabili da un punto di vista radiologico.
Sotto il profilo biochimico nell’artrosi si osservano modestissimi incrementi delle proteine della
fase acuta come la PCR, e nei soggetti che hanno la sinovite c’è la possibilità di andare a vedere
attraverso dei marker di turnover cartilagineo quanto sia il riassorbimento all’interno
dell’articolazione. Il liquido sinoviale è poco cellulato, come in tutte le flogosi croniche a bassa
intensità.
Dal punto di vista terapeutico a parte l’educazione e l’esercizio fisico per cercare di mantenere
sempre lubrificata l’articolazione colpita, bisogna cercare di ridurre il danno nel tempo: le terapie
termali fin dal tempo degli antichi romani sono sempre state molto utilizzate in queste patologie.
Loro scopo è di mettere il pz in un ambiente rilassante in modo da farlo ritemprare a livello
generale, ma soprattutto perché con l’apporto di calore, sia con l’idroterapia che con la
peloidoterapia (NdR fangoterapia), si può aumentare, tramite il maggiore flusso ematico, l’apporto
di sostanze che servono alla crescita e alla funzione del condrocita. Però in generale la terapia vera
si fa con i farmaci: analgesici, FANS e farmaci ad azione sintomatica lenta. Questi ultimi
dovrebbero servire a stimolare il condrocita a sintetizzare più matrice, più proteoglicani, più fibre
collagene e quindi a ridurre l’ipercatabolismo della cartilagine stessa. I quattro farmaci più utilizzati
a oggi sono condroitin-solfato, glucosamina-solfato, diacereina, S-adenosil-metionina: nessuno di
essi è risolutivo, il farmaco realmente efficace per l’artrosi deve ancora essere trovato, ma questi
sono quelli usati soprattutto per l’artrosi del ginocchio.
Esiste poi un importante ruolo della terapia locale: corticosteroidi iniettati localmente, che
servono a spegnere la sinovite quando c’è, e viscosupplementanti cioè farmaci immessi all’interno
dell’articolazione per aumentare il processo della lubrificazione articolare. I viscosupplementanti
sono in genere tutti a base di acido ialuronico, il quale sappiamo essere nettamente diminuito nella
cartilagine artrosica e che è fondamentale per fare da backbone alla struttura idrofilica della
cartilagine; quindi la viscosupplementazione serve ad immettere una sostanza che faccia aumentare
la lubrificazione della cartilagine che si sta reidratando. Questi farmaci sono stati inizialmente
testati nei cavalli da corsa che, proprio perché sottoposti ad allenamenti stressanti, vanno spesso
incontro a una forma di artrosi da usura. Per il riflesso economico che ciò comporta è stato
necessario tentare di migliorare questo processo di artrosi accelerata e da lì sono diventati dei veri
animali da esperimento per questi farmaci. Ognuno si è dimostrato efficace a livello di
rallentamento della progressione di malattia e da quando hanno funzionato in medicina veterinaria
sono poi stati introdotti anche per l’utilizzo sull’uomo.
5
Luigi: “I corticosteroidi non potrebbero accelerare il processo di degradazione ossea?”
Prof: “I cortisonici utilizzati per via intraarticolare hanno degli eccipienti microcristallini in
notevole quantità proprio per cercare di farli rimanere il più possibile all’interno dell’articolazione.
Quindi ci si è sempre chiesti se in una sinovite a bassa aggressività flogistica fosse utile introdurre
una sostanza che poteva localmente poi indurre una reazione flogistica secondaria. La cosa
principale è fare un’iniezione di steroide solo quando si è assolutamente certi che siamo in fase
acuta sinovitica. Se invece si fa l’iniezione in un’articolazione secca, dove c’è degradazione ma
senza reazione sinovitica, il rischio è fondato. In quel caso allora l’unica possibilità è utilizzare
degli steroidi che non siano cosiddetti “depot” (cioè quelli che sono a lento rilascio proprio perché
hanno quegli eccipienti microcristallini). Si può usare ad es. il 6-metil-prednisolone intramuscolo
ma cmq è buona norma non fare terapia infiltrativa con cortisonici se l’articolazione non è
sinovitica. Gli steroidi ad ogni modo sono utili proprio per spegnere la sinovite perché non possono
spegnere l’infiammazione molecolare propria della malfunzione del condrocita; bisognerebbe fare a
priori una valutazione clinica e eventualmente anche ecografia per dimostrare che c’è
l’infiammazione. L’infiltrazione di un’articolazione si fa di solito una volta al mese per non più di
tre infiltrazioni all’anno, perché altrimenti c’è il rischio che insorgano tutti gli effetti negativi della
terapia steroidea: questa ha infatti potenti effetti antinfiammatori, ma quando sono in eccesso
diventano di tipo catabolico, per cui il processo catabolico-degradativo potrebbe accelerare come
progressione e estendersi all’osso subcondrale.
CORTICOSTEROIDI
Nella seconda slide a pag.1 c’è un elenco presentato qualche anno fa in una review sui farmaci
immunosoppressori sul NEJM: i corticosteroidi sono al primo posto. I corticosteroidi sono quindi i
più potenti farmaci antinfiammatori e immunosoppressori che abbiamo a disposizione. Ecco perché
di corticosteroidi in reumatologia non possiamo fare a meno. Il problema è la durata del trattamento
steroideo.
Questi farmaci vengono impiegati in tutte le situazioni infiammatorie acute o croniche e nelle
reazioni immuni, nella pratica clinica soprattutto nelle artriti croniche e nelle COPD, oltre che nelle
malattie ematologiche.
Tra i loro effetti vi è sia l’incremento della trascrizione genica, sia il decremento della stessa: sulla
quarta slide ci sono tutte le molecole che vengono indotte e tutte quelle che invece vengono
represse. Da un lato abbiamo l’aumento della trascrizione genica del gene della lipocortina,
dell’angiotensinogeno, dell’IL-1R antagonista, dell’IL-10, della proteina di trasporto del Na,
dell’osteoprotegerina, quindi tutta una serie di induzione di geni importantissimi per varie malattie
di interesse reumatologico. Dall’altro lato abbiamo una serie di effetti inibenti su molecole
coinvolte nel processo infiammatorio sia locale che sistemico, sia tissutale che endoteliale, come
l’IL-1, IL-2, etc. Bisogna ricordare però che l’utilizzo degli steroidi porta sempre a una depressione
dell’asse ipotalamo-ipofisi-surrene e questo va tenuto maggiormente presente ogni volta che un pz
ha una malattia che da un punto di vista terapeutico lo espone a un trattamento con steroidi > 3
mesi.
I cortisonici più utilizzati nella pratica clinica sono prednisone, betametasone e desametasone,
metilprednisolone, triamcinolone e tanti altri usati per le COPD e per malattie dell’apparato GI. Il
prednisone è il Deltacortene, che è il più utilizzato in assoluto nella pratica clinica, poi c’è il
metilprednisolone che è il Medrol, anch’esso molto utilizzato, il triamcinolone è il Kenacort, usato
nelle terapie infiltrative, il betametasone si chiama Bentelan ed è uno dei più utilizzati nelle malattie
dell’apparato respiratorio, infine il desametasone è il Decadron o Soldesam, usato in tutte le
6
situazioni di edema cerebrale. Li distinguiamo perché ognuno va considerato in rapporto alla
propria potenza d’azione (bisogna sapere che 1 mg dell’uno equivale a tot dell’altro). Ancora più
importante è conoscerne la durata d’azione: ad es. betametasone e desametasone hanno un’emivita
di 36 h, mentre il metilprednisolone di 6, e questo è importante per il riflesso sull’asse ipotalamoipofisi-surrene.
La struttura dello steroide è importante per gli effetti che dà a livello genico, mediati dall’aggancio
al suo recettore.
Di fronte a una pletora di molecole che vengono indotte e altre che vengono soppresse, è logico
aspettarsi tutta una serie di effetti: abbiamo una marcatissima depressione di sintesi di cellule
eosinofile da parte delle cellule mieloidi, una diminuzione dell’attivazione dei linfociti T, delle mast
cellule, della sintesi delle citochine, della presentazione dell’Ag da parte delle cellule dendritiche,
etc. Quindi tutta l’immunità innata viene progressivamente depressa dalla terapia steroidea e ciò
significa che gli steroidi sono le sostanze che facilitano maggiormente la comparsa di infezioni.
Le conseguenze cliniche di tutti gli effetti che ci sono sui geni da parte degli steroidi sono (nella
quarta slide a pag.2 c’è l’elenco di tutte le proteine e gli enzimi interessati e i riflessi sugli effetti
collaterali):
diabete
atrofia muscolare
ipertensione
ipocaliemia
ritenzione idro-salina
glaucoma
osteoporosi
broncodilatazione
effetto antinfiammatorio
Tutte queste sono possibili conseguenze che vanno tenute presenti quando prescriviamo una terapia
steroidea , soprattutto se > 3 mesi.
La somministrazione dello steroide può avvenire per os a piccole dosi, se voglio ottenere una
risposta antiflogistica lenta (ma quanto più a lungo somministro queste piccole dosi tanto più ho la
possibilità di provocare una depressione dell’asse!!!), oppure posso utilizzarlo a boli cioè in grandi
quantità per un periodo limitato di tempo. La somministrazione per os a piccole dosi la utilizzo
quando prevedo che il pz possa ottenere un effetto antinfiammatorio in tempi lunghi, quando non
c’è urgenza nell’intervento terapeutico; invece in un pz con un attacco asmatico importante, o che
ha una cerebrite di tipo lupico, o una forma di vasculite dell’arteria temporale che può mettere a
repentaglio il visus, ho bisogno di avere effetti maggiori in tempi più brevi.
Quinta slide: rapporto tra effetto genomico e non genomico della terapia steroidea. Gli steroidi ad
alte dosi hanno un primo effetto non genomico sulle cellule bersaglio della loro azione, non tanto
sul DNA quanto sui canali di membrana, quindi modificano la funzione della cellula in tempi
rapidissimi. Quando invece l’effetto è genomico, c’è un’interferenza con l’espressione genica e il
blocco della sintesi proteica, che è un fenomeno più lento. Posso perciò sfruttare da un punto di
vista di dosi questi due diversi effetti. Se utilizzo 250 mg in equivalenti di prednisone ho l’effetto
non genomico, che sfrutto nell’immediato, e anche quello genomico; con 7.5 mg ho invece
pochissimo effetto non genomico e tantissimo genomico. E’ stato però valutato che andare oltre i
250 mg di prednisone o equivalenti di prednisone è inutile: questo perché tutto l’effetto che si
utilizza con 250 mg è il massimo di effetto non genomico raggiungibile e oltre quella dose non
abbiamo miglioramenti a livello di effetti sia genomici che non. C’è però un’eccezione: nella
pratica clinica dagli inizi degli anni 90, soprattutto quando si è trattato di controllare il rigetto acuto
renale, sono stati introdotti i cosiddetti boli di cortisone, i quali erano fatti da 1 g di
7
6-metilprednisolone. Questo dosaggio era stato estrapolato in maniera del tutto fortuita: un
neurologo statunitense, non sapendo cosa fare, ha provato in una condizione di rigetto acuto in un
pz trapiantato a fare immediatamente questa terapia. Ha funzionato talmente bene che ha proseguito
con questo farmaco per altri 2 gg e alla fine è diventata prassi comune utilizzare 3 boli consecutivi
di 6-metilprednisolone per tentare di controllare le situazioni iperacute. Da quel momento su Lancet
è apparso un articolo in cui si sottolineava proprio l’efficacia dell’uso di questi boli in tutte le
situazioni critiche, come le cerbritiche, le vasculitiche, le nefritiche acute, etc.
Tornando agli effetti collaterali, vediamo cosa fare quando questi si verificano: si sa che lo steroide
è un potente induttore della gluconeogenesi e questo provoca a lungo termine diabete, con tutte le
conseguenze CV. Perciò se durante la terapia il pz inizia a presentare incremento della glicemia,
bisogna metterlo a restrizione calorica. Se poi il pz è anziano (>80 anni però capisco leggendo la
slide), attenzione alla somministrazione di ipoglicemizzanti orali come le biguanidi, meglio
utilizzare altri tipi di ipoglicemizzanti orali, cmq sempre necessari per prevenire questo diabete
iatrogeno.
Prima slide a pag.3: teniamo presente sempre che il rapporto tra farmaco steroideo e effetto
collaterale è proporzionale alla potenza del farmaco stesso (vedi i vari esempi).
Riguardo all’iperglicemia sappiamo che a una dose prolungata oltre i 3 mesi da 1 a 7.9 mg
equivalenti di prednisone, il rischio di iperglicemia aumenta dell’80% e questi sono dei calcoli che
si possono fare con facilità in ambulatorio. A una dose di 25 mg/die, che è una di quelle che si usa
tranquillamente nel pz con PMR e in fase di mantenimento dell’Arterite Temporale, il rischio
relativo aumenta di 7 volte. Quindi non dimentichiamoci che si può programmare la comparsa degli
effetti collaterali.
Un altro effetto collaterale molto temuto è l’atrofia muscolare: ci sono evidenze sperimentali che
una terapia con ACE-inibitori e supplementazioni di Ca++ e Mg++ riduce moltissimo l’atrofia
muscolare in soggetti sottoposti a terapia steroidea prolungata. Quando c’è atrofia della cute con
possibile porpora, fragilità, assottigliamento, bisogna cercare di ridurre l’atrofia del cheratinocita
attraverso inibitori della calcineurina.
Quando compaiono ipertensione e dislipidemia da steroidi si utilizzano ACE-inibitori ed
eventualmente diuretici, in modo da ridurre la ritenzione idro-salina e migliorare la performance del
muscolo cardiaco.
Quando si dà prednisone per > 3 mesi a 5 o più mg/die, una delle complicanze più frequenti è
l’osteoporosi: perciò il pz deve iniziare SUBITO E SENZA ASPETTARE L’ESITO DELLA MOC
la terapia osteoprotettiva con Ca++ e vit D (e eventualmente con bisfosfonati se il soggetto è in
postmenopausa). Relativamente alle dosi di cortisonici associate alla comparsa di osteoporosi, lo
0,9% (circa 1 su 100) della popolazione generale riceve terapia cortisonica per più di 3 mesi, il
2,5% degli anziani prende steroidi per un periodo > 3 mesi e 2.5 mg/die di cortisone aumentano il
rischio di fratture di circa il 55% mentre il rischio di frattura aumenta notevolmente nei primi 6-12
mesi di terapia. Non trattare con farmaci osteoprotettivi pz che fanno terapia steroidea, anche se con
dosi modeste, per 6-12 mesi è delittuoso…
Un’altra importante complicanza è la cataratta: questa patologia aumenta con l’età e si sviluppa
nell’arco di 2 anni in pz che prendono 5 mg/die di cortisone. Se ricordiamo che pz con PMR o
arterite temporale fanno terapie che vanno ben oltre i 18 mesi, questi sono tutti candidati a avere
cataratta, quindi è assolutamente necessario prevenirla.
Per cui quando devo fare una terapia prolungata e posso di conseguenza prevedere la comparsa di
un effetto collaterale, devo mettere in atto tutte le strategie che me lo riducano al minimo. Ancora
8
oggi purtroppo tutto ciò viene disatteso: non c’è mai da parte del medico la presa di coscienza della
possibilità di contrastare gli effetti negativi dello steroide.
In prospettiva nel futuro la possibilità di antagonizzare tutte queste complicanze dello steroide è
rappresentata da una molecola endogena detta MIF, prodotta a livello dell’ipofisi ma anche del
macrofago attivato. Viene sintetizzata perché induce infiammazione, di cui si serve il macrofago,
cellula dell’immunità innata. Contemporaneamente però è in qualche modo un trasmettitore
endocrino essendo prodotta dall’ipofisi. Il ruolo del MIF sarebbe di antagonizzare in maniera
elettiva tutti gli effetti dei cortisonici, non solo a livello delle varie strutture tissutali ma anche a
livello dei geni dell’infiammazione. Quindi durante l’infiammazione il macrofago sintetizza il MIF
già per antagonizzare quella che potrebbe essere la risposta antinfiammatoria messa in atto dal
surrene. Inibisce l’induzione dell’espressione dell’IB, che è il naturale antagonista dell’NFB, e ha
anche altre azioni: è un vero e proprio controregolatore dell’attività dello steroide. Se lo inseriamo
nella bilancia fisiologica fuori dal processo infiammatorio, il MIF blocca tutti gli effetti negativi
sulle cellule muscolari, ossee, etc indotte dai glucocorticoidi. Si sta oggi cercando di capire se può
essere sintetizzata una molecola che abbia gli stessi effetti del MIF a livello delle cellule non
infiammatorie, in modo da sfruttare la controregolazione degli steroidi senza indurre gli elementi
dell’infiammazione che il MIF è in grado di indurre sui geni delle molecole dell’infiammazione.
La dose sostitutiva in equivalenti di prednisone tranquillizzante nella pratica clinica in un pz con
ipofunzione surrenalica come un Addison o un infarto emorragico a entrambi i surreni a seguito di
una APS è di 7.5 mg. Questa corrisponde alla dose più bassa utilizzata nelle malattie infiammatorie
croniche e ci porta a dire che, utilizzando una dose fisiologica di steroide in un pz che però non è in
condizioni fisiologiche ma infiammatorie, essa finisce per esercitare una serie di effetti catabolici
che vanno ben oltre la normale sopportazione fisiologica. Questo indica che il limite tra il
fisiologico e l’effetto patologico dello steroide è ridottissimo. Quindi c’è una soglia minima oltre la
quale lo steroide finisce per sortire effetti di tipo catabolico ed è proprio in quella fase che noi
sfruttiamo l’effetto antinfiammatorio. Questo ci permette di dire che quando vogliamo fare una
terapia steroidea, dobbiamo sfruttare al massimo gli effetti antinfiammatori per un periodo
brevissimo ma avere a mente che dobbiamo sostituire il più presto possibile la terapia steroidea con
farmaci capaci di risparmiare steroide per non incorrere negli effetti collaterali. Da un punto di vista
strategico inoltre il concetto dei 3 mesi diventa fondamentale, perché se ho una malattia cronica
come la COPD, l’artrite, il lupus, la vasculite, dove immagino che la terapia sia prolungata oltre i 3
mesi, devo pensare alla comparsa di effetti collaterali, di cui i più comuni sono in ordine di
frequenza: osteoporosi, cataratta, ipertensione e ritenzione idrosalina.
IMMUNOSOPPRESSORI
Sulla prima slide a pag.1 c’è una figura che riassume i principi immunologici fondamentali di
presentazione dell’Ag. Il principale farmaco utilizzato per deattivare le cellule T autoreattive è il
MTX. Esso è un antifolico ed è il farmaco àncora per l’AR e tutte le artriti. Di solito quando
facciamo terapia di una malattia cronica partiamo col MTX e eventualmente ne aggiungiamo altri.
La dose normalmente usata in clinica è di 0.1-0.3 mg/kg/settimana con recupero o meglio
antagonismo della sua tossicità attraverso la somministrazione di 5 mg di acido folico 24 h dopo.
0.1 mg è la dose iniziale per la prima settimana, poi si passa a 0.2 alla seconda, 0.3 alla terza poi
resta questa dose per tutto il mantenimento se il pz lo tollera bene. Effetti collaterali maggiori:
nausea e cefalea. Se il pz non tollera l’escalation del dosaggio, mantiene la terapia al dosaggio
meglio tollerato, ma in quel caso è molto più frequente che si debba fare una terapia di
combinazione, perché la dose più efficace è 0.3. L’azione del MTX è quella di bloccare la DHFR,
che è fondamentale per il metabolismo dell’acido folico. La supplementazione dell’acido folico 24
9
h dopo consente di spegnere tutta l’attivazione del metabolismo dell’acido folico che avviene a
livello delle cellule attivate, senza andare incontro agli effetti collaterali dovuti a una deprivazione
completa di acido folico nel tempo.
Potenti effetti favorevoli antinfiammatori:
riduzione della proliferazione linfocitaria B
riduzione della produzione spontanea di FR-IgM
riduzione della sintesi di IgM naturali (depressione delle risposte primarie dell’immunità
umorale)
riduzione della chemiotassi e della produzione di ossidoradicali (anche le cellule innate
possono essere compromesse nella loro capacità di difenderci)
riduzione in vitro dell’attività dell’IL-1
riduzione della proliferazione di cellule endoteliali sia basalmente che sotto stimolo
inibizione dell’angiogenesi
inibizione attività collagenasi e serinproteasi
A oggi il MTX è il più efficace farmaco che permetta il risparmio di terapia steroidea. Tutte le volte
che si ha un programma di terapia steroidea > 3 mesi, è buona norma tentare di inserire il MTX.
Il MTX è stato confrontato con tanti altri farmaci e nella slide sono elencati vari trial che hanno
dimostrato che, rispetto a tutti gli altri farmaci usati nella terapia delle malattie croniche, il MTX se
la cava in maniera egregia ma, proprio per gli effetti visti prima, la terapia prolungata e cronica con
MTX, soprattutto se purtroppo il pz ha bisogno di terapia cortisonica a lungo nel tempo, espone il
soggetto in terapia di combinazione al rischio di polmoniti da Pneumocystis, da Nocardia, da
Criptococco, Zoster generalizzato e eventualmente una malattia linfoproliferativa, intesa come
LH o LNH, che per fortuna regredisce alla sospensione del trattamento.
Caso clinico: pz 74 aa, F, con malattia aggressiva, in terapia con MTX. Nell’arco di 3 mesi
sviluppava linfoadenomegalia prima laterocervicale, poi sovraclaveare e ascellare; sottoposta a
biopsia midollare e linfonodale, si riscontrava un linfoma a grandi cellule. La prima cosa che di
solito si fa davanti a un linfoma a grandi cellule è la chemio ma, sapendo che la malattia
linfoproliferativa può essere indotta dalla somministrazione del MTX che va a abbassare nettamente
l’immunosorveglianza, con il consenso della signora e dei parenti abbiamo sospeso il MTX e tutte
le altre terapie che potevano essere immunosoppressive e osservato l’andamento. Le possibilità
erano o l’aumento delle linfoadenomegalie, con peggioramento dell’anemia e della leucopenia, o la
riduzione delle stesse. Nell’arco di 6 mesi le linfoadenomegalie sono scomparse completamente e al
controllo della biopsia midollare non c’era più traccia del linfoma.
Il MTX è un potentissimo antinfiammatorio ed immunosoppressore, ma toglie la sorveglianza
immunologica e ciò può far emergere dei cloni che si possono espandere con più facilità. Quando si
sospende il farmaco, c’è il recupero della sorveglianza immunologica. La nostra azione terapeutica
sulla pz suddetta è avvenuta sulla base della consultazione della letteratura, in cui ci sono una
decina di casi che mostrano come il 50% dei pz che hanno la comparsa di linfoma sotto terapia con
MTX, sospeso in tempo utile, hanno avuto un guadagno dell’immunosorveglianza e la scomparsa
della malattia.
Un altro effetto collaterale del MTX è la polmonite da ipersensibilità, a cui bisogna pensare ogni
volta che nel soggetto in terapia con il farmaco compare una polmonite acuta. In realtà è una
patologia che può avvenire per effetto di qualunque farmaco, anche di un banale diuretico. Si
presenta con febbre, tosse, dispnea acuta, presenza di infiltrati interstiziali che possono somigliare a
una ARDS. Al BAL presenta nel 50% dei casi le caratteristiche dell’alveolite eosinofila, la quale è
la più aggressiva delle malattie infiammatorie che colpiscono l’alveolo, molto più raramente si
10
riscontra un’alveolite linfocitaria che ha invece un andamento molto più favorevole. Ancora oggi il
40% dei pz che mostrano polmonite da ipersensibilità da MTX finisce in terapia intensiva.
Altri effetti collaterali del MTX:
può far aumentare la fibrosi interstiziale in un pz che ha già polmonite interstiziale, la quale
peraltro è una delle manifestazioni extrarticolari dell’AR
alopecia, rash, fragilità dei capelli
cefalea, vertigini, etc
Nonostante la numerosità degli effetti collaterali, MTX è cmq un farmaco molto utilizzato perché,
nell’ambito di tutti gli immunosoppressori aspecifici, è quello col più alto indice di sopravvivenza
farmacologica (significa che se lo do a 100 persone persiste nella sua efficacia per il periodo più
prolungato possibile). Circa il 65-70% dei pz può continuare oltre il 5°-10° anno la terapia con
questo farmaco.
Seconda slide pag.3: il suo vantaggio come efficacia terapeutica è dimostrato da uno studio
pubblicato su Lancet nel 2002 che mostra il rischio di mortalità, in genere per cause CV, in pz con
malattia infiammatoria trattati con MTX: la sua somministrazione prolungata riduce in maniera
significativa la morte per malattie CV indotta dalla malattia infiammatoria, molto di più rispetto alla
Sulfasalazina, D-Penicillamina, Idrossiclorochina (la quale è pure un farmaco eccellente dal punto
di vista di protezione CV).
Terza slide: prima di dare MTX bisogna conoscere vari dati che ci permettono poi di monitorare nel
tempo gli effetti collaterali, soprattutto attenzione all’aumento della creatinina e alla riduzione del
filtrato perché il MTX è eliminato per via urinaria e se si dovessero verificare questi ultimi eventi si
avrebbe il rischio di tossicità midollare da MTX. E’ necessario peraltro sapere se il pz è portatore di
una polmonite interstiziale perché essa può indurre un peggioramento della fibrosi.
Quarta slide: in merito al follow-up, bisogna fare ogni 15 gg una volta ogni 3 mesi all’inizio e poi 1
volta al mese la valutazione della funzionalità renale, dell’emocromo, dell’apparato respiratorio.
Se il pz presenta neutropenia, bisogna sospendere il MTX, somministrare 120 mg di acido folico 4
volte/die e se i PMN sono < 500/mm3 dare i fattori di crescita. Inoltre bisogna dare antibiotici se
compare la febbre da leucopenia (che si osserva ogni volta che un pz fa chemio o
immunosoppressori).
La ciclosporina è il farmaco d’elezione per i trapiantologi, perché riduce notevolmente
l’attivazione della T cellula agendo sull’asse CD3-CD28. E’uno dei farmaci che può sostituire la
terapia steroidea in tutti i soggetti < 50 aa con malattie infiammatorie croniche, ma ha degli effetti
collaterali importanti: ipertensione, riduzione del filtrato glomerulare, nefropatia interstiziale,
gastrotossicità, trombofilia, dislipidemia, stomatotossicità, carcinogenesi.
L’ipertensione compare perché la CsA induce iperattività adrenergica quindi a livello delle
terminazioni, soprattutto a livello renale, c’è un forte aumento della sensibilizzazione adrenergica.
Inoltre aumenta l’espressione di End-1, la quale è uno dei principali vasocostrittori; di conseguenza
aumenta la vasocostrizione arteriolare, a seguito della quale compare vasodilatazione periferica, e a
livello renale c’è ritenzione idrosalina. La riduzione del filtrato e l’aumento della pressione sono i 2
effetti più temuti del trattamento con CsA in acuto. In cronico invece la CsA inibisce l’espressione
di COX-2 nel mesangio, continua a far aumentare l’espressione di End-1, aumenta l’attivazione del
RAAS, aumenta l’espressione del TGF- il quale aumenta l’indice di apoptosi a livello delle
singole cellule tubulari e mesangiali renali, insomma alla fine di tutto induce fibrosi del nefrone.
Alla luce di ciò come si spiega l’utilizzo per indurre tolleranza nel rene? Bè, nel momento in cui
controllo il rigetto, pur rischiando di andare incontro a un peggioramento della funzione del rene
trapiantato, cmq lo faccio mantenere. C’è la possibilità di antagonizzare molti effetti collaterali
11
come l’ipertensione e la ritenzione idrosalina da riduzione del filtrato, ma non si può controllare la
fibrosi del nefrone tranne che con gli ACE-inibitori.
La CsA ha anche neurotossicità nel 40% dei casi e la complicanza più grave è una
leucoencefalopatia posteriore che si manifesta con cefalea, disturbi cognitivi, disturbi del visus,
ipertensione, crisi comiziali quindi con manifestazioni analoghe all’ipertensione maligna (d.d!!!).
Altro possibile effetto della CsA è la trombofilia: il danno endoteliale è dovuto a una riduzione della
sintesi di PGI2, aumento della sintesi di TXA2, aumento della funzione e dell’aggregabilità
piatrinica indotta da Ser.
Le linee guida per l’utilizzo della CsA sono: dose 3-5 mg/kg a seconda della tollerabilità del pz.
Quando faccio la valutazione pre-utilizzo non devo mai andare oltre il 30% di riduzione del filtrato
glomerulare; se riesco a mantenere il controllo della flogosi senza andare oltre una riduzione del
30% del filtrato, riesco a prevenire la fibrosi del nefrone. Ciò ovviamente non vale in trapiantologia,
perché lì m’interessa mantenere il trapianto, quindi si va ben oltre questo 30%.
FANS
Quando il pz ha dolore, i FANS vanno sempre utilizzati. Tra le 104 molecole a disposizione, la
scelta del farmaco appropriato va fatta secondo le linee della EBM, quindi esclusivamente
sull’esperienza del medico.
L’indometacina, un potente COX-1 inibitore, è ancora oggi il più efficace FANS nel controllo di
tutte le sintomatologie artritiche a livello della coxofemorale (coxalgia).
Il diclofenac, COX-1/COX-2 inibitore, è anch’esso potentissimo, gravato da effetti collaterali
soprattutto a livello di epatotossicità, ed è il FANS più venduto in Europa e in buona parte del
mondo. Anche l’ibuprofene è un ottimo FANS. Tra i FANS c’è uno spettro che va dai COX-1
selettivi ai COX-2 selettivi, e si è fatta molta propaganda nell’innovazione farmacologica e
farmacoterapeutica dei COX-2 inibitori. Questi ultimi da un punto di vista pratico sono utilizzati in
circa il 40% delle situazioni cliniche, mentre il resto è ancora dominio dei COX-1 inibitori.
Posologie dei 3 farmaci suddetti, che sono i più usati in clinica e peraltro sono farmaci da banco
quindi di facile reperibilità: indometacina 50-150 mg/die , diclofenac idem, ibuprofene 1200-2400
mg/die. Altri sono naprossene, piroxicam, rofecoxib, etc
Il ruolo dell’aspirina (ASA) come antinfiammatorio è diminuito molto d’importanza da quando è
stata messi in commercio la moltitudine di FANS. Per avere un efficace effetto antinfiammatorio
bisogna usarne dosi di 4-8 g/die ( cfr con uso molto più frequente come antiaggregante a 75-325
mg/die) che sono molto alte e possono dare salicilismo, quindi sono poco tollerate nell’adulto. Il
bambino invece ha una capacità notevole di tollerabilità dell’ASA, per cui le dosi equivalenti per il
bambino possono essere utilizzate soprattutto in caso di reumatismo articolare subacuto e
reumatismo postinfezione streptococcica.
Il Prof dice che si dovrebbe tenere seminario su un caso-clinico con la partecipazione anche dei
Prof. Bassi, Ghirlanda e Capelli ma a oggi (30/11) non si è saputo ancora nulla riguardo alla
data…
Esame: 30 quiz + orale, dalla media dei 2 voti si ottiene il voto finale di reumato. Il voto conclusivo
dell’intero esame risulterà dalla media tra il voto di reumato, quello di uro e quello di nefro. In
bocca al lupo!!!
Chiara Cadeddu
12