LE CELLULE STAMINALI
1. Caratteristiche distintive
Le cellule staminali sono cellule primitive non specializzate dotate della singolare capacità di
trasformarsi in altri tipi cellulari.
Molti ricercatori sostengono che le cellule staminali potranno nel futuro rivoluzionare la
medicina permettendo di riparare specifici tessuti o di riprodurre organi: è infatti possibile
riprodurre in laboratorio cellule staminali umane. Gli scienziati stanno cercando di mettere a punto
raffinate tecniche per indicare alle cellule staminali come e in che cosa differenziarsi per avere a
disposizione una fonte inesauribile di cellule di ricambio capaci di sostituire le cellule malate di un
organismo.
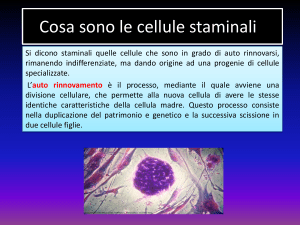
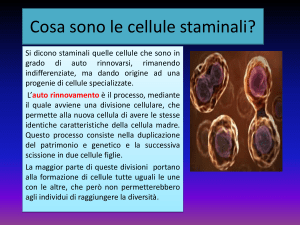
Una cellula staminale ha due proprietà principali:
1. autorinnovamento = capacità di compiere un numero illimitato di cicli replicativi (=
divisioni) mantenendo il medesimo stato differenziativo (= conservando le stesse
caratteristiche della cellula “madre”);
2. potenza = capacità di dare origine a una o più specie cellulari differenziate, cioè capaci di
svolgere una funzione specifica.
Potenzialmente le cellule staminali sono in grado di replicarsi un numero illimitato di volte
ma normalmente nel corpo si trovano in uno stato di quiescenza (fase G0 del ciclo cellulare) e
solamente di rado si dividono attraverso il processo della mitosi (fa eccezione lo sviluppo
embrionale). Quando l'organismo lo richiede, possono cominciare a dividersi rapidamente,
differenziandosi in modo specifico.
La replicazione delle cellule staminali avviene con un processo chiamato “divisione
asimmetrica”. La cellula staminale, dividendosi, dà origine a due cellule le quali, per ragioni
ancora non note, hanno due destini differenti: una è identica alla “cellula madre” (e quindi staminale
anch’essa) e resta a costituire la materia prima con la quale, quando è necessario, vengono prodotte
le cellule di ricambio per mantenere l’organismo in condizioni fisiologiche normali; l'altra, detta
“progenitrice” o “transit amplifying cells” (TAC), emigra verso il luogo in cui c'è bisogno e
attraverso una serie di passaggi diventa una cellula adulta e differenziata 1. La cellula progenitrice
può dividersi molte volte ma non indefinitamente (e quindi ha perduto la "staminalità", cioè la
capacità di autorinnovamento). Ad esempio, nel midollo osseo di un adulto, una cellula staminale si
divide e forma un'altra staminale e una cellula progenitrice la quale darà origine, dopo ulteriori
divisioni, ai globuli rossi, a tutti i tipi di globuli bianchi e alle piastrine. Ma mentre la cellula
1 Anche nei tumori sono implicate cellule staminali. Distinguiamo le “cancer stem cells” (CSCS) che hanno una
precisa capacità di riprodursi infinitamente e di provocare metastasi dalle cellule progenitrici che non possono
replicarsi ma che danno un contributo fondamentale nella diffusione di un tumore nell'organismo. Nel progettare
dunque delle terapie bisogna tener presente che non basta attaccare le CSCS, ma è necessario prendere in
considerazione anche le cellule progenitrici (cfr. DULBECCO R., «Clonare l'umanità? Meglio produrre organi di
ricambio» in Tuttoscienze, suppl. a La Stampa, mercoledì 16 settembre 2009, V).
1
progenitrice può farlo solo per un periodo limitato, la staminale può sostituire tutto il midollo osseo
e produrre le cellule del sangue per tutta la vita. Questa limitazione del numero di replicazioni delle
progenitrici ha probabilmente due ragioni:
1. stretto controllo del numero di cellule staminali in modo da mantenere (grazie ad un
complesso sistema di segnali biochimici) un equilibrio nella “nicchia biologica” da esse
occupate;
2. conservazione dell'integrità del genoma delle cellule staminali (un basso numero di
replicazioni riduce il rischio di mutazioni).
Le mutazioni a carico delle cellule staminali sono infatti estremamente nocive e pericolose perché
1) vengono trasmesse a tutte le generazioni di cellule figlie derivate dalla cellula staminale
“madre” (mentre una mutazione in una TAC si ripercuote solo su di una singola generazione di
cellule che, eventualmente, dopo un certo tempo verrà comunque sostituita);
2) possono indurre la cellula staminale a degenerare in senso neoplastico diventando una cellula
staminale tumorale.
2
2. Classificazione
Possiamo classificare le cellule staminali in base:
alla potenza
alla provenienza
alla mobilità
In base alla potenza distinguiamo quattro tipi di cellule staminali:
1. totipotenti = capaci di svilupparsi in un intero organismo e persino in tessuti extra–
embrionali (l'uovo fecondato fino allo stadio di 8 cellule);
2. pluripotenti = capaci di specializzarsi in tutti i tipi di cellule che troviamo in un individuo
adulto ma non in cellule che compongono i tessuti extra–embrionali;
3. moltipotenti = in grado di specializzarsi unicamente in alcuni tipi di cellule;
4. unipotenti = capaci di generare solamente un tipo di cellula specializzata.
3
4
Lo zigote (= uovo fecondato) è la cellula staminale per eccellenza poiché dà origine all'intero
organismo. Fino allo stadio di 8 cellule, l'uovo fecondato è totipotente: ogni cellula, anche separata
dalle altre, può produrre tutto ciò che serve al successivo sviluppo dell'organismo. La prova
scientifica è che, se prendiamo una cellula da un uovo fecondato segmentato, questa cellula può
dare inizio ad una nuova segmentazione comportandosi come un nuovo zigote. È il processo che, in
natura, dà luogo alla formazione dei gemelli e, in vitro, alla cosiddetta clonazione per scissione
gemellare o embrionale (di cui parleremo nel prossimo capitolo). Da 8 cellule si possono ricavare 8
nuovi zigoti, ognuno dei quali può sviluppare un intero organismo. La perdita della totipotenza
inizia con la formazione della morula (16 cellule) le cui cellule hanno già destini diversi determinati
dalla loro posizione.
In base alla provenienza distinguiamo:
5
1. cellule staminali adulte: sono cellule staminali rinvenibili nell'organismo adulto tra le
cellule specializzate di un tessuto specifico (midollo osseo, cervello, sangue, cute, tessuti
adiposi); sono non specializzate e, normalmente, multipotenti o unipotenti. La loro capacità
di autorinnovamento varia da tessuto a tessuto. Nei tessuti che si rinnovano continuamente,
come la pelle e il sangue, questa riserva è grande e in eccesso. Non è un caso, infatti, che in
questi tessuti si formino con facilità tumori. Al contrario, in tessuti in cui le cellule si
dividono di rado o mai, come il cuore o il cervello, questa riserva è più limitata e infatti in
essi raramente si formano tumori, mentre più facilmente vanno incontro a malattie
degenerative. Possono provenire anche da tessuti fetali (aborti procurati o spontanei), da
bambini o dal cordone ombelicale (quest'ultimo è una buona fonte di cellule staminali),
pertanto vengono dette più propriamente cellule staminali somatiche. Anche queste sono
capaci di differenziarsi solo in alcuni tipi cellulari. Un esempio di questo tipo cellulare è
dato dalle cellule staminali emopoietiche che generano ogni giorno 200 miliardi di globuli
rossi. Le staminali adulte vengono già utilizzate come terapia per oltre 100 patologie.
Tuttavia, hanno dei limiti di natura tecnica in quanto sono rare, difficili da isolare e poi da
indurre a riprodursi in laboratorio e a differenziarsi. Inoltre, sono in grado di specializzarsi
quasi solo nelle cellule dei tessuti da cui sono state prelevate. Così, una cellula staminale
prelevata dal sangue, molto difficilmente riuscirà a differenziarsi, ad esempio, in una cellula
nervosa;
2. cellule staminali embrionali: sono cellule pluripotenti ricavate dalle cellule interne di una
blastocisti (= lo stadio che l'embrione raggiunge a circa 5 giorni dalla fecondazione in cui è
costituito da circa 100-140 cellule) che vengono ottenute per mezzo di colture cellulari.
Sono le uniche cellule staminali capaci di differenziarsi in qualunque altro tipo cellulare.
Sono più facili delle altre da isolare, da far riprodurre e da conservare stabilmente in
laboratorio. La ricerca su questo tipo di cellule è ancora ai primi stadi e pone diversi
problemi di carattere etico.
6
Infine, possiamo distinguere fra cellule staminali “residenti” (es.: quelle del midollo osseo
che producono le cellule del sangue) e “circolanti” per breve tempo (es.: quelle del cordone
ombelicale).
3. Curare con le cellule staminali
Le speranze suscitate dalle cellule staminali riguardano la possibilità di curare molte gravi
patologie degenerative.
Se si riesce a farle differenziare in cellule nervose, si può sperare di curare l'Alzheimer, il
morbo di Parkinson, la sclerosi multipla, le malattie del midollo spinale.
Se si riesce a farle differenziare in cellule del muscolo cardiaco, si potranno curare molte
malattie del cuore, mentre facendole diventare cellule produttrici di insulina, si potrà combattere il
diabete.
Se si insegnerà loro a diventare cellule del sangue, si potrà sperare di curare la leucemia, molti
tipi di cancro, le immunodeficienze, le malattie ereditarie del sangue.
Ma si può pensare di indurle a differenziarsi anche in cellule delle ossa, della cartilagine, del
fegato, della pelle, della retina, dei muscoli scheletrici e allora avremo la possibilità di far guarire
pazienti affetti da osteoporosi, osteoartriti, epatiti, cirrosi, ustioni, distrofia muscolare.
Infine, se si riuscirà a mettere a punto una tecnica che induca queste cellule a diventare un
tessuto o un organo, si rivoluzionerà la medicina dei trapianti perché vi sarà una disponibilità
illimitata di organi e non ci sarà più il problema del rigetto2 (ciò vale per la terapia autologa3 o
singenica, perché per quella allogenica il problema del rigetto rimane).
La terapia con cellule staminali ottenute da un donatore estraneo (sano) è detta “allogenica”,
mentre se le cellule sono dello stesso paziente sul quale saranno utilizzate è detta “autologa”4;
infine, se provengono da due individui identici è detta “singenica”.
2 Oggi il problema del rigetto viene tenuto sotto controllo grazie ai farmaci “immunosoppressori” che impediscono che
l'organismo rigetti l'organo o il tessuto trapiantato. Spesso questi farmaci devono essere assunti per tutta la vita e ciò
non è senza conseguenze: in primo luogo, l'organismo resta senza difese e aumenta il rischio di malattie infettive,
anche gravi; in secondo luogo, aumenta anche il rischio di tumori, proprio perché l'organismo viene privato di un
presidio contro la proliferazione tumorale. Per superare il problema del rigetto, la letteratura scientifica propone tre
strategie alternative: 1) sfrutta il fatto che le staminali embrionali tollerano meglio di qualunque altra cellula le
operazioni di ingegneria genetica. Si potrebbe dunque intervenire modificando le molecole responsabili della
istocompatibilità, creando così una sorta di linea cellulare universale (enormi difficoltà tecniche e fattibilità solo
ipotetica); 2) creazione di “banche di cellule staminali embrionali” comprendenti una significativa percentuale dei tipi
di istocompatibilità esistenti, cosicché si possa scegliere la linea cellulare più adatta al sistema immunitario del
ricevente; 3) clonazione per trapianto di nucleo (di cui parleremo in seguito) (NERI D., La bioetica in laboratorio,
55–56).
3 Molte delle malattie che si intende curare con la terapia cellulare hanno una più o meno pronunciata componente
genetica che talora (nel caso delle malattie monogeniche) è la causa diretta della malattia, ma che in ogni caso
contribuisce al suo sviluppo Ciò limita notevolmente il futuro uso delle cellule staminali autologhe in medicina
rigenerativa (secondo alcuni solo alle condizioni derivanti da traumi o nel caso di malattie a scarsa componente
genetica). Che senso avrebbe infatti reimpiantare cellule che contengono lo stesso difetto genetico che predispone o
addirittura causa direttamente o accelera la malattia che si vuole curare? (NERI D., La bioetica in laboratorio, 52).
4 Viene detto “omotrapianto”; non è una tecnica semplice perché le cellule prelevate devono essere “curate” prima di
essere reimmesse nel paziente.
7
4. Problematiche tecniche ed etiche legate all'uso delle cellule staminali embrionali
Le cellule staminali embrionali sono le cellule pluripotenti che costituiscono la massa
8
cellulare interna della blastocisti5.
Trofoblasto
Embrioblasto o
massa cellulare interna
Le cellule staminali isolate dalla blastocisti possono essere indotte a proliferare
indefinitamente in vitro senza però differenziare. Questo, in natura, non è possibile: nel processo
naturale non c'è infatti proliferazione senza differenziazione, mentre le staminali ottenute in
laboratorio possono rimanere allo stadio indifferenziato per moltissimo tempo senza mostrare alcun
segnale di degenerazione e questo le rende particolarmente interessanti. Rimane il fatto che, se è
vero che abbiamo la materia prima in quantità pressoché inesauribile, dobbiamo ancora imparare a
indirizzarla in modo tale da poter prevedere con sufficiente certezza i risultati che intendiamo
ottenere in ambito terapeutico e, soprattutto, a controllare la sua potenzialità di indefinita
proliferazione6.
Le staminali embrionali hanno alta capacità di proliferazione e possono differenziare in tutti i
tipi cellulari dell'organismo e per questo sono particolarmente promettenti per future terapie
cellulari, anche se rimangono da risolvere problemi tecnici, economici ed etici.
5 La blastocisti è lo stadio di evoluzione della cellula successivo a quello di morula e si forma dopo circa 5 giorni da
quest'ultimo. Per ottenere cellule staminali embrionali dalla massa cellulare interna si può procedere in due modi: 1)
“catturare” la cellula allo stadio di blastocisti oppure 2) far regredire una cellula adulta (riprogrammazione).
Il trofoblasto deriva dalla segmentazione delle cellule esterne della morula. Darà luogo alla placenta e agli altri
sistemi di sostegno destinati a proteggere e a nutrire l'embrione, ma non partecipa alla formazione dell'embrione vero
e proprio. L’embrioblasto o massa cellulare interna è costituito dalle cellule che derivano dalla parte interna della
morula. Né le cellule del trofoblasto né quelle dell’embrioblasto possono separatamente dar luogo allo sviluppo di un
organismo ma devono lavorare insieme e per questo sono dette "pluripotenti". Le cellule staminali pluripotenti sono
cellule capaci di dare origine a tutti i tessuti che comporranno l'organismo adulto, ma non da sole perché non sono
più in grado di dar luogo al trofoblasto che è essenziale per lo sviluppo. Se, infatti, si prende una cellula dalla massa
cellulare interna e la si trasferisce in utero, non si sviluppa un embrione. Nello sviluppo in vivo il periodo di
pluripotenza è limitatissimo perché nell’embrioblasto già si comincia ad individuare una mappa presuntiva del
destino delle cellule.
6 Se questa è la proprietà più interessante delle staminali embrionali, è però anche fonte di preoccupazione perché,
secondo i dati emersi in alcune ricerche, può portare alla formazione di tumori chiamati “teratomi”. Questo fenomeno
è stato osservato nelle cellule embrionali lasciate differenziare spontaneamente, mentre si riduce, fino a sparire, nelle
progenie cellulari ottenute con processi di differenziazione guidata. È chiaro quindi che, prima di pensare
all'applicazione clinica, occorrerà approfondire la conoscenza dei meccanismi regolatori della proliferazione al fine di
eliminare il rischio tumorale (NERI D., La bioetica in laboratorio, Laterza, Bari 2005, 40–46).
9
I problemi tecnici ed economici sono di più tipi:
1. necessità di milioni, miliardi di cellule staminali per curare una patologia (si pensi alla
distrofia muscolare ove si tratta di ricostituire il 40% dei tessuti!);
2. costi elevatissimi e non sempre giustificati7;
3. difficoltà di indurre in quasi tutte le cellule un efficiente differenziamento nel tessuto
desiderato;
4. possibilità che le cellule che dopo il trapianto non si differenziano, proliferino e formino
tumori.
Non ci sono difficoltà etiche insormontabili per quanto concerne l'uso di materiale raccolto da
feti abortiti in modo spontaneo che però generalmente non sono utilizzabili a causa del cattivo stato
di conservazione dei tessuti. È comunque necessario avere la garanzia che non ci sia alcun rapporto
di causalità o di accordo tra l’équipe medica che provoca l'aborto e i ricercatori che utilizzano le
cellule staminali embrionali.
La questione più difficile sul piano etico riguarda l'ottenimento di cellule staminali prelevate
da embrioni non impiantati in utero prodotti appositamente a scopo sperimentale oppure dai
cosiddetti “embrioni soprannumerari” cioè quegli embrioni che rimangono inutilizzati nell'ambito
delle tecniche di procreazione assistita8. Se è da escludere del tutto l'ipotesi di produrre
appositamente embrioni umani per la sperimentazione, non appare moralmente soddisfacente
neppure l'utilizzazione degli embrioni soprannumerari crioconservati 9 anche nella prospettiva che
questi andranno comunque distrutti dopo un certo numero di anni perché qualunque
argomentazione a riguardo si fonda su una visione strumentale dell'embrione umano. Non è mai
legittimo eliminare un essere umano per ottenere benefici per altri esseri umani. Inoltre,
acconsentire ad usare gli embrioni soprannumerari a scopo di ricerca in base il principio del male
minore (partendo cioè dalla considerazione che comunque verranno distrutti), significa accettare
l'equiparazione tra “uccidere” e “lasciar morire”10.
7
Secondo i protocolli attualmente seguiti, le cellule vengono considerate alla stregua di un farmaco, perciò prodotte
3 volte per ogni paziente, per cui i costi lievitano moltissimo (per curare 3 pazienti servono attualmente 2 milioni di
euro!) (dati forniti da Giulio Cossu a settembre 2009 nelle relazione tenuta alla Conferenza Mondiale sulla Scienza).
Le normative internazionali in materia di trattamenti terapeutici prevedono che ogni nuovo trattamento, dopo aver
superato varie fasi sperimentali in vitro e poi su modelli animali, debba essere applicato in studi–pilota su un
ristretto numero di pazienti. Ma i trattamenti di cui parliamo sono ad alta tecnologia e ad alti costi e quindi è
prevedibile che in una prima fase saranno disponibili solo per pochi fortunati e solo nei centri ad alta
specializzazione. Ma lo scopo finale dovrà essere quello di passare alla fase dell'applicazione clinica quanto più
possibile generalizzata, perché le malattie presumibilmente curabili con le staminali riguardano milioni di persone.
Questo pone dei vincoli al tipo di tecnologia utilizzabile, che dovrà essere sufficientemente standardizzata (non si
può aspettarsi che in ogni singolo ospedale vi sia un'équipe di ricerca in grado di effettuare in loco tutto il complesso
lavoro di preparazione delle cellule staminali occorrenti per ogni singolo paziente). Una simile procedura
personalizzata può essere ipotizzabile nella prima fase di applicazione, a vantaggio di pochi pazienti e, comunque,
limitatamente al caso delle malattie croniche, nelle quali il tempo necessario per la preparazione dei trattamenti non
costituisce un problema. È però assai difficile pensare che un trattamento personalizzato di questo genere possa
essere generalizzato a tutti i pazienti e per tutte le patologie: i costi sarebbero proibitivi per qualunque sistema
sanitario. (NERI D., La bioetica in laboratorio, 55–54).
8
La legge 40/2005 riconosce all'embrione lo statuto di persona. Come conseguenza di ciò:
impedisce che vi siano embrioni soprannumerari;
comporta il rifiuto di utilizzare gli embrioni per la sperimentazione scientifica con finalità terapeutica,
compresi quelli già crioconservati.
9 Gli embrioni soprannumerari vengono fatti sviluppare fino allo stadio di blastocisti, per poi prelevare cellule dalla
massa cellulare interna (il che porta alla distruzione dell'embrione); tali cellule vengono poi messe in coltura su uno
strato di fibroblasti di topo irradiati e in adatto terreno dove si moltiplicano dando origine alla formazione di colonie
di “embrioidi” da cui si otterranno “linee cellulari” capaci di moltiplicarsi indefinitamente (le cellule staminali).
10
In alcuni Paesi esiste la possibilità legale di utilizzare a scopo di ricerca gli embrioni soprannumerari. Questa
10
Le problematiche etiche legate all'uso delle cellule staminali embrionali sono molteplici:
1. il loro prelievo (che avviene 5 giorni dopo la fertilizzazione dello stesso) comporta
l'uccisione dell'embrione (che, per la morale cattolica, dal momento in cui si fondono i
gameti, è già un soggetto umano e quindi ha diritto alla vita);
2. è difficile dominarne i processi proliferativi e differenziativi;
3. ci sono rischi teorici di formazione di tumori;
4. ci sono problemi etici legati alla selezione del donatore, alla qualità del consenso informato,
alla scelta del ricevente (perché alcuni pazienti possono accedere alla sperimentazione e altri
no?);
5.
c'è il rischio di sfruttamento economico di tali tecnologie11.
Ottenimento di cellule differenziate a partire da cellule staminali embrionali
5. La ricerca sulle cellule staminali adulte e altre nuove prospettive
Anche la linea di ricerca sulle cellule staminali adulte è promettente. Ci si chiede perciò se,
per evitare i problemi di natura etica legati all'uso delle staminali embrionali, si possa puntare su di
possibilità non è esclusa nemmeno dall'art. 18 della Convenzione di Oviedo (1997). È evidente che ci troviamo di
fronte alla nota distinzione tra ciò che giuridicamente lecito e ciò che non lo è moralmente.
11 La Dichiarazione di Helsinki (nn. 5 e 10), la Convenzioni di Oviedo (1997) e la Dichiarazione sul genoma umano e i
diritti dell'uomo dell'Unesco (1997) sono concordi nell'affermare che laddove venga a crearsi una situazione di
conflitto fra i risultati che si pensa di ottenere da una ricerca e/o da una sperimentazione e la vita e l'integrità dei
soggetti implicati in esse, si devono salvaguardare questi ultimi valori.
11
essa. La maggior parte degli scienziati risponde di no, almeno per ora, e le motivazioni che
adducono sono di tre tipi:
1. mentre le staminali embrionali sono pluripotenti, quelle adulte sono al massimo multipotenti
(differenza decisiva ai fini della ricerca, anche se meno in una successiva fase applicativa);
2. le staminali embrionali si riproducono molto più facilmente in coltura di quelle adulte;
3. le staminali embrionali si comportano in modo abbastanza diverso da quelle adulte, per cui
siamo di fronte a due diverse linee di ricerca e – dicono gli scienziati – una ricerca su due
piste diverse è meglio di una ricerca su una pista sola.
Nel 2006, lo scienziato giapponese Shinya Yamanaka ha annunciato di aver trovato il modo
di far girare al contrario le lancette dell'orologio, facendo regredire alcune cellule adulte, facilmente
disponibili, come quelle della pelle e ottenendo così cellule pluripotenti specifiche del singolo
paziente. Questa scoperta permetterebbe di evitare i problemi etici connessi all'utilizzo delle
staminali embrionali e del rigetto. Un danno di un nostro organo potrebbe, in futuro, essere curato
prelevando cellule adulte della pelle, riprogrammandole e facendole regredire allo stadio di cellule
staminali pluripotenti, per poi reimpiantarle con un autotrapianto nel tessuto ammalato.
BIBLIOGRAFIA
BOMPIANI A., «Staminali, cellule» in Enciclopedia di bioetica e sessuologia, 1635–1638.
COSSU G., «E con le staminali si fa il tagliando a cervello e cuore» in Tuttoscienze, suppl. a La
Stampa, mercoledì 16 settembre 2009, III.
GRECO P., Biotecnologie. Scienze e nuove tecniche biomediche verso quale umanità?, Cittadella,
Assisi 2004, 49–51.
MARINO I., Nelle tue mani, Einaudi, Torino 2009, 106–117.
NERI D., La bioetica in laboratorio. Cellule staminali, clonazione e salute umana, Laterza, Bari
2005, 27–56.
RUSSO G., Bioetica. Manuale per teologi, 200–202.
APPROFONDIMENTI
BENEDETTO XVI, Discorso ai partecipanti al Congresso Internazionale promosso dalla Pontificia
Accademia per la vita: “Le cellule staminali: quale futuro in ordine alla terapia?”, 16 settembre
2006.
CONGREGAZIONE PER LA DOTTRINA DELLA
bioetica (2008), nn. 31–32 (scheda 8).
FEDE,
Istr. Dignitas personae. Su alcune questioni di
PONTIFICIA ACCADEMIA PER LA VITA, Dichiarazione sulla produzione e uso scientifico e terapeutico
delle cellule staminali embrionali umane, 24 agosto 2000.
12