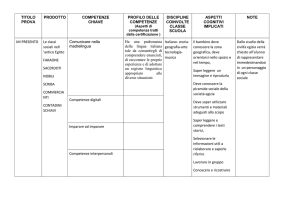
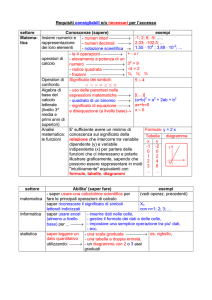
ITIS “N. Baldini “– Ravenna- a.s. 2008-09
Triennio Chimica
PIANO DI LAVORO PREVENTIVO DI ANALISI CHIMICA, ELABORAZIONE DATI E
LABORATORIO CLASSE 4^AC
Prof.ssa Francesca Calderoni
Prof.ssa Candida Marino
Obiettivi
L’insegnamento di questa disciplina presenta al 4° anno caratteristiche essenzialmente di valore
formativo; il corso risulta pertanto propedeutico al 5° anno quando gli studenti affronteranno gli
aspetti applicativi di tipo professionalizzante (analisi applicate di tipo merceologico).
Gli obiettivi specifici del corso sono pertanto:
conoscere gli aspetti teorici fondamentali e il principio fisico su cui si fondano i metodi analitici
indicati nel programma
conoscere i componenti fondamentali degli strumenti presi in considerazione
conoscere i fondamenti dell’analisi quali e/o quantitativa
saper controllare i parametri fondamentali per verificare il corretto funzionamento degli
strumenti utilizzati
saper eseguire delle analisi quali e/o quantitative su campioni preparati in laboratorio
saper elaborare i dati secondo procedure statistiche
Metodologie
Verranno adottate le seguenti metodologie:
-lezioni frontali, per introdurre in modo sistematico gli argomenti
-lezioni interattive, per favorire la partecipazione dell’intera classe
- attività di laboratorio
Verranno favoriti il recupero in itinere e pomeridiano, secondo necessità.
Verifiche
Tipologia delle prove di verifica
- verifiche formative, rappresentate da questionari, prove soggettive/oggettive contenuti nel libro di
testo
- verifiche scritte sommative, a conclusione di ogni unità di apprendimento unitamente a verifiche
di recupero, articolate sotto forma di quesiti e problemi. Le verifiche scritte sono valide per il voto
orale
- verifiche orali
- verifiche pratiche di laboratorio
Criteri di valutazione:
Per le prove scritte e orali: si fa riferimento alla griglia di valutazione (allegata) approvata dai
docenti del corso di chimica nella seduta del 09/09/08
Per l’attività di laboratorio verranno considerati:
Esecuzione sperimentale (conduzione e completamento dell’esperimento) e correttezza
dell’analisi
Capacità di organizzazione (reperimento ed allestimento dei materiali, apparecchiature, rispetto
dei tempi e dei compiti assegnati)
Compilazione quaderno di laboratorio (ordine generale- indice, cronologia, numerazione pagina
ecc.- indicazione dei dati essenziali- quantità, titolo soluzione, grandezze osservate,
indentificazione strumenti, calcoli eseguiti, risultati ben evidenziati)
Relazione sull’attività svolta in forma di relazione tecnica secondo una struttura schematica
fornita
Atteggiamento complessivo in laboratorio in considerazione delle norme di sicurezza.
Risorse
Libro di testo: R. Cozzi, P.P. Protti, T. Ruaro Analisi chimica strumentale ed. Zanichelli
Ulteriori riferimenti bibliografici A. Crea Falchet – Chimica analitica – Masson Italia/Zanichelli
Software: software specifico, pacchetti applicativi (Word, Excel…)
Strumentazione di laboratorio: spettrofotometri UV-VIS spettrofotometri per l’assorbimento
atomico; pHmetri; elettrodi
Tempi del percorso formativo:
Previste:
6 ore settimanali (di cui 4 ore di laboratorio)
Contenuti e obiettivi disciplinari dei moduli
Modulo 0 : MODULO DI RIPASSO
CONTENUTI
OBIETTIVI SPECIFICI
Unità 1: l’analisi chimica
Definizione di chimica analitica
Classificazione dei metodi analisi
Fasi di un processo analitico
Unità 2: analisi volumetrica
Definizione .
Titolante, analita
Standard primario
Curve di titolazione
Indicatori
Reazioni impiegate nell’analisi volumetrica
La concentrazione delle soluzioni
Unità 3: equilibri di precipitazione
Equilibrio eterogeneo,
solubilità e prodotto di solubilità, prodotto
ionico
fattori che influenzano la solubilità
Laboratorio:
Standardizzazione di soluzioni di NaOH; HCl,
KMnO4, AgNO3
Saper classificare i metodi analitici
Saper definire le fasi in una tecnica analitica
Saper calcolare la concentrazione delle
soluzioni come molarità, normalità, molalità,
frazione molare, percento peso e volume
Saper riconoscere i vari tipi di reazione,
saperle completare e bilanciare
Saper risolvere calcoli stechiometrici
Sapere i principi dell’analisi volumetrica
Saper definire un indicatore
Saper standardizzare una soluzione
Saper prevedere fenomeni di precipitazione e
dissoluzione.
Saper risolvere problemi stechiometrici
Modulo 1: TRATTAMENTO STATISTICO DEI DATI
CONTENUTI
OBIETTIVI SPECIFICI
Unità 1. Fonti di errore
Errori sistematici e casuali
Conoscere la differenza tra le diverse fonti di
Errore assoluto e relativo
errori
Accuratezza e precisione
Saper definire accuratezza e precisione
Valore centrale di una serie: media aritmetica, Saper esprimere il valore centrale di una serie di
mediana, percentile
dati sperimentali
Unità 2. Probabilità e statistica
Distribuzione della probabilità
Distribuzione normale o gaussiana, deviazione
standard
Test statistici: test di significatività (test di Dixon
per valori anomali o aberranti)
Test di student
Saper elaborare i dati secondo procedure
statistiche utilizzando tabelle per elaborazione dati
Saper presentare i risultati ottenuti
Modulo 2 : METODI GRAVIMETRICI DI ANALISI
CONTENUTI
OBIETTIVI SPECIFICI
Definizione
Formazione dei precipitati
Classificazione dei precipitati
Tecniche operative nella precipitazione
Modalità operative della precipitazione
Laboratorio
Determinazione gravimetrica dei solfati
Determinazione gravimetrica del nichel
Saper definire l’analisi gravimetrica
Saper classificare i precipitati
Sapere definire le tecniche e le modalità in
gravimetria
Modulo 3 : TITOLAZIONE PER PRECIPITAZIONE
CONTENUTI
Definizione
Argentometria: caratteristiche del nitrato
d’argento.
Titolazione argentometrica con il metodo di
Mohr
Titolazione argentometrica con il metodo di
Volhard
OBIETTIVI SPECIFICI
Saper le condizioni per eseguire una titolazione
argentometrica
Laboratorio
Determinazione dei cloruri
Modulo 4 : EQUILIBRIO DI COMPLESSAZIONE E
TITOLAZIONI COMPLESSOMETRICHE
CONTENUTI
OBIETTIVI SPECIFICI
Definizione e nomenclatura.
Stabilità e costante di instabilità
Chelati ed equilibrio di formazione
Equilibri di complessazione
Titolazioni complessometriche
Saper definire i complessi
Saper prevedere l’effetto complessante
sull’equilibrio di precipitazione.
Saper effettuare titolazioni con scelta degli
indicatori complesso metrici
Indicatori metallo-cromici
Curve di titolazione
Laboratorio
Determinazione della molarità di EDTA
Determinazione della durezza delle acque
Determinazione della durezza calcica
Determinazione della durezza permanente
Determinazione del calcio
Saper costruire una curva di titolazione
Modulo 5 : TITOLAZIONI REDOX
CONTENUTI
OBIETTIVI SPECIFICI
Unità 1. Titolazioni redox
Ossidazione e riduzione
Titolazioni di ossido-riduzione
Indicatori redox
Iodimetia, iodometria
Curva di titolazione
Sapere il significato di ossidazione e riduzione
Saper bilanciare reazioni redox
Saper risolvere i problemi con le redox
Saper definire una titolazione redox
Saper costruire una curva di titolazione redox
Laboratorio:
Determinazione del rame con Na2S2O3
Determinazione del cloro attivo nella
candeggina
Determinazione esatta normalità di AgNO3 0,05
N
Determinazione esatta normalità di NH4SCN
Modulo 6: METODI ELETTROCHIMICI DI
ANALISI
Unità 1. Potenziometria
Classificazione dei metodi elettrochimici:
Saper definire i vari metodi elettrochimici
potenziometria,elettrogravimetria,
Saper la funzione e le parti costituenti una cella
coulombometria,voltammetria, amperometria
galvanica
conduttimetria.
Saper l'origine del potenziale dell'elettrodo
La cella elettrochimica
Saper l'origine del potenziale di diffusione,
Classificazione degli elettrodi
inconvenienti e rimedi
Potenziale di elettrodo e potenziali standard Saper ricavare l'equazione di Nernst
di riduzione
Saper applicare l'equazione di Nernst ai vari
Notazione di cella
tipi elettrodi
La legge di Nernst
Saper come si misurano i potenziali standard
forza elettromotrice (f.e.m.) e differenza di
di riduzione
potenziale d.d.p
Conoscere il significato della serie
Elettrodo standard a idrogeno e potenziali
elettrochimica
standard di riduzione, potenziale di cella
Saper come si schematizza una cella galvanica
Elettrodi di riferimento
e come si calcola la f.e.m.
Elettrodi di misura
Saper ricavare dai potenziali standard il valore
Elettrodi ionoselettivi
della Keq
Sapere le caratteristiche degli elettrodi di
riferimento e di misura, le relative
schematizzazioni ed espressione del potenziale
di riduzione
Laboratorio:
Titolazione di una miscela di fosfati
Determinazione
della purezza dell’acido
fosforico
Determinazione del Fe2+
Determinazione del titolo esatto di una sol.
circa 0,01N di FeSO4*7H2O
Modulo 7: TECNICHE SPETTROFOTOMETRICHE
CONTENUTI
Unità 1. Principi generali
Le radiazioni elettromagnetiche: lunghezza
d’onda (), frequenza (), ampiezza, intensità.
Lo spettro elettromagnetico, la legge di Plank
tecniche ottiche di analisi: riflessione,
rifrazione, diffusione, interferenza, diffrazione,
luminescenza, assorbimento, emissione
Classificazione delle tecniche spettroscopiche
di assorbimento: assorbimento atomico e
molecolare
Unità2. Spettrofotometria UV/VIS
Le regioni principali dello spettro: UV
lontano, UV vicino, visibile
Assorbimento nell’UV-VIS
Legge
dell’assorbimento:
trasmittanza,
assorbanza, legge di Lambert Beer,
coefficiente di estinzione molare, tramittanza
percentuale
Strumentazione:
– Schema a blocchi
– caratteristiche delle parti fondamentali dello
strumento
–
Tipi di strumento: monoraggio e
doppioraggio
–
Prestazioni degli strumenti: campo
spettrale, accuratezza e precisione delle ,
risoluzione, stabilità della linea di base, luce
diffusa
Unità 3. Spettrofotometria IR
Le regioni principali dello spettro: IR lontano,
IR medio, IR vicino
Assorbimento nell’IR
OBIETTIVI SPECIFICI
Conoscere le grandezze che caratterizzano le
radiazioni elettromagnetiche
Saper interpretare l’interazione materiaradiazione
Saper riconoscere fenomeni di riflessione,
rifrazione, diffusione, interferenza, diffrazione,
luminescenza, assorbimento, emissione
Sapere i principi generali delle tecniche
spettroscopiche
Conoscere le definizioni di trasmittanza e
assorbanza
Saper interpretare la legge di
Beer e
conoscere le deviazioni
Sapere riprodurre lo schema a blocchi di uno
strumento
Saper descrivere le varie parti dello strumento
Saper descrivere i tipi di strumento
Saper effettuare uno spettro di assorbimento
Saper effettuare analisi quali-quantitative
spettrofotometriche nel campo UV/VIS
Sapere i principi fondamentali della
spettrofotometria IR
Sapere descrivere uno spettrofotometro IR
–
Il modello classico dell’oscilattore
armonico
– Il modello quantistico, numero quantico
vibrazionale, bande di overtone
Strumentazione per spettrofotometri a
dispersione:
– Schema a blocchi
– caratteristiche delle parti fondamentali dello
strumento
–
Tipi di strumento: monoraggio e
doppioraggio
Strumentazione per spettrofotometri in
trasformata di Fourier, cenni, vantaggi rispetto
agli strumenti a dispersione
Analisi qualitativa:
– Parametri caratteristici: posizione, intensità,
forma
– Zone di assorbimento
Unità 4. Spettrofotometria di assorbimento
atomico
Gli spettri di assorbimento atomico: acquisto
di energia radiante e rilassamento, le serie
spettrali, l’allargamento delle righe spettrali
(effetto Lorentz, Doppler, allargamento
naturale, cenni)
Assorbimento atomico e concentrazione, la
relazione di Boltzmann, il coefficiente di
assorbimento atomico
Strumentazione:
– Schema a blocchi
– caratteristiche delle parti fondamentali dello
strumento
– Prestazioni dello strumento
– Ottimizzazione dello strumento.
– Sistemi di correzione dell’assorbimento di
fondo: interferenze spettrali interferenze
non spettrali fisiche e chimiche correzione
Analisi quantitativa
– Metodo della retta di taratura
– Metodo delle aggiunte
Laboratorio:
Registrazione dello spetttro di assorbimento di
una soluzione di KMnO4
Determinazione del Fe2+ con α-α’ dipiridile
Determinazione dei nitriti
Determinazione spettrofotometrica del rame
Determinazione del calcio in AA
Conoscere la relazione tra assorbimento e
concentrazione
Saper interpretare la legge di
Beer e
conoscere le deviazioni
Sapere riprodurre lo schema a blocchi di uno
strumento
Saper descrivere le varie parti dello strumento
Saper effettuare analisi spettrofotometriche di
assorbimento atomico