Studio conformazionale
sulle penicilline.
Storia.
Nel 1928, Alexander Fleming (1881-1955), medico e microbiologo scozzese,
osservò, mentre era intento a studiare dei ceppi di stafilococco nei laboratori del
Saint Mary’s Hospital di Londra, che una muffa, il Penicillium notatum, la quale aveva
contaminato accidentalmente una delle sue piastre di coltura, provocava un alone di
inibizione dei batteri situati nelle vicinanze di essa. L’appartenenza della muffa al
genere Penicillium, suggerì a Fleming di chiamare questo composto antibatterico
“penicillina”. Per tale scoperta, fu insignito del premio Nobel per la medicina nel 1945
(con H. W. Florey ed E. B. Chain).
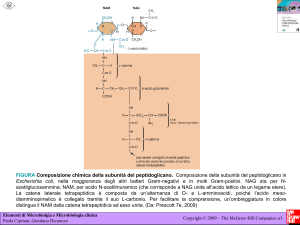
Biosintesi del peptidoglicano (mureina o mucopeptide batterico).
Una delle più importanti caratteristiche della cellula batterica (ad eccezione dei
micoplasmi, privi di parete esterna) è quella di essere racchiusa in un contenitore
rigido denominato sacculo o parete cellulare (cell-wall), responsabile, inoltre, della
differente colorazione assunta con il metodo del patologo danese Gram. Essa ha la
funzione di fornire una barriera semipermeabile tra l’interno e l’ambiente esterno e di
proteggere la cellula contro le variazioni di pressione osmotica; inoltre, previene la
digestione da parte degli enzimi dell’ospite e conferisce al batterio una morfologia
ben precisa. Il peptidoglicano è un componente eteropolimerico spongiforme che
conferisce una rigida stabilità meccanica alla cellula batterica in virtù della sua
struttura a graticcio dai molteplici legami crociati. È denominato “peptidoglicano”,
giacché composto da catene di glicani, filamenti lineari costituiti da due carboidrati
azotati, gli amminozuccheri N-acetil-glucosamina e acido N-acetil-muramico, che si
alternano e che sono uniti tra loro da legami peptidici β-(1,4) (legame scisso dal
lisozima o muramidasi).
La sua biosintesi può essere suddivisa in tre stadi; il primo stadio, che avviene nel
citoplasma, serve alla sintesi dei precursori uridil-difosfato (UDP) acetil-muramil-
1
pentapeptide con racemizzazione della L-alanina in D-alanina; nel secondo stadio, si
ha l’unione della UDP-acetil-muramil-pentapeptide con la UDP-acetil-glucosamina,
distacco dei nucleotidi uridinici e formazione di un lungo polimero; nel terzo stadio, si
ha il completamento dei legami crociati all’esterno della membrana cellulare tramite
una reazione di transpeptidazione, con l’enzima legato direttamente alla membrana.
In particolare: una molecola di N-acetil-glucosamina-1-fosfato (NAG-1-P) si lega ad
una molecola di uridina-difosfato (UDP) e successivamente ad una molecola di
fosfoenolpiruvato (PEP) con formazione del lactil etere della N-acetil-glucosamina (o
acido muramico); esso funziona da accettore per alcuni aminoacidi (cinque, L-ala-Dglu-L-lis-D-ala-D-ala, per Escherichia coli; dieci non lineari per Staphylococcus
aureus), attraverso i carbossili liberi in 3 dell’acido lattico; è da notare la
stereochimica D del glutammato e dell’alanina terminale in E. coli, caratteristica
importante per proteggere il peptidoglicano dall’idrolisi ad opera delle peptidasi
dell’ospite.
il prodotto di questa serie di reazioni è il cosiddetto “nucleotide di Park” (acido
muramico + pentapeptide); esso viene trasportato sulla parete in accrescimento da
un vettore lipidico fosforilato denominato bactoprenolo (BP), con liberazione di una
molecola di uridina-mono-fosfato (UMP), che fosforilata a livello citoplasmatico,
riprende il ciclo di reazioni iniziali. A questo punto, si ha l’attacco da parte di una
molecola di N-acetil-glucosamina (NAG) e l’aggiunta di cinque molecole di glicina,
con formazione di un ponte pentaglicinico, responsabile dei legami crociati trasversali
della struttura del peptidoglicano. Il complesso neoformato, si libera del vettore e
reagisce con un accettore di membrana, cioè una estremità in accrescimento di una
delle catene polisaccaridiche del peptidoglicano. La reazione finale consiste nella
formazione di un legame ammidico (peptidico) tra l’estremo del ponte pentaglicinico
e l’estremo del pentapeptide del polimero adiacente, previa rottura del legame tra le
due molecole terminali di D-alanina di quest’ultimo, con eliminazione di una molecola
di
D-alanina
e
la
produzione
dell’energia
necessaria
alla
reazione
di
transpeptidazione e di formazione del legame crociato; l’alanina terminale si legherà
all’unità lisinica del tetrapeptide adiacente attraverso il residuo pentaglicinico.
2
Inattivazione di una PBP transpeptidasica ad opera di una beta-lattamina con formazione di
penicilloil-enzima inattivo.
Figura I
Quest’ultimo
passaggio
della
biosintesi
è
una
transammidazione
(o
transpeptidazione, termine più “biochimico”) in cui il gruppo amminico terminale
dell’ultima glicina della catena A spiazza l’unità terminale di D-ala sulla catena B
vicina (Figura II). Il passaggio è catalizzato da una transammidasi (o transpeptidasi)
situata sul versante esterno della membrana citoplasmatica batterica; essa forma un
legame covalente transitorio con un suo ossidrile serinico; il completamento del ciclo
catalitico rigenera la funzionalità dell’enzima. La transpeptidasi viene acilata sul
residuo serinico dalla penicillina, con formazione di penicilloil-enzima inattivo e
relativa scissione del legame –CO-NH- dell’anello β-lattamico (Figura I). La
transpeptidasi costituisce, quindi, uno dei bersagli delle penicilline (e delle altre betalattamine), in virtù del fatto che sono analoghi strutturali dal dipeptide D-alanina-Dalanina; essa viene indicata come PBP (Penicillins Binding Proteins o proteine
leganti le penicilline), di cui sono noti diversi tipi. La lisi dei batteri che solitamente
segue l’esposizione ad antibiotici beta-lattamici dipende, in ultima analisi, non solo
dall’arresto della sintesi e dal conseguente indebolimento del peptidoglicano, ma
anche dall’attività degli enzimi autolitici della parete cellulare, le “autolisine” o idrolasi
della mureina (mureina-idrolasi) in grado di depolimerizzare il peptidoglicano stesso,
mediante la rottura del legame tra acido N-acetil-muramico e peptide a livello della Dalanina. L’interferenza con l’assemblaggio del peptidoglicano, associata all’attività
autolisinica fisiologica potrebbe spiegare in modo soddisfacente la lisi cellulare.
L’azione dei beta-lattamici, dipende fortemente dalla velocità di crescita delle cellule
batteriche: l’effetto batteriolitico è, infatti, inesistente in cellule quiescenti.
3
Figura II
Parete cellulare dei gram-positivi.
Figura III
Il peptidoglicano dei gram-positivi (Figura III), ha due caratteristiche principali, tali da
distinguerlo da quello dei gram-negativi: ha uno spessore maggiore (da 200 a 800 Å)
e confina direttamente con l’ambiente esterno. La parte esterna è costituita da un
4
sottile strato di proteine, responsabile dell’antigenicità del batterio e delle sue
caratteristiche tropiche; vi sono, inoltre, le porine, canali a permeabilità selettiva. La
barriera successiva è rappresentata dal peptidoglicano, il quale è attraversato da
molecole di acido teicoico e teicuronico, altamente immunogene, le quali hanno la
funzione di ancorarlo alla sottostante membrana citoplasmatica; questi acidi, inoltre,
costituiscono un polimero che rende la superficie cellulare altamente polarizzata e
con carica negativa, tale da favorire l’ingresso nella cellula di molecole ionizzate con
carica positiva (es. streptomicina, antibiotico aminoglicosidico). Sulla membrana
fluttuano numerose molecole proteiche, tra le quali i “recettori” delle beta-lattamine,
detti PBP, importanti sia per la sintesi che per il riparo della parete cellulare. Gli
enzimi inattivanti le beta-lattamine, le famigerate beta-lattamasi (idrolasi dette
“penicillinasi” o “cefalosporinasi” nel caso in cui reagiscano rispettivamente con
penicilline o cefalosporine), sono secreti all’esterno della parete cellulare.
Parete cellulare dei gram-negativi.
Figura IV
Nei batteri gram-negativi, la parete cellulare è più complessa ed ha caratteristiche più
lipoidee (Figura IV). E’ presente, infatti, una membrana esterna, contenente varie
proteine, porine e soprattutto i lipopolisaccaridi (LPS). Essi costituiscono le
5
endotossine batteriche e determinano risposte antigeniche, infiammatorie e gli shock
settici. Al di sotto è presente uno strato sottile di peptidoglicano (da 20 a 30 Å),
ancorato alla membrana soprastante dalle cosidette “lipoproteine di Braun”. Vi è poi
uno
spazio
intercellulare
detto
“periplasmico”
e
la
sottostante
membrana
citoplasmatica, in cui fluttuano varie proteine, tra cui le PBP. A differenza dei grampositivi, i batteri produttori di beta-lattamasi appartenenti ai gram-negativi, secernono
tali enzimi nello spazio periplasmico, realizzando una situazione più conservativa
(economizzazione biosintetica).
Tipologie di PBPS (Penicillins Binding Proteins).
Sono note diverse classi di PBPS, le quali rappresentano i “recettori” delle betalattamine. In Escherichia coli (un gram-negativo), per esempio, sono state messe in
evidenza sette diverse PBP (Tabella 1). Negli altri batteri gram-negativi è presente
uno spettro di PBPS simile a quello di E. coli, con funzioni analoghe, ma
caratterizzate da pesi molecolari diversi.
Tabella 1 - Proteine batteriche leganti le penicilline (PBPS) in Escherichia coli
PBP
1a
Peso
Copie
molecolare
per
(daltons)
cellula
91-92.000
230
Funzione enzimatica
Funzione
Risultato
fisiologica
della
inibizione
transpeptidasi (parete)
Integrità
Estensione
strutturale
della
delle cellule
parete, lisi
1b
81-86.000
//
//
//
//
2
66.000
20
endopeptidasi
Mantenimento
Forme
della forma a
ovali
bacillo
3
60.000
50
transpeptidasi (setti)
Divisione
Filamenti
cellulare
4
49.000
110
endopeptidasi/carbossipeptidasi
6
Nessuno
5
420.000
1.800
carbossipeptidasi
//
6
40.000
570
//
Nessuno
Il legame delle beta-lattamine alle PBP-1, le serin-transferasi per antonomasia di E.
coli e di altri batteri, porta a lisi cellulare; quello alle PBP-2, porta a cellule ovali prive
di rigidità e incapaci di riprodursi; quello alle PBP-3, genera batteri di forma allungata,
filamentosa, a causa dalla mancanza di un setto; il legame alle PBP-4, -5, -6 non ha,
invece, effetti letali. Chiarita l’importanza delle transpeptidasi nella biosintesi del
peptidoglicano, si evince che tre PBPS appartengono a tale categoria. Nei batteri
gram-positivi il numero di PBPS pare sia variabile, in rapporto alla morfologia
cellulare; ad esempio, nei bacilli il numero di PBP è maggiore rispetto ai cocchi ed
hanno funzioni più complesse. Le beta-lattamine hanno, inoltre, un’affinità diversa
per le diverse forme di PBPS (Tabella 2).
Tabella 2 - Legame delle beta-lattamine alle varie PBPS.
Beta-lattamina
Tipo di PBP coinvolta ( legame % )
benzilpenicillina benzatina
PBP-1 ( 8 % )
PBP-2 ( 0,7 %)
PBP-3 ( 2 % )
PBP-4 ( 4 % )
PBP-5 ( 65 % )
PBP-6 ( 21 % )
amoxicillina, varie cefalosporine
PBP-1
mecillinam, cefotaxima
PBP-2
mezlocillina, cefuroxima
PBP-3
7
Figura V
Rappresentazione schematica della struttura di
una PBP ad attività transpeptidasica (struttura
tridimensionale ottenuta mediante diffrazione ai
raggi X di colture di pneumococco)
Caratteristiche chimico-fisiche delle penicilline.
Tutte le penicilline, studiate con metodi cristallografici ai raggi X, possono essere
considerate dei derivati dall’acido 6-amminopenicillanico (6-APA), il quale è costituito
da un anello tiazolidinico (A) condensato ad uno β-lattamico (B); quest’ultimo porta
un gruppo amminico secondario (R-NH-), al quale si unisce una catena acilica
laterale (R-CO-), responsabile delle caratteristiche antibatteriche e farmacologiche
delle varie penicilline (Figura VI). Il termine “β-lattame” indica un’ammide ciclica a
quattro termini; il suo nome sistematico è azetidinone. Esso costituisce il gruppo
“farmacoforo” di tali molecole, ovvero quello che determina l’attività biologica del
farmaco. I sali di sodio e potassio delle penicilline sono cristallini e solubili in acqua e
possono essere impiegati per via orale e parenterale. Al contrario, i sali di procaina e
benzatina della benzilpenicillina sono molto poco solubili: questa proprietà è stata
opportunamente sfruttata per creare delle molecole deposito (penicilline ritardo), che
iniettate per via intramuscolare rilasciano lentamente la penicillina G, permettendo di
mantenere costanti i livelli ematici del farmaco per lunghi periodi.
8
Figura VI
Nella forma cristallina anidra, i sali di penicillina sono stabili per lungo tempo (per
anni a 4°C); le soluzioni, invece, perdono la loro attività rapidamente e devono
essere preparate al momento della somministrazione. Le molecole sono non planari
ed otticamente attive e, nel caso più semplice della penicillina G, presentano tre
centri di asimmetria (C2, C5 e C6), con una configurazione assoluta di tipo 2S - 5R 6R.
Figura VII
L’anello β-lattamico, dunque, non è planare e si trova in una conformazione assai
tesa, essendo i due anelli perpendicolari tra loro (Figura VII). L’azoto β-lattamico,
fortemente in tensione, ha caratteristiche più spiccatamente elettrofile rispetto
9
all’azoto esociclico della catena laterale e pertanto tenderà a reagire assai
rapidamente con vari nucleofili; in acqua, esso tende a rompersi molto lentamente,
ma, in ambiente alcalino, l’idrolisi è molto rapida e porta alla formazione dell’acido
penicilloico (sprovvisto dell’attività antibatterica), che decarbossila irreversibilmente
per dare l’acido penilloico (Figura VIII). Questa è la stessa reazione catalizzata dalle
beta-lattamasi batteriche. Tale reazione è data anche dagli alcoli e dalle ammine. In
ambiente acido, invece, l’idrolisi del legame β-lattamico prevede la partecipazione
della catena laterale R. Se la catena R ha un gruppo elettron-donatore, il quale viene
protonato in vivo divenendo elettron-attrattore, la densità elettronica sul carbonile
della catena laterale diminuisce: di conseguenza, vi è una certa protezione delle
penicilline dalla degradazione acida. La degradazione può essere ritardata
tamponando il pH a 6,0 - 6,8 e mantenendo la preparazione a bassa temperatura.
Occorre, inoltre, evitare contaminazioni con zinco e rame che catalizzano l’idrolisi. La
catena laterale è quindi responsabile delle caratteristiche “aptofore” delle penicilline,
conferendo gastroresistenza e determinando il grado di legame alle PBPS ed alle
proteine sieriche; infatti, più lipofila è la tale catena, più saranno pronunciate le
caratteristiche di legame alle proteine plasmatiche.
Schema della degradazione delle penicilline in funzione del pH.
Figura VIII
10
Classificazione delle penicilline.
Le penicilline (Figura IX) possono essere classificate in:
I. naturali (penicillina G o benzilpenicillina);
II. semisintetiche (prodotte dall’acido 6-amminopencillanico o 6-APA
con
catene laterali opportunamente modificate) suddividibili a loro volta in:
a. resistenti alle penicillinasi (es. meticillina e isossazolil-penicilline
come l’oxacillina);
b. ad ampio spettro e/o anti-pseudomonas (es. ammino-penicilline:
ampicillina, amoxicillina; acil-ureido-penicilline: azlocillina, mezlocillina,
piperacillina;
carbossi-penicilline:
carbenicillina,
ticarcillina,
carindacillina; sulfossi-penicilline: sulbenicillina; amidino-penicilline:
mecillinam).
Gli inibitori delle beta-lattamasi (tienamicina, acido clavulanico, sulbactam,
tazobactam), pur mantenendo una certa attività antibatterica, sono impiegati in virtù
del fatto che inattivano irreversibilmente le beta-lattamasi, estendendo, quindi,
l’attività dei rispettivi antibiotici ai quali vengono associati.
Nessuna penicillina è attiva contro le amebe, i bacilli tubercolari (micobatteri), i
plasmodi, le rickettsie, i miceti ed i virus.
Principio attivo
Principali specialità
medicinali registrate
in Italia
PENICILLINA G
benzilpenicillina (solo per SQUIBB®,
via iniettiva)
BENZILPENICILLINA
POTASSICA®,
PENICILLINA
FARMITALIA®
11
Principali usi clinici
Infezioni del cavo orale,
otite media, endocardite
streptococcica, meningite e
sepsi meningococcica,
polmonite, antrace
benzilpenicillina-benzatina
(solo per via iniettiva)
DIAMINOCILLINA®
flucloxacillina (per via orale BETABIOPTIC®,
e parenterale)
CLOXILLIN®,
FLUXACIL®, ecc…
Sifilide, meningite,
polmonite non complicata,
faringite da streptococco
Infezioni da streptococchi
produttori di beta-lattamasi,
otite esterna, polmonite,
impetigine, endocardite (in
associazione)
amoxicillina (per via orale e ALFAMOX®, AMOFLUX®,
parenterale)
AMOX®, BRADIMOX®,
MOPEN®, VELAMOX®,
ZIMOX®, AMOXICILLINA
semibranded (es.
Ratiopharm), ecc…
Endocardite, antrace,
eradicazione di H. pylori,
infezioni meningococciche,
meningite da Listeria, otite
media, polmoniti non
complicate, infezioni delle
basse vie urinarie,
osteomielite da H.
influenzae, infezioni
dentali, sinusite
Indicazioni precedenti
amoxicillina + acido
AUGMENTIN®,
(l’acido clavulanico
clavulanico (per via orale e CLAVULIN®,
estende l’attività ai ceppi
resistenti di S. aureus, E.
parenterale)
NEODUPLAMOX®
coli, Bacteroides,
Klebsiella), morsi di animali
Infezioni delle basse vie
ampicillina (per via orale e AMPICILLINA
urinarie, otite media,
iniettiva)
semibranded,
sinusite, bronchite,
AMPIPLUS®, AMPLITAL® polmonite non complicata,
salmonellosi invasiva
piperacillina (solo per via
iniettiva, anche in
associazione con l’inibitore
delle beta-lattamasi
tazobactam)
AVOCIN®, CILPIER®,
DIPERIL®, PICILLIN®,
PIPERACILLINA
semibranded,
PIPERITAL®,
SINTOPLUS®,
TAZOCIN® (con il
tazobactam)
ticarcillina (solo per via
iniettiva)
CLAVUCAR®,
TIMENTIN®
12
Setticemie da
Pseudomonas aeruginosa
(in associazione agli
aminoglicosidi), infezioni
varie (delle vie urinarie,
delle vie respiratorie,
intraddominali, della cute,
appendicite complicata)
Infezioni gravi da
Pseudomonas aeruginosa,
Bacterioides fragilis e
Proteus.
Figura IX
Studio sulla conformazione attiva delle penicilline: prospettive
future e conclusioni.
Gli isomeri conformazionali (conformeri) di una struttura biologicamente attiva, cioè
quegli isomeri che differiscono solo per la disposizione spaziale relativa degli atomi in
seguito alla rotazione di una parte della molecola intorno a legami semplici, sono in
13
grado di modificare la loro disposizione spaziale per favorire l’interazione con il
recettore (fase farmacodinamica); spesso, però, sono separati da barriere
energetiche così basse (facilmente superabili a temperatura ambiente), da rendere
molto difficile l’identificazione della specie che effettivamente interagisce col
recettore. Per ciò che concerne la molecola della penicillina G, essa non possiede un
elevato grado di libertà torsionale (grado di “flessibilità” molecolare), giacché i due
anelli condensati sono rigidi e perpendicolari tra loro; tuttavia, è possibile la rotazione
dei legami semplici della catena laterale in 6, del carbossile in 2 e dei metili in 3. La
struttura più stabile (conformazione preferita), corrispondente ad un minimo
energetico e che ha la maggiore probabilità di essere presente in miscela, è quella
rappresentata nella Figura X, in cui il benzile (-CH2-C6H5), gruppo stericamente
ingombrante, è più lontano dal resto della molecola. Non essendo stata chiarita con
esattezza la struttura topografica recettoriale, essendo essa stessa variabile e
specie-specifica, i metodi di “drug design”, ovvero di progettazione molecolare, sono
basati sull’aspetto farmacoforico (“pharmacophore-based”), approccio classico in cui
si modificano strutture preesistenti, già attive, al fine di trovare la conformazione
bioattiva, quella responsabile dell’effetto biologico. Infatti, non è possibile prevedere
la conformazione della penicillina nell’interazione con il suo recettore dalla
conoscenza del solo ligando. In ultima analisi, le relazioni struttura - attività (SAR)
effettuate sulle penicilline hanno chiarito i seguenti punti:
a) l’introduzione di gruppi elettron-donatori (che divengono elettron-attrattori in vivo),
sulla
catena
laterale
gastroresistente,
così
in
da
6,
stabilizzano
permettere
fenossimetilpenicillina o penicillina V);
14
la
l’intera
molecola,
somministrazione
rendendola
orale
(es.
b) l’introduzione di un gruppo amminico primario (elettron-attrattore quando
protonato) sul carbonio in α rispetto al carbonile del gruppo ammidico, oltre a
conferire acidoresistenza, estende l’attività delle penicilline anche ai gramnegativi (es. ampicillina); inoltre, l’esterificazione del carbossile in 2 dell’anello
tiazolidinico, permette la trasformazione in profarmaci (propenicilline), che la
liberano più lentamente (es. pivampicillina, doppio estere, che dà una più rapida e
completa idrolisi dopo l’assorbimento);
c) l’introduzione di gruppi ad elevato ingombro sterico sulla catena laterale in 6 (es.
gruppo 2,6-dimetossibenzenico), fa diminuire l’affinità fra farmaco e betalattamasi, conferendo resistenza all’enzima (es. meticillina, uso parenterale;
oxacillina, con il gruppo aggiuntivo 5-metil-isossazolico fra l’anello benzenico e il
legame ammidico, uso orale);
d) in generale, l’introduzione di gruppi idrofobici nella catena laterale indirizza
l’attività verso i gram-positivi, mentre i gruppi idrofilici favoriscono l’attività verso i
gram-negativi.
Quando saranno chiarite con esattezza le varie topografie recettoriali delle
penicilline, i chimici farmaceutici potranno isolare la conformazione bioattiva e
sintetizzare
analoghi
strutturali
che
consentiranno
di
esercitare
un’azione
stereospecifica solo sulle PBPS ad attività transpeptidasica, cioè quelle responsabili
della reticolazione del peptidoglicano; ciò produrrà una notevole riduzione del
dosaggio efficace per provocare la lisi cellulare dei batteri ovvero una diminuzione
della MIC o concentrazione minima inibente, e un’auspicabile contenimento del
fenomeno dell’antibiotico-resistenza, nonché una ulteriore diminuzione dei pochi, ma
temibili, effetti indesiderati delle penicilline.
15
Figura X
DOTT. DARIO FIUMARELLA
I ANNO SCUOLA DI SPECIALIZZAZIONE IN
- FARMACIA OSPEDALIERA UNIVERSITÀ DEGLI STUDI DI CATANZARO
[A. A. 2002/03]
16
BIBLIOGRAFIA
I. GOODMAN & GILMAN, “Le basi farmacologiche della terapia”, VIII ed. it.,
Zanichelli, Bologna, 1992
II. H.P. RANG – M.M. DALE – J.M. RITTER, “Farmacologia”, Case Editrice
Ambrosiana, Bologna, 1998
III. B. G. KATZUNG, “Farmacologia generale e clinica“, III ed. it., Piccin, Padova,
1997
IV. M. LA PLACA, “Microbiologia medica”, V ed., Società editrice Esculapio,
Bologna, 1988
V. W. FOYE, “Principi di chimica farmaceutica”, Piccin, Padova, 1997
VI. AA. VV., “Enciclopedia della chimica Garzanti”, Garzanti editore, Cernusco
(MI),1998
VII. F. CLEMENTI - G. FUMAGALLI, “Farmacologia generale e molecolare”, II ed.,
UTET, Torino, 1999
VIII. AA. VV., “Guida all’uso dei farmaci”, n° 2, Masson editore, Milano, 2003
IX. G. TEUTSCH, “La nuova chimica farmaceutica”, trad. it. di Massimo
Scaglione, Le scienze quaderni n° 102, Gruppo Editoriale Le Scienze, Milano,
1988
Siti internet:
(I)
www.unisi.it/ricerca/centri/sisbio/perneriweb/grup1new/relazione1.html
(II)
www.dpb-it.com/Antibiotici.htm
(III)
www.aaroi.it/aaroi2/rivista/n5_98/maggio_98_8.html
(IV)
www.cmbi.kun.nl/~gstricco/organica/alcani/alcani1.htm
17