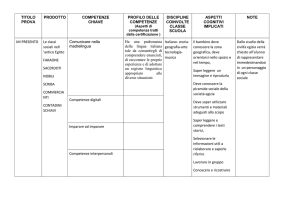
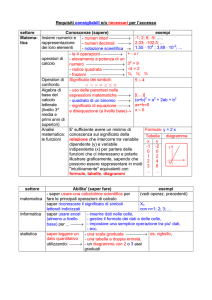
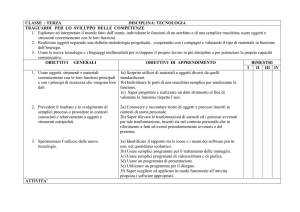
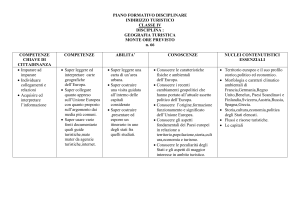
PROGRAMMA DI SCIENZE INTEGRATE : CHIMICA
Anno Scolastico 2012/2013
Classe 2
Insegnante Filipuzzi Fabiola
L’attività didattica si svolge per due ore la settimana ; circa una volta al mese si prevede di
svolgere la lezione attraverso l’attività laboratoriale.
Nell’ intero anno scolastico sono previste all’incirca 66 ore di lezione.
E’ stabilita la scansione oraria settimanale, in modo che gli alunni possano programmare lo studio
pomeridiano, previsto in un impegno a casa di circa 1 ora la settimana. Il programma sarà articolato
in moduli secondo la scansione temporale riportata di seguito. La valutazione consisterà di prove
sia orali che scritte.
OBIETTIVI DISCIPLINARI GENERALI
Apprendimento e applicazione del metodo scientifico quale strumento operativo per indagare e
comprendere i fenomeni chimici.
Sviluppo delle capacità di applicare e svolgere attività sperimentali in collaborazione con i
compagni.
Applicazione delle nozioni di chimica per interpretare aspetti della vita quotidiana.
OBIETTIVI MINIMI
Nella tabella di programmazione vengono evidenziate con l’asterisco le conoscenze e le abilità
minime indispensabili per avere una valutazione sufficiente.
Prerequisiti:
Saper utilizzare le grandezze fisiche e le unità di misura. Svolgere operazioni di equivalenza
utilizzando multipli e sottomultipli. Conoscere le fasi del metodo scientifico. Saper affrontare , in
collaborazione con i compagni, semplici esperienze di laboratorio.
CONOSCENZE
Unità introduttiva
La misura*
Sistema internazionale delle
unità di misura
Il termometro*
Le reazioni chimiche
Come si scrive una reazione*
Bilanciamento delle reazioni e
legge di Lavoisier
Scambi energetici durante le
reazioni chimiche
Fattori che influenzano la
velocità di una reazione
ABILITA’
Saper compiere equivalenze fra
unità di misura
Saper registrare dati
sperimentali
Elementi e composti
Analisi e sintesi di un
Saper definire un elemento
novembre
chimico e un composto chimico
Saper scrivere e bilanciare
semplici reazioni chimiche
Saper discutere gli scambi
energetici in una reazione
chimica
Saper immaginare le azioni da
compiere per velocizzare una
reazione chimica
TEMPI
Settembre
ottobre
composto
I simboli chimici*
Calcolo della composizione
percentuale di un composto e
Legge di Proust delle
proporzioni definite e delle
proporzioni multiple
Conoscere le regole sui simboli
chimici e conoscere i simboli
dei principali elementi
Saper scrivere e leggere una
formula chimica correttamente
Saper bilanciare semplici
reazioni chimiche
Lo stato gassoso
I gas*
I passaggi di stato*
La teoria cinetica
Le leggi dei gas
Saper risolvere problemi con le
leggi dei gas
Saper elencare i punti della
teoria cinetica
Lab: verifica sperimentale della
legge di Boyle
Saper calcolare il PM di una
sostanza
Conoscere e comprendere il
significato dell’u.m.a.
Comprendere il concetto di
mole e saper risolvere semplici
problemi con le moli
Saper calcolare la molarità
delle soluzioni ( formule dirette
e inverse)
Lab: preparazione di soluzioni
a concentrazione nota
novembre
Le particelle subatomiche e i
modelli atomici
Descrizione delle particelle
subatomiche fondamentali*
Le proprietà elettriche della
materia
I modelli atomici da Thompson
a Bohr
Il numero atomico e il numero
di massa*
Gli isotopi*
Isotopi instabili e decadimento
radiativo
Tipi di radiazioni*
Tempo di dimezzamento
Reazioni nucleari*
Saper descrivere le
caratteristiche delle particelle
subatomiche
Saper descrivere il modello
atomico di Bohr
Saper fare calcoli con il
numero atomico e il numero di
massa
Saper distinguere la differenza
tra reazioni chimiche e reazioni
nucleari
Lab: prove di riconoscimento
alla fiamma
gennaio
La tavola èperiodica e la
struttura elettronica
Come si legge la tavola
periodica*
Saper collocare un elemento
nella tavola periodica e saper
prevedere le sue proprietà in
base alla collocazione
febbraio
L’atomo
Principio di Avogadro
Massa degli atomi*
Peso atomico e u.m.a.*
Il peso molecolare*
La mole*
Il volume molare
La molarità
dicembre
Descrizione dei principali
gruppi e periodi
Famiglie chimiche
La valenza*
Classi di composti chimici :
ossidi, idrossidi, acidi, Sali*
Nomenclatura chimica*
I legami chimici
Legami tra atomi ( covalente,
covalente polare, ionico e
metallico)*
Legami tra molecole ( dipolodipolo, Van der Waals, ionedipolo, a idrogeno)
Legami chimici e proprietà
delle sostanze*
Le soluzioni
Vari tipi di soluzioni*
Soluzioni elettrolitiche
Soluzioni di acidi e di basi*
Le reazioni acido-base
La scala di pH*
Le reazioni di ossidoriduzione*
I fenomeni elettrolitici
Le trasformazioni della
materia e l’equilibrio
ambientale: una chimica
ecosostenibile
Materia ed energia
Energia contenuta negli
alimenti
Fonti di energia non rinnovabili
e rinnovabili
Effetto serra
Elementi di chimica organica
La chimica del carbonio e le
principali categorie di composti
organici
Esempi di gruppi funzionali
Esempi di sostanze organiche
naturali
Data: novembre 2012
Saper dare il nome a semplici
composti chimici secondo le
regole della nomenclatura
Lab: reazione di formazione di
un ossido, di un idrossido, di un
acido e di un sale
Saper prevedere che tipi di
legami si possono formare tra
atomi
Saper descrivere i legami sia
con la notazione di Lewis che
con il metodo convenzionale
Lab: riconoscimento della
polarità dell’ acqua e di altre
sostanze
marzo
Saper descrivere il concetto di
solubilità
Saper riconoscere la acidità di
una soluzione in base al pH
Comprendere se una reazione
è redox mediante calcolo del
numero di ossidazione
Lab: misura della acidità con
cartina al tornasole per alcune
sostanze diffuse
Comprendere il problema
dell’approvvigionamento
energetico
aprile
Saper riconoscere una sostanza
organica
giugno
Firma
maggio