William Crookes
BIOGRAFIA:
Sir William Crookes (Londra, 17 giugno 1832 - Londra, 4 aprile 1919) fu un
chimico e un fisico britannico.
Frequentò la scuola di Cheppenham dove ricevette l'educazione primaria, e a
soli 15 anni fu ammesso al Reale Collegio di Chimica (Royal College of
Chemistry) di Hanover Square a Londra sotto la guida di August Wilhelm von
Hofmann.
Nel 1861, mentre stava eseguendo esperimenti di spettroscopia, scoprì un
nuovo elemento chimico che aveva la caratteristica di emettere un raggio di
colore verde intenso nello spettro elettromagnetico. Chiamò questo elemento
tallio dal greco antico thallos, un germoglio verde.
Ideò e realizzò un radiometro (radiometro di Crookes).
[William Crookes]
Iniziò quindi una serie di ricerche sulla conduzione dell'elettricità nei gas a
bassa pressione e scoprì che quando la pressione era molto bassa, il catodo sembrava emettere dei
deboli raggi luminosi. Questi raggi furono chiamati raggi catodici ma in seguito si scoprì che erano dei
semplici flussi di elettroni. Questa proprietà è la stessa utilizzata nei normali tubi catodici dei
televisori.
Crookes fu uno dei primi scienziati ad interessarsi e studiare il settore che oggi viene chiamato Fisica
del plasma.
Nel 1913 fu eletto Presidente della Royal Society di Londra e rimase in carica fino al 1915.
Verso la fine della sua vita, ebbe stretti contatti con la Society for Psychical Research, ma il suo
rapporto con la giovane medium Florence Cook causò una brusca caduta della sua reputazione
scientifica, e cominciarono a circolare voci che i due fossero amanti e che Crookes la aiutasse a
falsificare le prove.
Fu insignito della Royal Medal nel 1875, della Medaglia Davy nel 1888 e della Medaglia Copley nel 1904.
Ricevette il premio Nobel per la Chimica nell’anno 1907.
CURIOSITÁ:
Crookes sperimentò con due grandi medium: Daniel Dunglas Home col quale ebbe risultati strabilianti
nel campo della PK, e Florence Cook, rimasta famosa per le sue materializzazioni e per il "fantasma "
materializzato di una giovane donna che disse di chiamarsi Katie King. Critiche violente bersagliarono il
giovane scienziato che mantenne coraggiosamente le sue posizioni e mai ritrattò quanto aveva
pubblicato sulle sue esperienze ("Ricerche sui fenomeni dello Spiritismo", 1874): mai volle che il
Crookes che aveva scoperto il Tallio fosse disgiunto da quello che aveva studiato Home e la Cook.
ARGOMENTO:
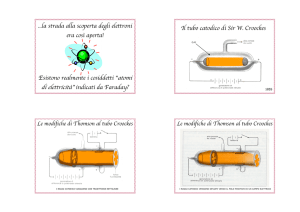
Tubi catodici
Il termine tubo a raggi catodici, più comunemente tubo catodico o CRT
(acronimo del termine inglese Cathode Ray Tube), indica la tecnologia
comunemente usata per la visualizzazione nei monitor e nei televisori, che
consiste nel convogliare ad hoc dei raggi catodici su di una superficie
sensibile, che ricostruisce l'immagine visibile.
La sperimentazione più ricca di risultati venne iniziata da un maestro
vetraio, H. Geissler, nel 1854 studiando il passaggio della corrente elettrica
nei gas.
In seguito, Crookes, prendendo spunto da Geissler, usò un tubo di vetro con
due elettrodi, uno caricato negativamente (catodo) e l’altro caricato
negativamente (anodo), saldati internamente alle due estremità. I due
elettrodi venivano collegati con un generatore di differenza di potenziale
(ddp) e i diversi fenomeni osservati nel tubo, ossia nessun effetto, scarica
elettrica, luminosità diffusa, fluorescenza, dipendevano dalla pressione del gas presente e dalla
differenza di potenziale applicata.
Esperimento 1. Togliendo dal tubo tutta l’aria, quindi creando il vuoto, ed applicando una qualsiasi ddp
non si ottenne alcun effetto.
Esperimento 2. Collegando gli elettrodi ad una ddp di circa 20.000 V e una pressione residua inferiore
a 0.5 mmHg, si ottenne un sorprendente risultato: in queste condizioni si poté osservare che dalla parte
opposta del catodo (elettrodo negativo) il vetro emana una fluorescenza verdastra localizzata in una
posizione indipendente da quella dell’anodo. Sembrava che dal catodo venissero emessi raggi, chiamati
catodici da Goldstein nel 1886, che viaggiavano in linea retta attraversi il tubo [Fig. 1].
Esperimento 3. Collocando un campo magnetico o elettrico a contatto del tubo catodico, si osservò che
i raggi erano leggermente deviati in direzione della carica positiva del campo magnetico. Da questo si
dedusse che i raggi catodici dovevano avere una carica elettrica negativa.
Esperimento 4. Ponendo un mulinello a quattro pale (due bianche e due nere) sulla “strada” dei raggi
catodici e collegando il ddp, si poté osservare che la ruota iniziava a spostarsi lungo il binario su cui era
poggiata; invertendo i poli la ruota si fermava e ripartiva al contrario [Fig. 2]. Questo significava che i
raggi catodici erano costituiti da particelle dotate di carica negativa.
Esperimento 5. Inoltre venne scoperto che i raggi non potevano attraversare la materia. Infatti,
disponendo una lamina metallica sagomata a “croce di Malta” all’interno del tubo [Fig. 3], bloccava il
flusso del raggi catodici proiettando sul vetro la propria ombra [Fig. 4].
CONCLUSIONI: Dalle osservazioni dedotte dai cinque esperimenti Crookes concluse che i raggi
catodici erano costituiti da particelle dotate di carica negativa alla quale venne dato dal fisico inglese
J. J. Thomson nel 1897, il nome di elettroni e che essi non potevano attraversare la materia.
Figura 1
Figura 3
Figura 2
Figura 4
Joseph John Thomson
BIOGRAFIA:
Sir Joseph John Thomson, fisico inglese, è noto per aver
scoperto la particella di carica negativa: l'elettrone.
Nato a Cheetham, nei pressi di Manchester, il 18 dicembre del
1856, da genitori scozzesi, John studiò ingegneria all'università di
Owen, per poi andare al Trinity College di Cambridge. Quindi, nel
1890, sposa Rose Paget: da questo matrimonio nasceranno due
figli. Uno dei suoi studenti, Ernest Rutherford, continuò in
seguito il suo lavoro.
Influenzato dagli studi di Maxwell e dalla scoperta dei raggi X,
egli dedusse che i raggi catodici erano composti da particelle di
carica negativa, che chiamò corpuscoli, e che sono oggi noti come
elettroni. In precedenza George Johnstone Stoney presuppose
l'elettrone come l'unità di carica in elettrochimica, ma Thomson
comprese subito che in realtà esso era una particella subatomica,
[Joseph John Thomson]
la prima ad essere scoperta. La sua scoperta gli portò una
certa notorietà (1897) e gli consentì di vincere il Nobel in fisica nel 1906: per ironia della sorte il
figlio George Paget Thomson ricevette alcuni anni più tardi (1937) lo stesso premio ma per aver
dimostrato che l'elettrone è, di fatto, un'onda (vedi anche dualità onda-corpuscolo).
Nel 1912 realizzò il primo spettrometro di massa (allora chiamato parabola spettrografica), uno
strumento che consentiva di determinare il rapporto tra la massa e la carica degli ioni e che da allora
è diventato uno strumento molto utilizzato nella chimica.
Prima dello scoppio della Prima Guerra Mondiale, fece ancora un'altra grande scoperta: quella degli
isotopi. Nel 1918 diventa Master al Trinity College di Cambridge, dove resta fino alla sua morte,
avvenuta in 30 agosto del 1940. Il suo corpo è stato sepolto nell'Abbazia di Westminster, accanto ad
Isaac Newton.
ARGOMENTO:
elettroni e modello atomico (a panettone)
Thomson nel 1897 misurando le deviazioni che subivano gli elettroni in un campo elettrico o magnetico e
confermando le ipotesi di Crookes, determinò il rapporto tra la carica (c) e la massa di queste particelle
che risultò pari a:
1.76 x 108 C/g
che non si discosta molto da quello attualmente accettato.
Poiché tale valore si manteneva costante indipendentemente dal materiale di cui era costituito il catodo
e il gas che riempiva il tubo, J. J. Thomson concluse che gli elettroni dovevano essere costituenti
fondamentali della materia.
Un ulteriore processo nella conoscenza degli elettroni venne compiuto da Einstein nel 1905 quando si
scoprì che la superficie di alcuni metalli, colpita dalla luce emetteva particelle cariche negativamente; il
fenomeno venne chiamato effetto fotoelettrico. Un’ennesima conferma degli esperimenti di Thomson
fu la scoperta dell’effetto termionico, cioè l’emissione dei metalli scaldati ad alte temperature nel
vuoto di elettroni. Inoltre si scoprì che gli elettroni erano anche i costituenti dei raggi β.
Gli studi sul passaggio della corrente elettrica nelle soluzioni avevano consentito di stabilire che in
soluzione, ,’atomo di idrogeno era presente sottoforma di ione positivo, cioè che esso assumeva una
carica elettrica di segno opposto a quella dell’elettrone ma di valore esattamente uguale. Si era potuto
misurare anche il rapporto carica/massa per tale ione, confrontando questo rapporto con quello
dell’elettrone si concluse che la massa dell’elettone è 1837 volte più piccola della massa dell’atomo di
idrogeno.
In seguito (1911) con le classiche esperienze di R. Millikan, fu possibile misurare direttamente la carica
dell’elettrone, con sufficiente precisione, che risultò valere:
Carica = -1,602 X 10-19 C
Poiché tale carica era la più piccola fino ad allora determinata, venne considerata come la carica
elementare (e) e le fu attribuito il valore convenzionale di -1. Noto il valore della carica dell’elettrone,
fu possibile determinare la massa m=9,11 x 10-28 g. La scoperta dell’elettrone veniva dunque a
dimostrare che non era l’atomo la parte più piccola della materia, ma che ne esisteva una ancora più
piccola; l’elettrone.
Il fisico tedesco E. Goldstein nel 1886 modificò un tubo di Crookes usando un catodo costituito da una
piastra metallica forata [Fig 1]. Operando nelle stesse condizioni sperimentali che avevano portato alla
formazione dei raggi catodici, egli notò sulla parete di vetro dietro al catodo, una debole luminosità
prodotta da raggi che attraversavano il tubo a partire dall’anodo. Queste radiazioni, data la loro
provenienza, furono chiamate raggi anodici o raggi canale o Goldstein. Nel 1910 Thomson riprese gli
studi sui raggi canale e propose di chiamarli raggi positivi per significare che essi esibivano una carica
elettrica positiva, quindi opposta a quella dei raggi catodici e che pertanto si muovevano in direzione
contraria. A ulteriore differenza dai raggi catodici, i corpuscoli con carica positiva dei raggi anodici
avevano masse che dipendevano dal gas presente nel tubo.
In seguito, il corpuscolo costituente i raggi anodici prodotti dall’idrogeno, venne considerato una
particella fondamentale, costituente di tutti gli atomi, che fu chiamata protone.
Un atomo, secondo Thomson, era un entità globulare al cui interno vi erano delle cariche positive e
negative. Le cariche positive non avevano peso a differenza delle cariche negative, gli elettroni, che
determinavano il peso dell'atomo. Secondo il modello atomico proposto da Thomson l'atomo viveva in
uno stadio stazionario in quanto le cariche negative erano bilanciate da quelle positive. Se all'atomo
veniva fornita una energia, come fece Thomson nei suoi precedenti esperimenti con i gas, allora esso
emetteva una radiazione e se l'energia fornita risultava forte l'atomo si ionizzava. Uno ione, secondo
Thomson, era un atomo al cui interno c'era una disparità di cariche positive o negative; in quest'ultimo
caso gli elettroni espulsi da un atomo (che diventava così ione positivo) venivano assorbiti da un altro
atomo che diventava ione negativo.
La disposizione di cariche positive ed elettroni non seguiva della particolari regole sebbene il modello
prevedeva che tali cariche fossero sempre presenti all'interno dell'atomo, come racchiuse in una sorta
di guscio [Fig 2].
Il modello atomico di Thomson è chiamato a panettone o a budino con le uvette in quanto viene
rappresentato l’atomo con gli elettroni al suo interno (uvetta).
Figura 1
Figura 2
Informazioni tratte ed elaborate da: “Wikipedia” (internet), “l’Enciclopedia”, “Nuovo corso di Chimica” (testo
scolastico), “Chmica e Tecnologie della Chimica” (testo).
Immagini prese da: “www.monci.it/.../2E_Tubi_A_Raggi_Anodici.htm” e “www.sparkmuseum.com”
Turco Diletta e Vincenzi Giada
Esercizi:
I raggi catodici sono costituiti da ioni negativi
V
F
L’esperienza di Thomson ha evidenziato che i raggi catodici sono:
a. ioni negativi derivanti dalla ionizzazione del gas all’interno del tubo
b. particelle prive di carica
c. particelle con carica negativa
d. una manifestazione radioattiva degli elementi da cui è formato il catodo
La carica relativa dell’elettrone è:
a. +1
b. -1
c. 0
d. -1,602 x 10-19 C
Completamento:
Durante le sue sperimentazioni, Crookes utilizzò un tubo di vetro con due ________, uno positivo (______) e
uno negativo (______). Sperimentò che con una ____ di 20000 V ed una pressione del gas pari a 0.5 mmHg, il
catodo emanava fasci di luce che vennero denominati _________________ con carica ________.
Negli anni successivi dimostrò che essi erano costituiti da ________ poiché provocavano lo spostamento di un
mulinello. In oltre, grazie alla croce di Malta, si scoprì che esse ______________ la materia.
Particelle,
Anodo,
Raggi anodici,
Attraversano,
Raggi catodici,
Non attraversano,
Ddp,
Magneti,
Catodo,
Positiva,
Ioni,
Negativa.
Elettrodi,
Scarica,