La scoperta dell’elettrone
(8 settembre 2006)
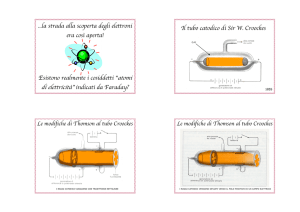
Durante gli anni 80 dell’’800, J. J. Thomson stava studiando i raggi catodici. In
Inghilterra essi venivano considerati “particelle di materia dotati di grande carica, in moto
ad alta velocita`”, principalmente perche’ curvavano la traiettoria in un campo magnetico.
Egli chiamo` “corpuscolo” quest’ipotetica particella. In Germania i raggi catodici erano
invece considerati una “perturbazione dell’etere” simile ai raggi ultravioletti.
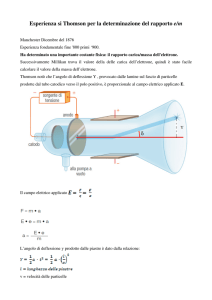
Thomson comincio` con misurare il rapporto e/m (carica su massa): poiche’ erano noti i
valori di questo rapporto per ioni di diversi elementi, un confronto di questi rapporti
poteva dare uno spunto per scoprire la natura del corpuscolo. Impiego` la tecnica di
Schuster in cui si misura il raggio di curvatura R di un fascio di particelle in moto in un
campo magnetico noto B, ma che richiede anche la conoscenza della velocita` v dei raggi:
e
v
. Sia usando la misura (errata) della velocita` fatta da lui stesso, che l’assunzione
m RB
di Schuster, che la velocita` fosse uguale alla velocita` media di una molecola di gas, e/m
risultava uguale al rapporto per gli ioni gia` noti, confermando cosi’ la teoria inglese sulla
natura dei raggi come fasci di particelle cariche di dimensioni atomiche.
Contro la natura corpuscolare dei raggi catodici Lenard sollevo` l’obiezione che il
cammino libero medio dei raggi che uscivano dal tubo era molto maggiore del valore
atteso se fossero stati ioni gassosi.
Questa obiezione spinse Thomson a cercare un metodo piu` diretto di misurare v. Vi
riusci’ sfruttando la propria scoperta della deflessione elettrostatica dei raggi; bilanciando
una forza elettrica ed una magnetica in modo da ottenere un fascio non deflesso, ricavo`:
v E B.
Il risultato di queste misure fu che e/m era maggiore del rapporto corrispondente dello
ione idrogeno di un fattore 1000. Lo stesso valore si applicava a tutti i raggi catodici che
Thomson provo`, indipendentemente dal tipo di materiale di cui erano costituiti gli
elettrodi e del gas che riempiva il tubo. Dal grande valore di e/m del corpuscolo Thomson
inferi’ la sua piccola massa (assumendo che la carica fosse dell’ordine dell’unita`
elettrolitica); da questa inferi’ (un po’ arbitrariamente) le sue piccole dimensioni; da
queste la sua penetrabilita` (rispondendo alla critica di Lenard). Dalle dimensioni e
dall’indipendenza di e/m dalle circostanze della produzione del corpuscolo inferi’ che
esso e` un costituente di tutti gli atomi: l’elettrone, anche se non ancora con questo nome,
era stato scoperto (1897). Nei due anni seguenti Thomson trovo` altre particelle – quelle
liberate da metalli dalla luce ultravioletta e da filamenti di carbone dal calore – che
avevano approssimativamente lo stesso valore di e/m del corpuscolo. Riusci’ anche a
misurare la carica e usando la camera di Wilson. Il risultato era in accordo, come ordine
di grandezza, con le stime dell’”elettrone” elettrolitico.
Nonostante tutta questa evidenza sperimentale, la teoria di Thomson era incompleta,
perche’ non poggiava sul suo assunto fondamentale che gli atomi normali consistessero
di corpuscoli. Zeeman rimedio` a questa mancanza stabilendo che la particella, che nella
teoria di Lorentz era responsabile della separazione magnetica delle linee spettrali,
possedeva un e/m 1000 volte maggiore dell’idrogeno elettrolitico. Il corpuscolo non solo
era contenuto negli atomi normali, ma era responsabile del loro spettro.