2. MALATTIE ENDOCRINE E METABOLICHE
8. MALATTIE DELLA TIROIDE
Sommario:
Introduzione
Sintesi e secrezione degli ormoni tiroidei
Effetti degli ormoni tiroidei
Valutazione di laboratorio della funzione tiroidea
I disordini della tiroide comprendono il gozzo eutiroideo, la euthyroid sick syndrome, l'ipertiroidismo,
l'ipotiroidismo, le tiroiditi e i tumori tiroidei. Un breve accenno alla sintesi e alla fisiologia degli ormoni
tiroidei e alle indagini di laboratorio per lo studio della funzione tiroidea è indispensabile per una completa
comprensione di queste patologie.
l
Sintesi e secrezione degli ormoni tiroidei
Lo schema generale della biosintesi degli ormoni tiroidei è riportato nella Fig. 8-1. Lo ioduro ingerito con i
cibi e con l'acqua viene concentrato attivamente dalla tiroide, convertito in iodio organico dalla
perossidasi tiroidea e incorporato nella tirosina della tireoglobulina intrafollicolare all'interno della colloide,
presso la superficie basale delle cellule follicolari della ghiandola. Le tirosine vengono iodate a livello di
un solo sito molecolare (monoiodotirosina) oppure di due (diiodotirosina) e quindi vengono condensate
per formare gli ormoni attivi (diiodotirosina + diiodotirosina tetraiodotironina [tiroxina, T 4]; diiodotirosina +
monoiodotirosina triiodotironina [T 3]). Un'altra fonte di T3 all'interno della ghiandola tiroidea è l'ormone che
deriva dalla deiodazione dell'anello esterno della T 4 ad opera di un selenoenzima: la 5´-deiodasi di tipo I
(5´D-I). La tireoglobulina, una glicoproteina contenente T 3 e T4 all'interno della propria matrice, viene
captata dall'interno del follicolo come goccioline di colloide da parte delle cellule tiroidee.
Lisosomi contenenti proteasi separano la T3 e la T4 dalla tireoglobulina, con conseguente liberazione di T 3
e T4 libere. Anche le iodotirosine (monoiodotirosina e diiodotirosina) vengono liberate dalla tireoglobulina,
ma soltanto quantità molto piccole raggiungono il torrente circolatorio. Lo iodio viene rimosso dalle loro
molecole ad opera delle deiodasi intracellulari e viene riutilizzato dalla tiroide.
La T4 e la T3 rilasciate dalla tiroide in seguito alla proteolisi raggiungono la circolazione, dove vengono
associate a proteine sieriche leganti gli ormoni tiroidei per essere trasportate. La principale proteina che
lega gli ormoni tiroidei è la globulina legante la tiroxina (Thyroxine-Binding Globulin, TBG), la quale ha
un'alta affinità ma una bassa capacità per la T 4 e la T3. La TBG normalmente veicola circa il 75% degli
ormoni legati. Le altre proteine leganti gli ormoni tiroidei (soprattutto la prealbumina legante la tiroxina,
detta anche transtiretina, la quale ha alta affinità ma bassa capacità per la T 4, e l'albumina, dotata di
bassa affinità ma alta capacità per la T 4 e la T3) trasportano il resto degli ormoni tiroidei sierici legati.
Circa lo 0,03% della T4 sierica totale e lo 0,3% della T 3 sierica totale sono liberi e in equilibrio con gli
ormoni legati. Soltanto la T4 e la T3 libere sono disponibili per i tessuti periferici per l'azione ormonale.
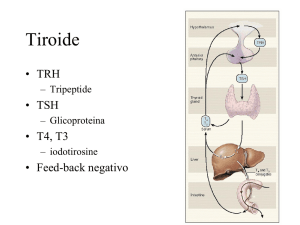
Tutte le reazioni necessarie per la sintesi della T 3 e della T4 sono influenzate e controllate dall'ormone
tireo-stimolante ipofisario (TSH), detto anche tireotropina, che stimola le cellule follicolari della ghiandola
tiroidea. Il TSH si lega al proprio recettore di membrana tiroideo posto sulla superficie esterna delle
cellule follicolari e attiva l'enzima adenil-ciclasi, aumentando così la formazione della adenosina
3´:5´-fosfato ciclico (cAMP), il nucleotide che media gli effetti intracellulari del TSH. La secrezione
ipofisaria di TSH è controllata da un meccanismo di feedback negativo modulato dai livelli circolanti di T 4
e di T3 libere e dalla conversione della T 4 in T3 nelle cellule tireotrope ipofisarie. La T 3 è la iodotironina
metabolicamente attiva. L'aumento dei livelli degli ormoni tiroidei liberi (T 4 e T3) inibisce la secrezione di
TSH da parte dell'ipofisi, mentre la riduzione dei livelli di T 3 e di T4 determina un aumento del rilascio di
TSH. La secrezione di TSH è influenzata anche dall'ormone di rilascio della tireotropina (TRH), un
peptide di 3 aminoacidi sintetizzato nell'ipotalamo. Il TRH, immesso nel sistema portale interposto tra
l'ipotalamo e l'ipofisi, si lega a uno specifico recettore sulle cellule tireotrope dell'ipofisi anteriore e
determina la successiva secrezione di TSH. L'esatta regolazione della sintesi e del rilascio del TRH non è
del tutto chiara, anche se gli ormoni tiroidei vi svolgono certamente un ruolo.
Circa il 20% della T3 circolante viene prodotto dalla tiroide. Il restante 80% deriva dalla monodeiodazione
dell'anello esterno della T4 (5´D-I), principalmente nel fegato. Nel fegato e in tessuti extraepatici avviene
anche la monodeiodazione dell'anello interno della T 4 (5-deiodasi [5D-III]), che porta alla formazione di
3,3´,5´-T3 (T3 inversa o reverse T3, rT3). Questa iodotironina ha un'attività metabolica minima ma è
presente nel siero umano normale e, in quantità trascurabili, nella tireoglobulina. Circa il 99% della rT 3
circolante deriva dalla deiodazione dell'anello interno della T 4 nei tessuti periferici. I livelli di rT 3
aumentano in molte circostanze nelle quali i livelli sierici di T 3 si abbassano a causa della riduzione di
attività della 5´D-I dell'anello esterno (p. es., nelle malattie croniche epatiche e renali, negli stati di
malattia acuti e cronici, nell'inanizione e con le diete povere di carboidrati). Questo aumento della rT 3 si
verifica soprattutto a causa della riduzione di attività della deiodasi dell'anello esterno (5´D-I), che riduce
marcatamente la clearance della rT 3. Tali stati di malattia cronica, pertanto, determinano una riduzione
della produzione dell'ormone attivo, la T 3, e un aumento dei livelli sierici della rT 3 dovuti alla riduzione
della clearance della rT3. La riduzione della produzione di T 3 potrebbe costituire una risposta adattativa
alla malattia.
l
Effetti degli ormoni tiroidei
Gli ormoni tiroidei hanno due effetti fisiologici principali:
aumentano la sintesi proteica praticamente in ogni tessuto corporeo. (La T 3 e la T4 penetrano nelle
cellule, dove la T3, che proviene dalla circolazione e dalla conversione della T 4 in T3 all'interno
della cellula stessa, si lega a recettori nucleari specifici e influenza la sintesi dell'mRNA.)
la T3 incrementa il consumo di O2 aumentando l'attività della Na+, K+-ATPasi (pompa del Na),
soprattutto nei tessuti responsabili del consumo basale di O 2 (cioè fegato, rene, cuore e muscolo
scheletrico). L'aumento dell'attività della Na+, K+-ATPasi è secondario all'aumento della sintesi di
questo enzima; di conseguenza, l'aumento del consumo di O2 è probabilmente correlato anche al
legame nucleare degli ormoni tiroidei. Comunque, non è stato escluso un effetto diretto della T 3
sui mitocondri. La T3 viene ritenuta l'ormone tiroideo attivo, benché la T 4 di per sé possa essere
biologicamente attiva.
l
Valutazione di laboratorio della funzione tiroidea
Determinazione dell'ormone tireo-stimolante (TSH) sierico: la misurazione del TSH sierico è il metodo
migliore per definire una disfunzione tiroidea. Il riscontro di valori normali esclude in sostanza la presenza
di ipertiroidismo o ipotiroidismo, tranne in caso di ipertiroidismo secondario a un adenoma ipofisario
secernente TSH o a resistenza ipofisaria agli ormoni tiroidei e in alcuni pazienti affetti da ipotiroidismo
centrale dovuto a una patologia dell'ipotalamo e/o dell'ipofisi. Queste condizioni sono trattate brevemente
più avanti. Il livello sierico del TSH distingue anche le sindromi con ipertiroidismo subclinico (TSH sierico
soppresso) da quelle con ipotiroidismo subclinico (TSH sierico elevato), entrambe associate con livelli
sierici normali di T4, T4 libera, T3 e T3 libera.
I nuovi test per il TSH sierico che si avvalgono di metodi immunometrici sono molto più sensibili e accurati
rispetto ai test di prima generazione basati sulle tecniche radioimmunologiche. Questa sensibilità rende
possibile la differenziazione tra i livelli estremamente bassi o indeterminabili riscontrati nell'ipertiroidismo
vero e i livelli inferiori alla norma osservati in alcuni pazienti, p. es., i pazienti con euthyroid sick syndrome
(v. oltre). I test immunometrici di seconda generazione (IEMA, IFMA e ICMA) hanno una sensibilità
funzionale compresa tra 0,1 e 0,2 mU/l. I test di terza generazione (alcuni tipi di ICMA) hanno una
sensibilità funzionale compresa tra 0,01 e 0,02 mU/l. I test di quarta generazione attualmente in via di
sviluppo hanno una sensibilità funzionale compresa tra 0,001 e 0,002 mU/l.
Determinazione della T4 totale sierica: la T4 totale sierica viene misurata per lo più con tecniche
immunometriche che impiegano traccianti isotopici (ImmunoRadioMetric Assay, IRMA) o non isotopici, tra
i quali un enzima (ImmunoEnzymoMetric Assay, IEMA), un fluoroforo (ImmunoFluoroMetric Assay, IFMA)
o un composto chemioluminescente (ImmunoChemiluminoMetric Assay, ICMA). Le tecniche
immunometriche misurano la T4 totale, cioè sia l'ormone legato sia quello libero, benché quasi tutta la T 4
sia legata alle proteine. Queste indagini sono semplici, poco costose e di rapida esecuzione. La T4 totale
è una misura diretta della T 4, non alterata dalla presenza di iodio non T 4. Tuttavia, variazioni dei livelli
sierici della proteina di trasporto producono variazioni corrispondenti della T 4 totale, anche se laT4 libera
fisiologicamente attiva rimane invariata. In questo modo un paziente può essere fisiologicamente normale
nonostante abbia un livello di T4 totale sierica alterato.
La TBG aumenta per lo più durante la gravidanza, in corso di terapia con estrogeni o con contraccettivi
orali e nella fase acuta delle epatiti infettive. Essa può anche essere aumentata geneticamente, a causa
di un'anomalia legata al cromosoma X.
La TBG viene diminuita principalmente dagli steroidi anabolizzanti, compreso il testosterone, e da
quantità eccessive di corticosteroidi; anche la diminuzione può avere origine genetica. Infine, dosi elevate
di farmaci come la fenitoina e l'aspirina e i loro derivati spiazzano la T 4 dai suoi siti di legame sulla TBG,
riducendo così in modo fittizio il livello di T4 totale sierica.
Misurazione diretta della T4 libera: poiché gli ormoni tiroidei disponibili per i tessuti periferici sono quelli
liberi, la misurazione diretta della T 4 libera sierica evita le insidie legate all'interpretazione dei livelli totali
di T4, i quali sono influenzati dai livelli delle proteine leganti. Quindi, i livelli di T 4 libera sierica delineano in
modo più accurato la reale funzione tiroidea rispetto alla T 4 totale. La misurazione diretta del livello di T 4
libera sierica viene eseguita con la massima precisione con il metodo della dialisi all'equilibrio, il quale
richiede tempo, è costoso, è tecnicamente impegnativo e non è disponibile nella maggior parte dei
laboratori comuni. Questo metodo separa l'ormone legato da quello libero. Il gold standard per la
misurazione della T4 libera sierica è la dialisi all'equilibrio con incubazione notturna del siero contenente
125I-T ; la percentuale di T libera viene calcolata determinando i conteggi totali nel dializzato, divisi per la
4
4
125I-T totale aggiunta al siero, moltiplicata per la concentrazione della T totale. Una versione semplificata
4
4
è disponibile in kit; la T4 libera viene misurata nel dializzato con un metodo immunologico.
Calcolo indiretto della T4 libera: queste misurazioni sono facilmente accessibili, sono più semplici e
forniscono risultati molto ben sovrapponibili a quelli dei metodi per la misurazione diretta della T 4 libera
descritti in precedenza. I metodi di indice richiedono l'esecuzione di due test indipendenti, uno che misura
la T4 totale sierica e l'altro che misura la capacità di legame dell'ormone tiroideo o la captazione della T 3
su resina. L'indice di T4 libera viene quindi calcolato utilizzando la T 4 totale e il livello di TBG, la capacità
di legame dell'ormone tiroideo o la captazione della T 3 su resina. Esso è direttamente proporzionale al
livello di T4 libera. I metodi immunologici sono standardizzati per la misurazione diretta della T 4 libera con
la dialisi all'equilibrio, perciò i risultati vengono riportati in unità assolute (ng/dl o pmol/l). Le due
metodiche più comunemente utilizzate sono un metodo immunologico in due passaggi e uno in un solo
passaggio, che impiegano entrambi un analogo della T 4. Queste analisi non sono completamente scevre
dall'influenza delle proteine leganti o di sostanze contenute nel siero che possono provocare falsi aumenti
o diminuzioni dei livelli di T4 libera.
Determinazione della T3 totale sierica e della T 3 libera: poiché la T3 è legata saldamente alla TBG (anche
se in una quota 10 volte inferiore alla T 4) ma non alla transtiretina, i livelli sierici totali della T 3 misurati con
le stesse metodiche descritte sopra per la T 4 totale saranno influenzati dalle modificazioni del livello
sierico della TBG e dai farmaci che alterano il legame alla proteina. I livelli sierici di T 3 libera vengono
misurati con gli stessi metodi diretti e indiretti descritti sopra per la T 4.
Test al TRH: il TSH sierico viene misurato prima e dopo un'iniezione EV di 500 mg di TRH sintetico.
Normalmente si assiste a un rapido incremento dei livelli di TSH variabile tra 5 e 25 mU/ ml, che
raggiunge un picco in 30 min e ritorna alla norma entro 120 min. L'incremento è esagerato
nell'ipotiroidismo primitivo. Il test al TRH può essere utile per distinguere l'ipotiroidismo ipofisario da
quello ipotalamico. I pazienti con ipotiroidismo secondario a un deficit ipofisario hanno una risposta del
TSH al TRH diminuita o assente. I pazienti con disordini ipotalamici che hanno una scarsa riserva di TRH
e una normale riserva ipofisaria rilasciano di solito quantità normali di TSH in risposta al TRH, nonostante
il fenomeno possa essere ritardato e prolungato, con il risultato di uno slittamento del tempo di rilascio.
Nell'ipertiroidismo la secrezione di TSH rimane soppressa, anche in risposta all'iniezione di TRH, a causa
degli effetti inibitori esercitati dagli alti livelli di T 4 e T3 libere sulle cellule tireotrope ipofisarie. Comunque,
con i più recenti test analitici per il TSH, il test al TRH è di rado necessario per la diagnosi di disfunzione
tiroidea, dal momento che i livelli sierici basali di TSH sono proporzionali alla risposta del TSH al TRH.
Determinazione degli autoanticorpi tiroidei: autoanticorpi contro la perossidasi tiroidea e, meno
frequentemente, contro la tireoglobulina sono presenti in quasi tutti i pazienti con tiroidite di Hashimoto e
autoanticorpi contro la perossidasi tiroidea vengono solitamente dimostrati nei pazienti con morbo di
Graves. Entrambi questi anticorpi vengono comunemente misurati con metodi immunoenzimatici; un test
per gli autoanticorpi antiperossidasi tiroidea ha preso il posto del meno recente test di agglutinazione su
globuli rossi con acido tannico per gli autoanticorpi antimicrosomiali (M). L'ipertiroidismo nel morbo di
Graves è causato da un autoanticorpo diretto contro il recettore per il TSH delle cellule follicolari della
tiroide (TSH Receptor Antibody, TRAb). Per misurare il TRAb vengono usati due metodi generali. Il test di
inibizione del legame del TSH determina la capacità delle IgG sieriche di inibire il legame del 125I-TSH al
recettore per il TSH in forma solubile. Il test agli anticorpi tireo-stimolanti misura la capacità di queste IgG
di stimolare la formazione di cAMP o la captazione di 125I in differenti sistemi biologici, cioè le colture
monostratificate di cellule tiroidee isolate, le cellule follicolari tiroidee di ratto in coltura (FRTL-5) o le
cellule tiroidee estratte dal tessuto umano o suino. Infine, anticorpi contro la T 4 e la T3 si possono
rinvenire nei pazienti con malattie autoimmuni della tiroide e possono influenzare le determinazioni dei
due ormoni, ma non sono quasi mai significativi dal punto di vista clinico.
Misurazione della tireoglobulina: la tiroide è l'unica fonte di questa glicoproteina iodata ad alto peso
molecolare, la quale è facilmente dimostrabile nei pazienti normali ed è solitamente elevata nei pazienti
con gozzo tossico e non tossico. La tireoglobulina sierica viene utilizzata principalmente per la
valutazione dei pazienti dopo tiroidectomia totale o subtotale con o senza ablazione con 131I per i tumori
tiroidei differenziati. Valori di tireoglobulina sierica normali o elevati indicano la presenza di tessuto
tiroideo residuo normale o maligno nei pazienti che ricevono dosi TSH-soppressive di l-tiroxina oppure
dopo la sospensione del farmaco. Il problema principale degli attuali metodi di analisi immunometrica e
radioimmunologica per la misurazione della tireoglobulina sierica è rappresentato dalla presenza di
anticorpi anti-tireoglobulina, che generalmente portano a una sottostima dei livelli della proteina.
Test di captazione dello iodio radioattivo: questo test è svantaggioso in termini di costo, durata e
disagio per il paziente. L'isotopo di scelta è lo 123I, il quale espone il paziente a una piccola dose di
radiazioni che si esaurisce rapidamente. È molto utile nella diagnosi differenziale dell'ipertiroidismo,
trattata nelle pagine seguenti. La captazione tiroidea dello 123I varia notevolmente a seconda dell'apporto
alimentare di iodio ed è più bassa nei pazienti esposti a un eccesso dell'elemento. La captazione tiroidea
dello 123I può essere utile per il calcolo della dose di 131I nel trattamento dell'ipertiroidismo.
Scintigrafia della tiroide: la scintigrafia con radioiodio o tecnezio 99m non viene impiegata di routine. È
utile per evidenziare anomalie strutturali della ghiandola e per la valutazione di una malattia tiroidea
nodulare, specialmente un nodulo solitario, per stabilire il suo stato funzionale, cioè se sia caldo o freddo.
IPERTIROIDISMO
Sommario:
Introduzione
Eziologia
Sintomi e segni
Diagnosi
Terapia
(Tireotossicosi)
Condizione clinica comprendente diverse malattie specifiche, caratterizzata da ipermetabolismo ed
elevazione dei livelli sierici degli ormoni tiroidei liberi.
C'è ancora un certo disaccordo sull'uso dei termini ipertiroidismo e tireotossicosi. Alcuni esperti
preferiscono usare il termine tireotossicosi in riferimento alla condizione clinica che comprende
l'ipertiroidismo (definito quindi come l'aumento della sintesi e della secrezione di ormone tiroideo) tra le
sue cause. In questo capitolo, ipertiroidismo viene usato come sinonimo di tireotossicosi.
l
Eziologia
L'ipertiroidismo può essere il risultato di un aumento della sintesi e della secrezione degli ormoni tiroidei
(T4 e T3) da parte della ghiandola, causato da sostanze stimolanti presenti nel sangue oppure da
un'iperfunzione tiroidea autonoma. Esso può inoltre essere causato dal rilascio eccessivo di ormone
tiroideo dalla ghiandola alla circolazione periferica senza un aumento della sintesi ormonale. Ciò è
comunemente causato da modificazioni distruttive della tiroide secondarie a varie cause di tiroidite.
L'ultima importante causa di ipertiroidismo è l'ingestione volontaria o accidentale di quantità eccessive di
ormone tiroideo, definita tireotossicosi factitia.
Le cause di ipertiroidismo possono essere considerate sulla base della captazione tiroidea dello iodio
radioattivo e della presenza o dell'assenza di stimolatori tiroidei circolanti (v. Tab. 8-1 e 8-2)
.
Morbo di Graves (gozzo tossico diffuso): il morbo di Graves è caratterizzato da ipertiroidismo e uno o
più dei segni seguenti: gozzo, esoftalmo e mixedema pretibiale.
Il morbo di Graves è la causa più frequente di ipertiroidismo, è una malattia autoimmune e ha un decorso
cronico con remissioni e recidive. L'eziologia del morbo di Graves è rappresentata da un anticorpo diretto
contro il recettore tiroideo per il TSH, il quale dà luogo a una stimolazione continua della ghiandola per la
sintesi e la secrezione di quantità eccessive di T 4 e T3. Il morbo di Graves (come la tiroidite di Hashimoto)
è talvolta associato con altri disordini autoimmuni, tra i quali il diabete mellito insulino-dipendente, la
vitiligine, la canizie prematura, l'anemia perniciosa, le malattie del collagene e la sindrome da deficit
polighiandolare.
La patogenesi dell'oftalmopatia infiltrativa (riscontrata nel morbo di Graves) è scarsamente compresa, ma
essa viene più frequentemente osservata nelle fasi attive dell'ipertiroidismo. Può anche presentarsi prima
della insorgenza dell'ipertiroidismo oppure da 15 a 20 anni dopo e frequentemente peggiora o migliora
indipendentemente dal decorso clinico dell'ipertiroidismo. L'oftalmopatia infiltrativa può essere causata da
immunoglobuline dirette contro antigeni specifici dei muscoli extraoculari e dei fibroblasti orbitari. Gli
anticorpi sono diversi da quelli che danno inizio all'ipertiroidismo di tipo Graves. Un'oftalmopatia tipica in
presenza di funzione tiroidea normale è chiamata morbo di Graves eutiroideo.
Inappropriata secrezione di TSH: tutti i pazienti con ipertiroidismo hanno livelli sierici di TSH
essenzialmente indosabili, tranne quelli con un tumore anteroipofisario secernente TSH o quelli con
resistenza ipofisaria all'ormone tiroideo. In entrambe queste condizioni il TSH è biologicamente più attivo
del TSH normale e un aumento della subunità a del TSH nel sangue è un marker della presenza di un
tumore ipofisario secernente l'ormone.
Gravidanza molare, coriocarcinoma e iperemesi gravidica: queste tre condizioni comportano l'elevazione
dei livelli sierici di gonadotropina corionica umana, la quale è un debole stimolatore della tiroide. La
gonadotropina corionica umana raggiunge i livelli massimi durante il primo trimestre di gravidanza e
determina il leggero aumento della T 4 libera sierica e la diminuzione del TSH sierico che a volte si
osservano durante le fasi precoci della gravidanza. I valori della gonadotropina corionica umana sono
solitamente più elevati nelle donne con gravidanza molare e nelle pazienti con coriocarcinoma, mentre
sono generalmente normali nelle donne con iperemesi gravidica. Recentemente, è stato ipotizzato che
l'aumento dell'attività stimolatoria sulla tiroide nel siero delle pazienti affette da queste condizioni sia
causato dall'aumento dei livelli di asialo-gonadotropina corionica umana, la quale sembra essere uno
stimolatore tiroideo più potente.
Gozzo tossico solitario o multinodulare (morbo di Plummer): il gozzo multinodulare tossico è più comune
nell'età avanzata. Del tutto recentemente, mutazioni puntiformi con effetto attivante a livello del recettore
per il TSH, le quali determinano una stimolazione tiroidea continua, sono state descritte nei noduli solitari.
Questa scoperta potrebbe spiegare, almeno in alcuni pazienti, la patogenesi dei noduli iperfunzionanti.
Ipertiroidismo autosomico dominante non autoimmune: questo disordine, che è una sindrome
familiare autosomica dominante di ipertiroidismo, si manifesta durante la prima infanzia. L'eziologia è
costituita da mutazioni a carico del gene per il recettore del TSH, le quali hanno come effetto l'attivazione
costitutiva del recettore e la stimolazione continua della tiroide a sintetizzare e secernere ormoni in
eccesso.
Gozzo indotto dal litio: la somministrazione di litio può indurre gozzo con o senza ipotiroidismo,
specialmente nei pazienti con tiroidite di Hashimoto, forse a causa del suo effetto inibitorio sul rilascio
dello ioduro dalla tiroide. Sebbene i pazienti che assumono litio possano sviluppare anche ipertiroidismo,
è stato recentemente suggerito che questa associazione sia casuale e non dovuta alla somministrazione
di litio.
Malattie infiammatorie (tiroiditi): le forme di tiroidite comprendono la tiroidite linfocitica silente, la
tiroidite subacuta e la tiroidite di Hashimoto (tutte e tre sono trattate sotto Tiroiditi, oltre). La tiroidite
linfocitaria sporadica è poco frequente e le segnalazioni più recenti provenienti dal Midwest riguardo
all'aumento della sua frequenza potrebbero essere state confuse con l'ingestione di carni bovine
contaminate con tessuto tiroideo degli animali. L'ipertiroidismo è il risultato delle modificazioni distruttive
della ghiandola e del rilascio dell'ormone immagazzinato, non dell'aumento della sintesi.
La terapia radiante ad alte dosi sui tessuti del collo eseguita per patologie maligne non tiroidee può
causare una tiroidite dolorosa e un ipertiroidismo transitorio. L'incidenza di ipotiroidismo permanente
dopo tale terapia radiante è alta e la funzione tiroidea (TSH sierico) deve essere valutata a intervalli di
6-12 mesi. Un'oftalmopatia di Graves può presentarsi anni dopo la terapia radiante.
L'amiodarone e l'interferone a è stato segnalato che inducono un'ampia varietà di disordini funzionali
della tiroide; la loro trattazione va oltre gli scopi di questa breve panoramica. Comunque, entrambi i
farmaci possono indurre tiroiditi con ipertiroidismo e i pazienti che li assumono devono essere
strettamente controllati.
Tireotossicosi factitia: i pazienti con questo disordine ingeriscono volontariamente o accidentalmente
quantità eccessive di ormone tiroideo, il quale provoca l'insorgenza di ipertiroidismo senza gozzo.
Contrariamente a quanto avviene in tutte le altre cause di ipertiroidismo, la tireoglobulina sierica non è
elevata ed è quasi sempre bassa o ai limiti inferiori della norma.
Ipertiroidismo dovuto a ingestione di iodio: l'ingestione di iodio è la principale causa di ipertiroidismo con
bassa captazione tiroidea di iodio radioattivo, il quale è considerato un ipertiroidismo vero e proprio, cioè
con aumento con sintesi e della secrezione di ormone tiroideo in eccesso da parte della tiroide. Esso si
osserva più spesso nei pazienti con gozzo nodulare non tossico sottostante (soprattutto gli anziani) ai
quali vengono somministrati farmaci che contengono iodio (p. es., l'amiodarone o gli espettoranti
contenenti iodio) oppure che vengono sottoposti a indagini radiologiche e cardiologiche con impiego di
mezzi di contrasto ricchi di iodio. Poiché la captazione tiroidea dello iodio radioattivo è inversamente
proporzionale all'assunzione di iodio, la bassa captazione di iodio radioattivo si spiega facilmente. Esso è
molto più comune nelle aree del pianeta con bassa o marginale assunzione di iodio dall'ambiente
(Europa occidentale continentale), ma può verificarsi anche negli USA, dove l'apporto di iodio è
adeguato. Tuttavia, l'eziologia dell'ipertiroidismo indotto dallo iodio non è chiara, ma potrebbe essere
rappresentata dalla fornitura di iodio in eccesso a piccole aree di tessuto tiroideo autonomo.
L'ipertiroidismo normalmente persiste finché è presente l'eccesso di iodio in circolo ed è più difficile da
controllare rispetto alle altre cause di ipertiroidismo.
Carcinoma tiroideo metastatizzato: la sovraproduzione di ormone tiroideo si verifica eccezionalmente a
partire da un carcinoma follicolare metastatizzato, particolarmente ai polmoni.
Struma ovarii: raramente, i teratomi ovarici contengono una quantità di tessuto tiroideo sufficiente a
provocare un vero e proprio ipertiroidismo, solo che la sua localizzazione è nella pelvi e la captazione di
iodio radioattivo da parte della tiroide ne risulta soppressa.
l
Sintomi e segni
La maggior parte dei sintomi e dei segni dell'ipertiroidismo è uguale per tutte le forme, con alcune
eccezioni come l'oftalmopatia infiltrativa (comune) e la dermopatia (rara), che sono manifestazioni
autoimmunitarie del morbo di Graves e non vengono osservate in caso di eziologia diversa.
La presentazione clinica dell'ipertiroidismo può essere drastica o subdola. Segni e sintomi comuni sono: il
gozzo; la tachicardia; l'aumento della pressione differenziale; la cute calda, sottile e umida; il tremore; i
segni oculari (v. oltre); la fibrillazione atriale; l'irritabilità e l'iperattività; l'aumento della sudorazione;
l'intolleranza al caldo; le palpitazioni; la stanchezza; l'aumento dell'appetito; la perdita di peso; l'insonnia;
la debolezza e l'accentuazione della peristalsi (occasionalmente la diarrea). Molti sintomi
dell'ipertiroidismo sono simili a quelli dell'iperstimolazione simpatica. Le persone più anziane, in
particolare quelle con gozzo nodulare tossico, possono esordire atipicamente con un ipertiroidismo
silente o mascherato (v. Cap. 293).
I segni oculari osservati nei pazienti con ipertiroidismo comprendono sguardo fisso, rarità
dell'ammiccamento, retrazione palpebrale e iperemia congiuntivale di grado lieve. Questi segni oculari
sono prevalentemente dovuti alla stimolazione adrenergica eccessiva e solitamente scompaiono con un
trattamento efficace. L'oftalmopatia infiltrativa costituisce uno stadio evolutivo più avanzato ed è specifica
del morbo di Graves. È caratterizzata da dolore orbitario, lacrimazione, irritazione, fotofobia, aumento del
tessuto retrorbitario, esoftalmo e infiltrazione linfocitaria dei muscoli extraoculari, che può provocare
astenia muscolare oculare portando spesso a diplopia.
La dermopatia infiltrativa, chiamata anche mixedema pretibiale (termine fuorviante, dato che il mixedema
fa pensare all'ipotiroidismo), è caratterizzata da un'infiltrazione senza fovea da parte di una sostanza
proteinacea amorfa, di solito nella zona pretibiale. Essa raramente si presenta in assenza
dell'oftalmopatia di Graves. La lesione è spesso pruriginosa ed eritematosa nelle sue fasi iniziali, per poi
divenire successivamente ispessita e dura. Come l'oftalmopatia, la dermopatia infiltrativa può comparire
con anni di anticipo o di ritardo rispetto all'ipertiroidismo.
L'ipertiroidismo della gravidanza molare, del coriocarcinoma e dell'iperemesi gravidica è transitorio, e una
funzione tiroidea normale si ristabilisce quando la gravidanza molare viene eliminata, il coriocarcinoma
viene adeguatamente trattato o l'iperemesi gravidica scompare.
I pazienti con gozzo nodulare tossico non hanno alcuna delle manifestazioni di tipo autoimmune, né gli
anticorpi circolanti osservati nei pazienti con morbo di Graves. Infine, contrariamente al morbo di Graves,
che può recedere spontaneamente, il gozzo tossico uninodulare e quello multinodulare solitamente non
recedono.
La crisi tireotossica è caratterizzata dall'insorgenza improvvisa di una sintomatologia ipertiroidea più
accentuata, con esacerbazione di alcuni sintomi e presenza di segni atipici. Vi sono compresi febbre,
astenia e deperimento muscolare marcati, irrequietezza estrema con ampie oscillazioni dell'umore,
confusione, psicosi o perfino coma ed epatomegalia con ittero lieve. Il paziente può presentarsi con
collasso cardiocircolatorio e shock. La crisi tireotossica, che è rara nei bambini, è il risultato di un
ipertiroidismo non trattato o trattato inadeguatamente e può essere precipitata da un'infezione, un trauma,
un intervento chirurgico, un'embolia, un'acidosi diabetica o una tossiemia gravidica o da parto. La crisi
tireotossica è un'emergenza che mette in pericolo la vita e che richiede un trattamento immediato e
specifico (v. Tab. 8-3).
Nell'ipertiroidismo gli aumenti della T 3 sierica sono di solito alquanto superiori a quelli della T4,
probabilmente a causa dell'aumento sia della secrezione tiroidea di T 3 sia della conversione periferica
della T4 in T3. In alcuni pazienti ipertiroidei è elevata soltanto la T 3; questa condizione è chiamata
T3-tossicosi.
La T3-tossicosi si può verificare in ognuno dei disordini abituali che determinano ipertiroidismo, tra i quali il
morbo di Graves, il gozzo multinodulare e il nodulo tiroideo solitario autonomamente funzionante. Se la
T3-tossicosi non viene trattata, il paziente di solito sviluppa le tipiche alterazioni di laboratorio
dell'ipertiroidismo, cioè l'innalzamento della T 4 e della captazione dello 123I. Ciò suggerisce che la
T3-tossicosi è una manifestazione precoce dell'ipertiroidismo abituale e che deve essere trattata come
tale.
Le varie forme di tiroidite hanno generalmente una fase ipertiroidea. Alcune sono state esposte in
precedenza e altre verranno trattate oltre alla voce Tiroiditi.
l
Diagnosi
La diagnosi di ipertiroidismo solitamente non offre difficoltà e si basa su un'anamnesi e un esame
obiettivo accurati, su un forte indice di sospetto e sui consueti test di funzionalità tiroidea. Un dosaggio
del TSH sierico è il miglior test da eseguire per primo, poiché il TSH è sempre soppresso nei pazienti
ipertiroidei, tranne quando la causa è un tumore ipofisario secernente TSH o una resistenza ipofisaria agli
ormoni tiroidei. Deve quindi essere misurata la T4 libera e se essa risulta normale deve essere
determinata la T3 sierica (v. sopra).
Con l'aiuto delle indagini di laboratorio di conferma, le cause principali di ipertiroidismo possono spesso
essere diagnosticate clinicamente. Tuttavia, l'eziologia non è sempre evidente ed è indicata l'esecuzione
di ulteriori indagini. Un possibile approccio per la distinzione delle cause di ipertiroidismo è quello di
eseguire un test di captazione tiroidea di iodio radioattivo con 123I. In quasi tutte le situazioni in cui
l'ipertiroidismo è dovuto alla sovraproduzione ormonale, la captazione tiroidea di iodio radioattivo è
elevata.
La T3-tossicosi è difficile da diagnosticare perché la T 3 di solito non viene misurata quando si valuta la
funzione tiroidea, a meno che il paziente non abbia un TSH sierico soppresso e livelli di T 4 libera normali.
I criteri per porre la diagnosi sono (1) la presenza di sintomi e segni sfumati di ipertiroidismo, (2) un livello
di T4 libera normale e (3) un livello sierico di TSH soppresso.
Nel morbo di Graves, gli anticorpi contro il recettore tiroideo per il TSH possono essere misurati con la
tecnica dello spiazzamento del TSH marcato con 125I da membrane cellulari tiroidee purificate, oppure
mediante la stimolazione della sintesi di AMP ciclico da parte di cellule tiroidee in coltura (test per gli
anticorpi tireo-stimolanti). Il dosaggio degli anticorpi contro il recettore per il TSH è raramente necessario,
tranne durante l'ultimo trimestre di gravidanza, per prevedere la possibile insorgenza di un morbo di
Graves neonatale; gli anticorpi contro il recettore per il TSH attraversano facilmente la placenta per
stimolare la tiroide fetale. Sebbene questi anticorpi possano ridursi durante il trattamento con farmaci
antitiroidei dei pazienti con morbo di Graves in fase di remissione, questo metodo viene impiegato
raramente per prevedere la remissione. La maggior parte dei pazienti con morbo di Graves possiede
anticorpi circolanti antiperossidasi tiroidea e un numero minore possiede anticorpi anti- tireoglobulina. Dal
momento che le determinazioni quantitative di questi anticorpi sono facilmente eseguibili nella maggior
parte dei laboratori, esse possono essere di aiuto per stabilire se l'ipertiroidismo ha una causa
autoimmune.
L'inappropriata secrezione di TSH è infrequente e la diagnosi è confermata quando l'ipertiroidismo si
presenta con innalzamento delle concentrazioni di T 4 e T3 libere e con livelli sierici di TSH normali o
elevati.
Un nodulo "caldo" singolo concentra tutto lo 123I con soppressione del resto della tiroide alla scintigrafia e
aree multiple di aumento e di riduzione della captazione di 123I vengono osservate nei pazienti con noduli
multipli.
l
Terapia
Per l'ipertiroidismo esiste un gran numero di trattamenti, impiegati a seconda dell'eziologia.
Iodio: lo iodio in dosi farmacologiche inibisce il rilascio di T 3 e T4 in poche ore e impedisce
l'organificazione dello iodio, un effetto transitorio che dura da pochi giorni a una settimana (fenomeno
della fuga). Lo iodio viene usato per il trattamento di emergenza della crisi tireotossica, per i pazienti
ipertiroidei che devono essere sottoposti a interventi chirurgici non tiroidei d'urgenza e (dal momento che
esso riduce la vascolarizzazione della tiroide) per la preparazione preoperatoria dei pazienti ipertiroidei
che devono essere sottoposti a tireoidectomia subtotale. Generalmente lo iodio non viene impiegato di
routine per la terapia dell'ipertiroidismo. La dose usuale è di due o tre gocce di una soluzione satura di
ioduro di potassio PO da tid a qid (da 300 a 600 mg/die), o 0,5 g di ioduro di sodio in 1 l di soluzione
fisiologica somministrati lentamente EV q 12 h.
Le complicanze della terapia con iodio sono costituite dall'infiammazione delle ghiandole salivari, dalla
congiuntivite e dalle eruzioni cutanee. Inoltre, nei pazienti con gozzi non tossici, si può osservare
l'induzione di un ipertiroidismo transitorio (malattia di Jod-Basedow) in seguito alla somministrazione di
farmaci o mezzi di contrasto contenenti iodio. Paradossalmente, questi ultimi sono utili per la
preparazione rapida dei pazienti per gli interventi sulla tiroide quando le procedure standard non
ottengono effetto. Il sodio ipodato e l'acido iopanoico forniscono un eccesso di iodio e sono potenti
inibitori della conversione della T4 in T3. La combinazione di questi agenti con il desametasone, anch'esso
un potente inibitore della conversione della T 4 in T3, può risolvere i sintomi dell'ipertiroidismo e riportare la
concentrazione sierica della T3 ai valori normali entro una settimana.
Propiltiouracile e metimazolo: sono farmaci antitiroidei che riducono l'organificazione dello ioduro e
impediscono la reazione di condensazione. Sebbene le segnalazioni non siano univoche, sembra che dal
16 al 40% dei pazienti con morbo di Graves rimanga in stato di remissione dopo la sospensione di un
ciclo terapeutico di 1 o 2 anni condotto con uno dei due farmaci. Il ritorno alla normalità o la marcata
riduzione delle dimensioni della ghiandola, il ripristino di un normale livello sierico di TSH e la presenza di
un ipertiroidismo di gravità minore prima dell'inizio della terapia sono segni prognostici favorevoli per la
remissione a lungo termine del morbo di Graves. L'impiego concomitante della terapia farmacologica
antitiroidea e della l-tiroxina per migliorare il tasso di remissione nei pazienti con morbo di Graves rimane
controverso. Poiché il gozzo nodulare tossico va di rado incontro a remissione, la terapia farmacologica
antitiroidea viene somministrata esclusivamente in preparazione al trattamento chirurgico o a una terapia
con 131I.
Il propiltiouracile (ma non il metimazolo) ad alte dosi inibisce anche la conversione periferica della T4 in
T3. La dose di partenza abituale per il propiltiouracile va da 100 a 150 mg PO q 8 h e per il metimazolo da
15 a 30 mg PO giornalmente. Quando il paziente diviene eutiroideo il dosaggio viene ridotto alla dose
minima efficace, di solito da 100 a 150 mg/die di propiltiouracile in due o tre dosi frazionate o da 10 a 15
mg/die di metimazolo. In genere, si ottiene il controllo in circa tre mesi. Un controllo più rapido può essere
ottenuto aumentando la dose di propiltiouracile tra 450 e 600 mg/die. Dosi di propiltiouracile di questa
entità o maggiori (da 800 a 1200 mg/ die) sono in genere riservate ai pazienti più gravi, tra i quali quelli
con crisi tireotossica. Le dosi di mantenimento possono essere continuate per uno o molti anni a seconda
della situazione clinica. Il carbimazolo, ampiamente usato in Europa, viene rapidamente convertito in
metimazolo in vivo. La dose iniziale abituale è simile a quella del metimazolo; la dose di mantenimento è
di 10-15 mg/ die.
Gli effetti collaterali di questi farmaci comprendono reazioni allergiche, nausea, perdita del gusto e, in
meno dell'1% dei pazienti, agranulocitosi reversibile. Se il paziente è allergico a un farmaco, è lecito fare
un tentativo con l'altro, ma esiste la possibilità di una sensibilità crociata. Se si verifica agranulocitosi,
passare a un altro farmaco è inaccettabile e va intrapresa una terapia più risolutiva, come la
somministrazione di radioiodio o l'intervento chirurgico.
È difficile stabilire quale farmaco sia preferibile. Il metimazolo ha una durata d'azione più prolungata e
può essere somministrato una volta al giorno, il che migliora la compliance del paziente. Inoltre, quando il
metimazolo viene utilizzato in dosi < 40 mg/die, l'agranulocitosi è meno comune; con il propiltiouracile,
l'agranulocitosi può insorgere con qualunque dosaggio. Il propiltiouracile può essere preferito se la
terapia farmacologica antitiroidea deve essere intrapresa durante la gravidanza o l'allattamento, poiché
esso passa attraverso la placenta e nel latte molto meno del metimazolo. Comunque, il metimazolo è
stato usato con successo nelle gestanti e nelle donne in allattamento senza la comparsa di complicanze
fetali o neonatali. Il propiltiouracile viene preferito anche per il trattamento della crisi tireotossica perché i
dosaggi utilizzati (da 800 a 1200 mg/die) bloccano parzialmente la conversione periferica della T 4 in T3.
β-bloccanti: i sintomi e i segni di ipertiroidismo dovuti all'ipertono adrenergico possono rispondere ai
b-bloccanti. Il propranololo è stato quello maggiormente usato. Le manifestazioni che migliorano e quelle
che non migliorano con il propranololo sono mostrate nella Tab. 8-4. Il propranololo non è utile come si
riteneva in passato per la fissità dello sguardo e la retrazione palpebrale, facendo pensare che entrambi
possano essere effetti prevalentemente di tipo a (o almeno una mescolanza di effetti a e b).
Il propranololo è indicato nella crisi tireotossica (v. Tab. 8-3). Esso riduce rapidamente la frequenza
cardiaca, di solito entro 2 o 3 h quando viene somministrato PO ed entro pochi minuti quando viene
somministrato EV. Il propranololo è altresì indicato per il trattamento immediato della tachicardia presente
in altre forme di ipertiroidismo (comprese le tiroiditi) e particolarmente nei pazienti anziani senza storia di
scompenso cardiaco congestizio, dal momento che solitamente sono necessarie diverse settimane per
ottenere un'attenuazione della sintomatologia con i farmaci antitiroidei. I calcioantagonisti possono essere
utili per controllare le tachiaritmie nei pazienti nei quali i b-bloccanti sono controindicati. Per i particolari
sulla terapia con propranololo, v. Cap. 199.
Sodio iodio radioattivo (131I): questa è la più comune forma di terapia utilizzata negli USA per i pazienti
con ipertiroidismo. Non esiste alcuna prova che il radioiodio aumenti l'incidenza dei tumori, della
leucemia, del carcinoma tiroideo o delle malformazioni congenite nei figli delle donne che hanno avuto
una gravidanza in un momento successivo. Il radioiodio è raccomandato da molti come trattamento di
scelta per il morbo di Graves e il gozzo nodulare tossico in tutti i pazienti, compresi i bambini. Il dosaggio
dello 131I è difficile da calibrare e la risposta della ghiandola non può essere prevista esattamente. Se
viene somministrata una dose di 131I sufficiente a indurre l'eutiroidismo, circa il 25% dei pazienti diverrà
ipotiroideo 1 anno più tardi e l'incidenza continuerà ad aumentare ogni anno. Quindi, la maggioranza di
questi pazienti diventerà ipotiroidea. D'altra parte, se vengono impiegate dosi più basse, vi è una
maggiore incidenza di recidiva dell'ipertiroidismo.
Trattamento chirurgico: il trattamento chirurgico è indicato per i pazienti giovani con morbo di Graves la
cui malattia è recidivata dopo un ciclo di terapia farmacologica antitiroidea e che rifiutano la terapia con
131I, nei pazienti che non sono in grado di tollerare altri farmaci a causa di ipersensibilità o altri problemi,
nei pazienti con gozzi di dimensioni molto grandi e in alcuni pazienti più giovani con adenoma tossico e
gozzo multinodulare. Il trattamento chirurgico può essere eseguito nei pazienti anziani con gozzi nodulari
giganti.
Esso offre buone prospettive di recupero di una funzione normale. Le recidive postoperatorie variano tra il
2 e il 9%; il rischio di ipotiroidismo è direttamente correlato all'estensione del trattamento chirurgico.
Complicanze non comuni, ma difficili da trattare, sono la paralisi delle corde vocali e l'ipoparatiroidismo.
Prima dell'intervento, per ridurre la vascolarizzazione della ghiandola, va somministrata per 2 sett. una
soluzione satura di ioduro di potassio, 3 gocce PO tid (circa 300-500 mg/die). Inoltre devono essere
somministrati propiltiouracile o metimazolo, poiché il paziente deve essere eutiroideo prima di poter
somministrare lo ioduro. Come è stato notato precedentemente, l'aggiunta di desametasone e di mezzi di
contrasto iodati può essere utilizzata per ripristinare rapidamente uno stato di eutiroidismo. Le procedure
chirurgiche sono più difficoltose nei pazienti già sottoposti in precedenza a tiroidectomia o terapia con
radioiodio.
Crisi tireotossica: un regime terapeutico per la crisi tireotossica è riportato nella Tab. 8-3.
Dermopatia e oftalmopatia infiltrativa:
corticosteroidi topici possono talvolta
spontaneamente dopo alcuni mesi o
dall'endocrinologo e dall'oculista e può
l'intervento chirurgico.
nella dermopatia infiltrativa riscontrata nel morbo di Graves i
attenuare il prurito. La dermopatia di solito si risolve
anni. L'oftalmopatia deve essere trattata congiuntamente
richiedere i FANS, i corticosteroidi, l'irradiazione orbitaria e
IPOTIROIDISMO
Sommario:
Introduzione
Sintomi e segni
Diagnosi
Terapia
Risposta clinica caratteristica al deficit di ormone tiroideo nell'adulto.
L'ipotiroidismo primitivo, la forma più comune, è probabilmente una malattia autoimmune, che si
presenta di solito come conseguenza di una tiroidite di Hashimoto ed è spesso associata a un gozzo di
consistenza dura o, più tardivamente nell'evoluzione della malattia, a una ghiandola tiroidea fibrosa e
grinza con funzionalità ridotta o assente. La seconda forma più frequente è l'ipotiroidismo
post-terapeutico, specialmente successivo a terapia con iodio radioattivo o a intervento chirurgico per
ipertiroidismo. L'ipotiroidismo che si verifica in caso di eccesso di terapia con propiltiouracile, metimazolo
e ioduro solitamente regredisce dopo l'interruzione della terapia. Un lieve ipotiroidismo è comune nelle
donne anziane.
La maggior parte dei pazienti con gozzo non dovuto a tiroidite di Hashimoto è eutiroidea o ipertiroidea,
ma un ipotiroidismo con gozzo può manifestarsi nel gozzo endemico. Il deficit di iodio riduce
l'ormonogenesi tiroidea; viene secreto TSH, la tiroide si ingrandisce sotto lo stimolo dell'ormone, capta
avidamente lo iodio e compare il gozzo. Se il deficit di iodio è grave, il paziente diviene ipotiroideo, ma
questa malattia è praticamente scomparsa negli USA dal momento dell'introduzione del sale iodato. Il
cretinismo endemico è la più comune causa di ipotiroidismo congenito nelle regioni gravemente carenti di
iodio e la principale causa di deficienza mentale in tutto il mondo.
Rari deficit enzimatici ereditari possono alterare la sintesi degli ormoni tiroidei e causare ipotiroidismo con
gozzo (v. anche Gozzi congeniti nel Cap. 269).
L'ipotiroidismo secondario si verifica quando esiste un'insufficienza dell'asse ipotalamo-ipofisario
dovuta a un deficit della secrezione di TRH da parte dell'ipotalamo o della secrezione di TSH da parte
dell'ipofisi.
l
Sintomi e segni
I sintomi e i segni dell'ipotiroidismo primario generalmente sono in evidente contrasto con quelli
dell'ipertiroidismo e possono avere un esordio alquanto sfumato e insidioso. L'espressione del volto è
ottusa; la voce è roca e l'eloquio è lento; il gonfiore facciale e periorbitale è causato dall'infiltrazione da
parte dei mucopolisaccaridi acido ialuronico e condroitin-solfato; l'intolleranza al freddo può essere
notevole; le palpebre sono abbassate a causa della diminuzione del tono adrenergico; i capelli sono radi,
crespi e secchi, la pelle è ruvida, secca, squamosa e ispessita. L'aumento di peso è modesto ed è in gran
parte dovuto alla riduzione del metabolismo alimentare e alla ritenzione di liquidi. I pazienti hanno un
deficit di memoria e mostrano altri segni di compromissione delle funzioni intellettive, con una graduale
modificazione della personalità. Alcuni appaiono depressi e può essere presente una psicosi franca
("follia mixedematosa").
C'è spesso ipercarotenemia, particolarmente evidente alle palme delle mani e alle piante dei piedi, a
causa del deposito di carotene negli strati epidermici ricchi di lipidi. Il deposito di sostanze proteinacee
nella lingua può produrre macroglossia. La riduzione sia degli ormoni tiroidei sia della stimolazione
adrenergica provoca bradicardia. Il cuore può essere ingrandito, in parte a causa di dilatazione, ma
principalmente per l'accumulo di un versamento sieroso ad alto contenuto proteico nel sacco pericardico.
Si possono rilevare versamenti pleurici o peritoneali. I versamenti pleurici e pericardici si sviluppano
lentamente e solo raramente provocano difficoltà respiratorie o emodinamiche. I pazienti generalmente
accusano stipsi, che può essere grave. Sono comuni le parestesie delle mani e dei piedi, spesso dovute
alla sindrome del tunnel carpale-tarsale causata dal deposito di una sostanza amorfa proteinacea nei
legamenti intorno al polso e alla caviglia, con conseguente compressione dei nervi. I riflessi possono
essere di grande aiuto dal punto di vista diagnostico, a causa della vivacità di contrazione e della
lentezza dei tempi di rilassamento. Le donne con ipotiroidismo manifestano spesso menorragia, in
contrasto con l'ipomenorrea dell'ipertiroidismo. Si osserva frequentemente ipotermia. Spesso è presente
anemia, di solito normocromica normocitica e a eziologia sconosciuta, ma essa può essere ipocromica a
causa della menorragia e talvolta macrocitica a causa dell'associata anemia perniciosa o del ridotto
assorbimento di acido folico. In genere, l'anemia è raramente grave (Hb > 9 g/dl). Essa recede con la
correzione dello stato ipometabolico, richiedendo talvolta da 6 a 9 mesi.
Il coma mixedematoso è una complicanza dell'ipotiroidismo potenzialmente letale. Le sue caratteristiche
comprendono un ipotiroidismo di fondo di lunga durata, uno stato di coma con ipotermia estrema
(temperature da 24 a 32,2°C [da 75,2 a 90°F]), areflessia, convulsioni, ritenzione di CO 2 e depressione
respiratoria. L'ipotermia grave può non essere riconosciuta, a meno che non vengano impiegati
termometri speciali con scala di lettura per le basse temperature. È imperativo porre la diagnosi
rapidamente basandosi sul giudizio clinico, sull'anamnesi e sull'esame obiettivo, perché c'è la probabilità
di un decesso precoce. I fattori precipitanti comprendono l'esposizione al freddo, le malattie, le infezioni, i
traumi e i farmaci che deprimono il SNC.
l
Diagnosi
È importante distinguere l'ipotiroidismo secondario da quello primitivo; anche se l'ipotiroidismo secondario
non è frequente, spesso coinvolge altri organi endocrini sotto il controllo dell'asse ipotalamo-ipofisario. In
una donna con ipotiroidismo noto, gli indizi che orientano verso l'ipotiroidismo secondario sono una storia
di amenorrea piuttosto che di menorragia e alcune differenze indicative all'esame obiettivo.
Nell'ipotiroidismo secondario la cute e i capelli sono secchi, ma non altrettanto ruvidi; spesso si osserva
depigmentazione cutanea; la macroglossia non è così pronunciata; le mammelle sono atrofiche; il cuore è
piccolo, senza accumulo di versamenti sierosi nel sacco pericardico; la PA è bassa e spesso si rileva
ipoglicemia a causa della concomitante insufficienza corticosurrenalica o del deficit di ormone della
crescita.
Le indagini di laboratorio dimostrano la presenza di un basso livello di TSH circolante nell'ipotiroidismo
secondario (benché il TSH sierico possa essere normale alla misurazione con tecniche immunologiche,
ma abbia ridotta attività biologica), mentre nell'ipotiroidismo primitivo manca la retroinibizione sull'ipofisi
normale e i livelli sierici di TSH sono elevati. Il dosaggio del TSH sierico è l'esame più semplice e più
sensibile per la diagnosi di ipotiroidismo primitivo. In quest'ultimo il colesterolo sierico è generalmente
elevato, mentre lo è meno in quello secondario. Altri ormoni ipofisari e i corrispondenti ormoni dei loro
tessuti bersaglio possono essere diminuiti nell'ipotiroidismo secondario.
Il test al TRH (v. sopra Valutazione di laboratorio della funzione tiroidea) può essere utile ai fini della
distinzione tra ipotiroidismo secondario a un'insufficienza ipofisaria e ipotiroidismo dovuto a insufficienza
ipotalamica. In quest'ultimo, viene rilasciato TSH in risposta al TRH.
La determinazione dei livelli sierici totali di T 3 nell'ipotiroidismo merita una menzione. Oltre
all'ipotiroidismo primitivo e a quello secondario, altre condizioni sono caratterizzate dalla riduzione dei
livelli circolanti di T3 totale; esse comprendono la riduzione della TBG sierica, gli effetti di alcuni farmaci
(v. sopra) e della euthyroid sick syndrome dovuta a patologie acute e croniche, l'inanizione e le diete
povere di carboidrati (v. sopra per la trattazione della euthyroid sick syndrome).
Nell'ipotiroidismo di gravità maggiore, sono diminuiti i livelli sierici sia di T 3 sia di T4. Tuttavia, molti
pazienti con ipotiroidismo primitivo (elevato TSH sierico, basso livello sierico di T 4) possono avere normali
livelli circolanti di T3, probabilmente a causa della prolungata stimolazione da parte del TSH sulla tiroide
insufficiente, che determina la sintesi e la secrezione preferenziale dell'ormone biologicamente attivo T 3.
l
Terapia
Sono disponibili diverse preparazioni di ormoni tiroidei per la terapia sostitutiva, le quali comprendono le
preparazioni sintetiche di T4 (l-tiroxina), la triiodotironina (liotironina), le associazioni dei due ormoni
sintetici e la tiroide animale essiccata. Vengono preferite le preparazioni sintetiche di T4 (l-tiroxina); il
dosaggio medio di mantenimento va da 75 a 125 mg/die PO, ma le dosi iniziali devono essere molto più
basse, specialmente negli anziani, nei pazienti cardiopatici e in quelli con ipotiroidismo di vecchia data o
di particolare gravità (tranne per il coma mixedematoso). L'assorbimento è abbastanza costante, intorno
al 70% della dose. La T3 viene generata a partire dalla T 4 nei tessuti periferici. In generale, la dose di
mantenimento può essere diminuita nell'anziano e aumentata nelle donne in gravidanza. La dose può
anche dover essere aumentata se vengono somministrati contemporaneamente farmaci che riducono
l'assorbimento della T4 o aumentano la sua escrezione biliare. Per le dosi medie nella prima e nella
seconda infanzia, v. Ipotiroidismo nel Cap. 269. La dose impiegata deve essere la dose minima in grado
di riportare alla norma i livelli sierici di TSH (benché questo criterio non possa essere utilizzato nei
pazienti con ipotiroidismo secondario).
La T3 (liotironina sodica) non deve essere usata da sola per la terapia sostitutiva a lungo termine,
perché il suo rapido turnover richiede che essa venga assunta due volte al giorno. La somministrazione di
quantitativi sostitutivi standard di T 3 (da 25 a 50 mg/die) determina un rapido innalzamento dei livelli
sierici di T3 fino a valori compresi fra 300 e 1000 ng/dl (fra 4,62 e 15,4 nmol/l) entro 2-4 ore, grazie al suo
assorbimento pressoché completo; questi livelli ritornano alla norma entro 24 h. Pertanto, nella
valutazione dei livelli sierici di T 3 nei pazienti sottoposti a questo regime terapeutico, il medico deve
conoscere il momento in cui l'ormone è stato somministrato. In aggiunta, i pazienti che assumono T 3 sono
chimicamente ipertiroidei per almeno alcune ore al giorno e così possono essere esposti a maggiori rischi
cardiaci.
Un andamento simile dei livelli sierici di T 3 si osserva quando vengono assunte per via orale miscele di T 3
e T4, benché i livelli di picco del T 3 siano alquanto più bassi dal momento che ne viene somministrata una
quantità inferiore. I regimi sostitutivi con preparazioni sintetiche di T 4 mostrano un andamento differente
nella risposta della T3 sierica. Gli aumenti della T 3 avvengono gradualmente e, quando vengono
somministrate dosi adeguate di T 4, i livelli si mantengono normali. Le preparazioni di tiroide animale
essiccata contengono quantità variabili di T 3 e di T4 e non devono essere prescritte a meno che il
paziente non abbia risposto bene a questa terapia per anni.
Il coma mixedematoso viene trattato con un'alta dose iniziale di T 4 (da 200 a 500 mg EV) o di T 3 (40 mg
EV). La dose di mantenimento per la T4 va da 50 a 100 mg/die EV, e per la T3 da 10 a 20 mg/ die EV, fino
a quando non si può somministrare T 4 per via orale. Vengono somministrati anche corticosteroidi, perché
inizialmente non può essere esclusa la possibilità di un ipotiroidismo di natura centrale. Il paziente non
deve essere riscaldato rapidamente, per evitare il pericolo di aritmie cardiache. L'ipossiemia è comune,
perciò all'inizio del trattamento deve essere misurata la Pa o2. Se la ventilazione alveolare è
compromessa, è necessaria l'assistenza ventilatoria meccanica immediata. La malattia precipitante deve
essere prontamente e appropriatamente trattata, e la reintegrazione idrica condotta con prudenza, perché
i pazienti ipotiroidei non eliminano l'acqua in maniera adeguata. Infine, tutti i farmaci devono essere
somministrati con cautela poiché, vengono metabolizzati più lentamente di quanto avviene nelle persone
normali.