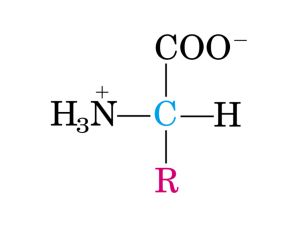
Tutti gli amminoacidi presenti nelle proteine sono alfaamminoacidi.
All’atomo di carbonio alfa sono legati un gruppo
carbossilico (-COOH), un gruppo amminico (-NH2), un
atomo di idrogeno ed una catena laterale (gruppo R).
La catena laterale è diversa per struttura, dimensioni e carica.
L’atomo di carbonio alfa è detto asimmetrico o chirale
perché lega quattro gruppi diversi. La glicina non possiede
un atomo di carbonio chirale in quanto il suo gruppo R è
rappresentato da un atomo di idrogeno.
Classificazione degli amminoacidi
In base alle caratteristiche chimiche del gruppo
R gli amminoacidi possono essere classificati
come:
•non polari (idrofobici);
•polari (senza carica);
•acidi (carichi negativamente);
•basici (carichi positivamente).
Caratteristiche chimiche della catena laterale
Le proprietà chimiche del gruppo R conferiscono
caratteristiche particolari a ciascun amminoacido e
definiscono il tipo di interazioni che si possono originare.
•Gli amminoacidi con gruppo R non polare possono
formare interazioni idrofobiche.
•Gli amminoacidi con gruppo R polare non carico
possono formare legami H.
•Gli amminoacidi con gruppo R carico possono formare
legami ionici.
In certain proteins, non-standard amino acids
are substituted for standard stop codons,
depending on associated signal sequences in
the messenger RNA. For example, UGA can
code for selenocysteine, and UAG can code
for pyrrolysine.
Selenocysteine is now viewed as the 21st
amino acid, and pyrrolysine is viewed as the
22nd
Selenocysteine has a structure similar to that of
cysteine, but with an atom of selenium taking the
place of the usual sulfur, forming a selenol group.
Proteins that contain one or more selenocysteine
residues are called selenoproteins. There are more
than 20 human proteins that contain selenocysteine
selenol group
Pyrrolysine (abbreviated as Pyl or O) is a naturally occurring,
genetically coded amino acid used by some methanogenic archaea
and one known bacterium in enzymes that are part of their methaneproducing metabolism. It is similar to lysine, but with an added
pyrroline ring linked to the end of the lysine side chain. Produced by
a specific tRNA and aminoacyl tRNA synthetase, it forms part of an
unusual genetic code in these organisms, and is considered the 22nd
proteinogenic amino acid.
Alcuni
dei
20
amminoacidi
ordinari
proteinogenici sono detti essenziali (o standard),
in quanto non possono essere biosintetizzati
direttamente da un organismo, devono pertanto
essere assunti col cibo.
Essenziali per l'uomo sono la lisina, la leucina,
l'isoleucina, la metionina, la fenilalanina, la
treonina, il triptofano, la valina, e, nei bambini,
l'istidina e l'arginina.
Zwitterioni
Comportamento acido-base
Le basicità relative dell’anione carbossilato e del gruppo amminico indicano che gli
amminoacidi debbano esistere come ioni dipolari, anche detti zwitterioni, in cui il
gruppo amminico è protonato mentre il carbossile esiste come ione carbossilato.
A valori di pH:
•molto bassi, l’amminoacido esiste in una forma (1) in cui il gruppo amminico e il
carbossile sono entrambi protonati: esso porta, quindi, una carica netta positiva ed è
un acido diprotico,
•elevati, l’amminoacido reca, invece, una carica netta negativa (3) e presenta due siti
basici ai quali può subire la protonazione,
•intermedi, l’amminoacido esiste prevalentemente come zwitterione (2) che non
possiede carica netta.
Il valore di pH in cui la concentrazione dello zwitterione è massima è conosciuto
come punto isoelettrico, pI, dell’amminoacido.
Al punto isoelettrico, pI, l’amminoacido rimane immobile all’interno
di un campo elettrico, cioè non migra né verso il polo positivo né
verso il polo negativo poiché le sue cariche sono esattamente
bilanciate.
Al contrario, a bassi valori di pH, l’amminoacido reca una carica
positiva e migra verso il polo negativo mentre, ad alti valori di pH,
reca una carica negativa e migra verso il polo positivo.
Questi concetti sono alla base della tecnica chiamata elettroforesi, un
processo tramite il quale è possibile separare composti in base alle
loro cariche elettriche.
simbolo
tipo di R
PM
pI
pK1
pK2
pKr
A
Ala
idrofobo
89,09
6,11
2,35
9,87
C
Cys
idrofilo
121,16
5,05
1,92
10,70
8,37
D
Asp
acido
133,10
2,85
1,99
9,90
3,90
E
Glu
acido
147,13
3,15
2,10
9,47
4,07
F
Phe
idrofobo
165,19
aromatico
5,49
2,20
9,31
G
Gly
idrofobo
75,07
6,06
2,35
9,78
H
His
basico
155,16
7,60
1,80
9,33
I
Ile
idrofobo
131,17
6,05
2,32
9,76
K
Lys
basico
146,19
9,60
2,16
9,06
L
Leu
idrofobo
131,17
6,01
2,33
9,74
M
Met
idrofobo
149,21
5,74
2,13
9,28
N
Asn
idrofilo
132,12
5,41
2,14
8,72
P
Pro
idrofobo
115,13
6,30
1,95
10,64
Q
Gln
idrofilo
146,15
5,65
2,17
9,13
R
Arg
basico
174,20
10,76
1,82
8,99
S
Ser
idrofilo
105,09
5,68
2,19
9,21
T
Thr
idrofilo
119,12
5,60
2,09
9,10
V
Val
idrofobo
117,15
6,00
2,39
9,74
W
Trp
idrofobo
204,23
5,89
2,46
9,41
Y
Tyr
idrofilo
181,19
5,64
2,20
9,21
6,04
10,54
12,48
10,46
L'istidina è un amminoacido polare, la sua molecola è chirale.
L'enantiomero L è uno dei 20 amminoacidi ordinari, il suo gruppo
laterale reca un anello imidazolico. Negli esseri umani è considerato
essenziale, per i bambini e durante lo sviluppo.
L'anello imidazolico che l'istidina reca sulla sua molecola ha un pKa
di 6.0: ciò fa sì che piccole variazioni di pH nell'ambiente cellulare,
che è in genere attorno a valori di pH neutri, possano cambiare il
segno della sua ionizzazione. Per questa ragione, il residuo
dell'istidina è di fondamentale importanza nelle proteine, e compare
nei siti in cui può coordinare ioni metallici o i substrati su cui va ad
esercitare la sua attività enzimatica.
L'imidazolo contiene un atomo di azoto di tipo
pirrolico ed uno di tipo piridinico.
La molecola è essenzialmente piana e quasi
regolare.
Gli imidazoli sono basi moderatamente forti.
Il pKa dell'acido coniugato è 7.00:
formano perciò sali con molti acidi inorganici.
L'anello imidazolico ha due atomi di azoto con differenti proprietà;
uno (quello che ha legato a sé un atomo di idrogeno) condivide il
suo doppietto di elettroni nell'anello aromatico ed è quindi
lievemente acido, l'altro invece condivide nell'anello aromatico un
solo elettrone lasciando il suo doppietto di elettroni disponibile ed
è quindi basico.
Queste proprietà vengono sfruttate negli enzimi in vari modi. Nelle cosiddette triadi
catalitiche l'azoto basico dell'istidina viene usato per rimuovere uno ione H+ dalla serina,
dalla treonina o dalla cisteina per attivarle come nucleofili.
Nel trasferimento di protoni via istidina (hystidine proton shuttle) l'istidina trasferisce
uno ione H+ estraendolo da un donatore tramite il suo azoto basico e cedendo lo ione H+
legato al suo atomo di azoto acido ad un accettore.
Nell'enzima anidrasi carbonica l'istidina viene usata per allontanare rapidamente ioni H+
da una molecola d'acqua legata ad uno ione zinco per rigenerare la forma attiva
dell'enzima.
Infine, l'istidina è un precursore della biosintesi dell'istamina.