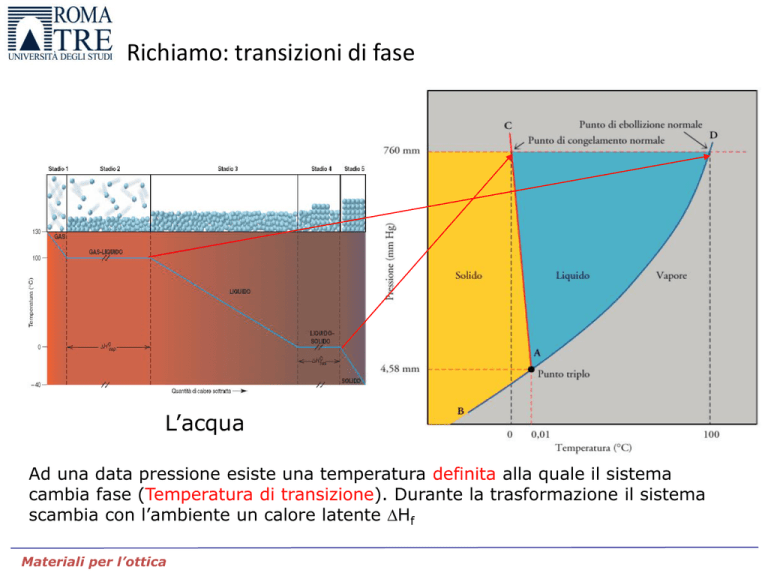
Richiamo: transizioni di fase
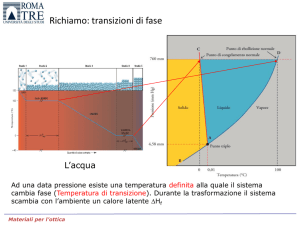
L’acqua
Ad una data pressione esiste una temperatura definita alla quale il sistema
cambia fase (Temperatura di transizione). Durante la trasformazione il sistema
scambia con l’ambiente un calore latente Hf
Materiali per l’ottica
Richiamo: transizioni di fase
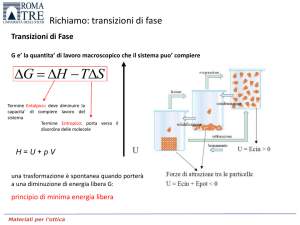
Transizioni di Fase
G e’ la quantita’ di lavoro macroscopico che il sistema
puo’ compiere a T e P costanti. Bilancio tra la tendenza del
Sistema a minimizzare l’energia e massimizzare l’entropia.
G H TS
Termine Entalpico: quantita’ di calore
scambiata a P cost
Termine Entropico: quantita’ di calore
utilizzata per andare verso stato
disordinato
H=U+pV
una trasformazione è spontanea quando porterà
a una diminuzione di energia libera G:
principio di minima energia libera
Materiali per l’ottica
Richiamo: transizioni di fase
Cambiamenti di stato
Discontinuità del volume
(densità) alla transizione di
fase
•Le transizioni di fase del primo ordine sono quelle che coinvolgono un calore latente. Durante tali transizioni, un
sistema termodinamico assorbe o rilascia una quantità di energia fissa, e generalmente grande. Poiché l'energia non può
essere istantaneamente trasferita dal sistema all'ambiente circostante, le transizioni del primo ordine sono associate a
"regimi di fase mista" in cui alcune parti del sistema hanno completato la transizione, mentre altre ancora no.
•La seconda classe è detta delle transizioni di fase continue, anche chiamate transizioni di fase del secondo ordine:
queste non sono associate ad alcun calore latente.
Materiali per l’ottica
Richiamo: transizioni di fase
<iframe width="640" height="360"
src="https://www.youtube.com/embed/9x4b
PCL2UTU" frameborder="0"
allowfullscreen></iframe>
https://www.youtube.com/watch?v=9x4bP
CL2UTU
Transizione tra due fasi superficiali
(ricostruzioni superficiali, TC~80 K)
Materiali per l’ottica
Richiamo: cinetica delle transizioni di fase
La transizione di fase (es. liquido>cristallo) non si verifica sull’intera massa
simultaneamente altrimenti sarebbero coinvolti moti cooperativi degli atomi ed
elevata riduzione entropica (“troppo” ordine)
La trasformazione avviene attraverso la nucleazione di piccoli aggregati (100
atomi) e loro successivo accrescimento attraverso processi termicamente attivati
(superamento di barriere energetiche)
La cristallizzazione non può avvenire alla Tm di equilibrio dato che li’
Energia libera fase solido=Energia libera stato liquido (GS=GL)
Necessità del sottoraffreddamento per promuovere la formazione di nuclei cristallini
mediante una diminuzione della energia libera globale
Materiali per l’ottica
Richiamo: transizioni di fase
nucleazione
omogenea
eterogenea
2
r
G
*
v
4
G r G 4r
3
3
2
v
Termine di volume
<0 per T<Tm
(avviene spontaneamente)
Materiali per l’ottica
Termine di superficie
>0 per T<Tm
(costo energetico per la
creazione delle interfacce)
r<r*: il nucleo è instabile (si forma e si ridissolve)
r>r*: il nucleo è stabile e si può accrescere
indefinitivamente (continua diminuzione di G)
La tensione superficiale è definibile nel modo più elementare dal punto di vista
meccanico come la forza per unità lineare che tiene uniti i lembi di un ipotetico
taglio praticato sulla superficie libera del fluido, ovvero:
γ = dFS/d l
dove d l è la lunghezza di un tratto infinitesimo del taglio e dFS è la forza
infinitesima perpendicolare al taglio giacente sulla superficie.
Si può ricavare la stessa definizione tenendo conto del fatto che una lamina
liquida tende spontaneamente a raggiungere la configurazione di minima
superficie, per cui la tensione superficiale si definisce come:
γ = dW/d A
dove d W è il lavoro elementare compiuto contro le forze di tensione
superficiale per ottenere un aumento infinitesimo d A della superficie della
lamina.
Richiamo: transizioni di fase
Per avere la transizione bisogna superare una barriera energetica (si calcola uguagliando a zero la
definizione della slide precedente per ricavare r* e poi sostituendo)
16 3Tm2
16 3
1
G
2
3H 2f
3Gv
T Tm
*
2
Tanto più la temperatura è minore di Tm tanto più facile à la formazione di nuclei stabili
Materiali per l’ottica
Tanto più la temperatura è minore di Tm tanto più facile à la formazione di nuclei stabili….ma in realta’
esiste una temperatura ideale…
Richiamo: transizioni di fase
La velocità di accrescimento di nuclei stabili è governata da una
energia libera di attivazione G accr (dipende dalla possibilità di
diffusione su lunghe distanze e viscosità).
L’unione al nucleo comporta il passaggio dallo stato liquido a solido
(comporta una variazione di energia libera di volume e dipende da
G v )
v C 1 e
a
Materiali per l’ottica
Gv
RT
e
Gaccr
RT
Come si puo’ evitare la cristallizzazione
e ottenere un vetro?
Materiali per l’ottica lineare: vetri inorganici
Vetro: un materiale ottenuto per solidificazione da fuso senza
cristallizzazione (può esser sia di natura inorganica che organica).
In pratica è un fluido ad altissima viscosità
Caratteristiche principali:
• assenza ordine a lungo raggio (amorfo)
• assenza di un punto di fusione ben definito
• la sua viscosità diminuisce con continuità all’aumentare della temperatura
• isotropia
Si cataloga un vetro come ottico se:
•
•
•
ha proprietà ottiche ben definite e riproducibili
è otticamente omogeneo
non presenta bolle, striature, strain e inclusioni.
Materiali per l’ottica
Materiali per l’ottica lineare: vetri inorganici
Differenze tra solido vetroso rispetto ad uno cristallino:
•Il passaggio dallo stato liquido a solido avviene in modo progressivo
Continuo aumento della viscosità col raffreddamento sino a raggiungere una completa
rigidità (viscosità maggiore di 1015 poise)
Assenza del calore latente di solidificazione
•I materiali vetrosi hanno una velocità di raffreddamento al di sotto
del punto di fusione maggiore della velocità di cristallizzazione: gli
atomi si “congelano” in posizioni fuori dall’equilibrio
•I materiali che esistono nello stato vetroso sono dotati di viscosità
elevata in prossimità del punto di solidificazione.
•Lo stato vetroso non è uno stato termodinamicamente stabile
il vetro tende ad evolvere verso la cristallizzazione (minore energia libera)
Energia
devetrificazione
vetro
cristallo
configurazione
Materiali per l’ottica
Richiamo: la viscosità
Viscosità:
Quando si verifica una condizione di scorrimento relativo tra due elementi di un fluido
compare lungo l’area di contatto una forza tangenziale di attrito detta forza di attrito
interno con verso sempre contrario a quello della velocità relativa.
v1
Velocità v1>v2
Si trova sperimentalmente che il modulo
della forza di attrito interno dF dipende da:
v2
dF dS
dv
dn
dS
= area di contatto
dv/dn = variazione del modulo della
velocità in direzione normale a
dS
= viscosità del fluido (dipende dal
fluido e dalla temperatura T
La viscosità nei liquidi diminuisce con l’aumentare della temperatura (nei gas aumenta con T)
Unità di misura: kg/(ms) oppure Poise=0.1 kg/(ms)
Esempi: H2O (T=0°C)0.018 poise, H2O (T=20°C)0.010 poise
Materiali per l’ottica
Il vetro: la solidificazione
Il volume specifico (inverso della
densità) diminuisce con continuità e
non
bruscamente
come
in
una
transizione di fase di cristallizzazione.
La diminuzione del volume è più lenta
sotto la Tm (nello stato cristallino) rispetto
a quello liquido perché la contrazione è
puramente termica (diminuzione
dell’ampiezza delle vibrazioni) mentre
nello stato liquido coinvolge anche
l’impacchettamento della struttura
Transizione vetrosa
(intersezione)
Materiali per l’ottica
Temperatura di fusione/solidificazione
cristallina
Il vetro: la solidificazione
La velocità di raffreddamento
cristallizzazione. La viscosità già
è
superiore
a
quella
di
elevata va aumentando con
l’abbassamento della T: la cristallizzazione è ulteriormente inibita: gli atomi
hanno sempre meno mobilità per trovare il loro “giusto” posto
La variazione di volume specifico è continua
Il liquido è sottoraffreddato in equilibrio termodinamico metastabile
Esiste una temperatura alla quale la variazione di volume specifico
presenta un flesso: Tg=TEMPERATURA DI CONGELAMENTO O Di
TRANSIZIONE VETROSA dallo stato sotto raffreddato allo stato
vetroso
Materiali per l’ottica
Il vetro: la solidificazione
Il volume finale del solido dipende dalla velocità di raffreddamento utilizzata
In generale, le proprietà fisiche del vetro dipendono dalla sua storia termica
Materiali per l’ottica
Il vetro: oltre la solidificazione
Al punto di trasformazione la viscosità è dell’ordine di 1013 poise
Al di sotto di Tg la contrazione del vetro è di natura termica ovvero
la configurazione molecolare è congelata
La viscosità aumenta e a Tamb è circa 1020 poise
Il materiale si comporta come solido elastico
In qualità di liquido congelato il vetro è un materiale isotropo
Materiali per l’ottica
Capitoli: 3
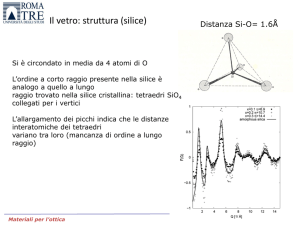
Il vetro: struttura (silice)
Si è circondato in media da 4 atomi di O
L’ordine a corto raggio presente nella silice è
analogo a quello a lungo
raggio trovato nella silice cristallina: tetraedri SiO4
collegati per i vertici
L’allargamento dei picchi indica che le distanze
interatomiche dei tetraedri
variano tra loro (mancanza di ordine a lungo
raggio)
Materiali per l’ottica
Distanza Si-O= 1.6Å
Il vetro: struttura (silice)
Materiali per l’ottica
Il vetro: struttura (silice)
Probabilità di trovare gli atomi in funzione della distanza da
un determinato atomo prescelto
Funzione di distribuzione radiale (FDR) della silice vetrosa
Materiali per l’ottica
Il vetro: struttura (silice)
TEORIA DI PORAI-KOSHITS (1959)
La struttura del vetro è costituita da domini nanocristallini (D=10-100Å)
Ciascun dominio può anche avere una composizione diversa
Zone con regolare disposizione delle unità strutturali collegate da zone
esterne altamente disordinate
In accordo con i dati XRD, con la presenza di gruppi OH
E’ compatibile con la presenza di stati vetrosi in materiali non ossidi
e con la trasparenza del vetro
Materiali per l’ottica
Energia
Il vetro: struttura (silice)
devetrificazione
vetro
cristallo
configurazione
TEORIA DI ZACHARIASEN (1932)
Si arguisce che che la differenza in energia tra vetro e cristallo della stessa
composizione è molto piccola (altrimenti rapida devetrificazione): metastabilità
prossima a stabilità
Tipo di legami e motivo strutturale (ad es. tetraedro silicico) devono esser identici
perché l’energia interna è funzione essenzialmente della energia di coesione
Dato però che non si osserva ordine a lungo raggio, mentre nel cristallo le unità
strutturali si ripetono periodicamente nello spazio,nel vetro le unità strutturali di
dispongono in modo casuale distorcendo i legami ma mantenendo le “rete” del
vetro continua
Accordo con i dati XRD ma non spiega l’esistenza di vetri non costituiti da ossidi
e non giustifica la presenza di gruppi OH- riscontrati nel vetro
Materiali per l’ottica
Il vetro: struttura (silice)
Confronto tra le due teorie (tra le molte esistenti…)
Zachariasen
Porai-Koshits
Risultati al microscopio ottico hanno evidenziato zone eterogenee ben definite che non sono il
risultato di una separazione di fase e come tali sono stabili ad eventuali trattamenti termici
Materiali per l’ottica
Il vetro: struttura (silice)
I costituenti del vetro si suddividono in :
1.
Formatori: formano il vetro senza l’introduzione di altri ossidi (network
formers): SiO2, B2O3, P2O5, As2O3. Esistono formatori parziali ovvero
ossidi che formano il vetro con l’introduzione di almeno un altro ossido:
TeO2, SeO2, MoO3, WO3
2.
Modificatori che modificano la struttura del vetro ‘rompendo’ il network
(network modifiers): Na2O, K2O, Li2O, CaO, PbO…La presenza di network
modifiers comporta:
- aumento della mobilità e diminuzione della viscosità (diminuzione
della temperatura di formazione del vetro)
- modifica delle proprietà del vetro a seconda della composizione
1.
Stabilizzanti: riducono i danni dovuti al contatto con agenti esterni, p. es.
acqua: Ca2O, MgO….
Materiali per l’ottica
Il vetro: struttura (silice)
Tra i costituenti del vetro:
Ossidi stabilizzatori
CaO, MgO, PbO, Al2O3, BaO, ZnO…
Additivi
Decoloranti
Coloranti
Opacizzanti
anidride arseniosa, ossido di alluminio
biossido di manganese
ad esempio, Fe, Cr, Ag, Cu, Co
floruri
Esempi di vetri
Silice
“cristallo”
Vetro Crown
Vetro Flint
54.0%
62.0%
42.0%
B2O3
Na2O
5.0%
CaO
5.2%
MgO
K2O
14.0%
PbO
32.0%
K2CO3
Materiali per l’ottica
1.7%
42.0%
21.9%
14.7%
Il vetro: struttura (silice)
Esempio di vetro: sodalime
Usato per finestre e contenitori.
1.
2.
3.
L’introduzione di un altro ossido (ad esempio Na2O) distrugge la continuità
del reticolo SiO2
L’apporto dell’ossido modifica il rapporto Si/O e non è possibile che ciascun
ione O sia legato a 2 atomi di Si.
Esistono degli ioni O che appartengono ad un solo tetraedro (ossigeni non
pontanti: bridging)
Na
O
Si
Materiali per l’ottica
Capitoli: 3