Il vetro: struttura (silice)
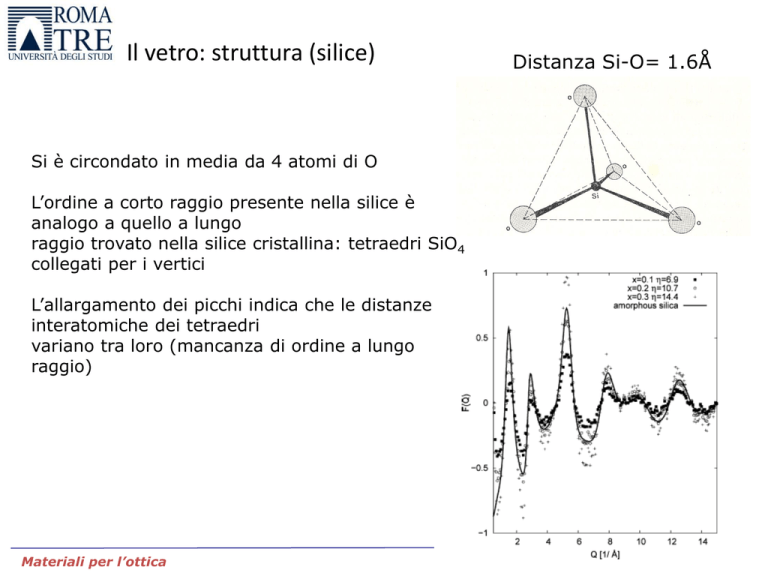
Si è circondato in media da 4 atomi di O
L’ordine a corto raggio presente nella silice è
analogo a quello a lungo
raggio trovato nella silice cristallina: tetraedri SiO4
collegati per i vertici
L’allargamento dei picchi indica che le distanze
interatomiche dei tetraedri
variano tra loro (mancanza di ordine a lungo
raggio)
Materiali per l’ottica
Distanza Si-O= 1.6Å
Il vetro: struttura (silice)
Materiali per l’ottica
Il vetro: struttura (silice)
Probabilità di trovare gli atomi in funzione della distanza da
un determinato atomo prescelto
Funzione di distribuzione radiale (FDR) della silice vetrosa
Materiali per l’ottica
Il vetro: struttura (silice)
TEORIA DI PORAI-KOSHITS (1959)
La struttura del vetro è costituita da domini nanocristallini (D=10-100Å)
Ciascun dominio può anche avere una composizione diversa
Zone con regolare disposizione delle unità strutturali collegate da zone
esterne altamente disordinate
In accordo con i dati XRD, con la presenza di gruppi OH
E’ compatibile con la presenza di stati vetrosi in materiali non ossidi
e con la trasparenza del vetro
Materiali per l’ottica
Energia
Il vetro: struttura (silice)
devetrificazione
vetro
cristallo
configurazione
TEORIA DI ZACHARIASEN (1932)
Si arguisce che che la differenza in energia tra vetro e cristallo della stessa
composizione è molto piccola (altrimenti rapida devetrificazione): metastabilità
prossima a stabilità
Tipo di legami e motivo strutturale (ad es. tetraedro silicico) devono esser identici
perché l’energia interna è funzione essenzialmente della energia di coesione
Dato però che non si osserva ordine a lungo raggio, mentre nel cristallo le unità
strutturali si ripetono periodicamente nello spazio,nel vetro le unità strutturali di
dispongono in modo casuale distorcendo i legami ma mantenendo le “rete” del
vetro continua
Accordo con i dati XRD ma non spiega l’esistenza di vetri non costituiti da ossidi
e non giustifica la presenza di gruppi OH- riscontrati nel vetro
Materiali per l’ottica
Il vetro: struttura (silice)
Confronto tra le due teorie (tra le molte esistenti…)
Zachariasen
Porai-Koshits
Risultati al microscopio ottico hanno evidenziato zone eterogenee ben definite che non sono il
risultato di una separazione di fase e come tali sono stabili ad eventuali trattamenti termici
Materiali per l’ottica
Il vetro: struttura (silice)
I costituenti del vetro si suddividono in :
1.
Formatori: formano il vetro senza l’introduzione di altri ossidi (network
formers): SiO2, B2O3, P2O5, As2O3. Esistono formatori parziali ovvero
ossidi che formano il vetro con l’introduzione di almeno un altro ossido:
TeO2, SeO2, MoO3, WO3
2.
Modificatori che modificano la struttura del vetro ‘rompendo’ il network
(network modifiers): Na2O, K2O, Li2O, CaO, PbO…La presenza di network
modifiers comporta:
- aumento della mobilità e diminuzione della viscosità (diminuzione
della temperatura di formazione del vetro)
- modifica delle proprietà del vetro a seconda della composizione
3.
Stabilizzanti: riducono i danni dovuti al contatto con agenti esterni, p.
es. acqua: Ca2O, MgO….
Materiali per l’ottica
Il vetro: struttura (silice)
Tra i costituenti del vetro:
Ossidi stabilizzatori
CaO, MgO, PbO, Al2O3, BaO, ZnO…
Additivi
Decoloranti
Coloranti
Opacizzanti
anidride arseniosa, ossido di alluminio
biossido di manganese
ad esempio, Fe, Cr, Ag, Cu, Co
floruri
Esempi di vetri
Silice
“cristallo”
Vetro Crown
Vetro Flint
54.0%
62.0%
42.0%
B2O3
Na2O
5.0%
CaO
5.2%
MgO
K2O
14.0%
PbO
32.0%
K2CO3
Materiali per l’ottica
1.7%
42.0%
21.9%
14.7%
Il vetro: struttura (silice)
Esempio di vetro: sodalime
Usato per finestre e contenitori.
1.
2.
3.
L’introduzione di un altro ossido (ad esempio Na2O) distrugge la continuità
del reticolo SiO2
L’apporto dell’ossido modifica il rapporto Si/O e non è possibile che ciascun
ione O sia legato a 2 atomi di Si.
Esistono degli ioni O che appartengono ad un solo tetraedro (ossigeni non
pontanti: bridging)
Na
O
Si
Materiali per l’ottica
Sintetici: plastiche, gomme, resine e adesivi, membrane…
Naturali: cellulosa, lievito, seta, capelli, DNA, RNA….
Materia soffice -------- Materia dura (metalli, ceramiche, etc.)
Energia di interazione per unita’ di volume:
E/a3 dove a=distanza media
Materia dura -> a=10-10m E= 10-18J
E/a3= 1012 J/m3
Materia soffice -> a=10-8 : 10-6m E= 10-20J
E/a3= 10-2 : 104 J/m3
Di conseguenza la materia soffice puo’ subire cambiamenti
rilevanti di struttura anche intorno a T ambiente.
STRUTTURA PRIMARIA (o chimica)
STRUTTURA SECONDARIA
Come le caratteristiche di un solido, cristallino o no sono determinate da:
Struttura della molecola + forze intermolecolari e periodicita’ (per il cristallo),
Cosi’, le caratteristiche della materia soffice dipendono da :
Struttura della molecola di base + flessibilita’ della catena polimerica +
interazioni tra catene + peso molecolare e sua distribuzione.
<R2> distanza quadratica media tra le due estremita’
Interazioni tra unita’ della catena =
Legami chimici
Interazioni tra catene: van der Waals, legami H, interazioni idrofobiche…
anisotropia.
Polimeri lineari:
Polistirene,
polietilene HD,
polimetilmetacrilato,
nylon,
fluorocarburi,….
Polimeri
ramificati:
Polietilene LD
Polimeri a legami
incrociati
(vulcanizzazione):
gomme elastiche
Polimeri
reticolati: resine
epossidiche, etc.
Forze di van der
Waals e legami
H
Meno compatti,
quindi meno
densi
Legami incrociati
covalenti, ottenuti durante
la sintesi con successiva
reazione irreversibile
Copolimeri a blocchi
Polimeri a stella
Polimeri a pennello
Capitoli: 3
• Capitolo 3
• Capitolo 14