IL PIOMBO
Il piombo è stato uno dei primi elementi metallici noti, probabilmente già dal 5000 a.C.
agli egizi, successivamente ai fenici e ai cinesi intorno al 2000 a.C., e infine ai romani, i
quali lo impiegavano su larga scala per condutture d'acqua. Dagli alchimisti fu associato
al pianeta Saturno: da qui il nome “saturnismo” per indicare le intossicazioni croniche
da piombo. In natura, dove si trova prevalentemente in composti corrispondenti al suo
stato di ossidazione +2, è un elemento relativamente poco abbondante infatti è circa
0,0015% della crosta terrestre). Se ne conoscono moltissimi minerali, ma i più
importanti sono il solfuro (galena, PbS) e i suoi prodotti di alterazione quali il carbonato
(cerussite, PbCO3) e il solfato (anglesite, PbSO4).
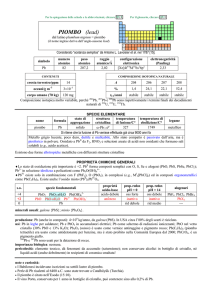
CARATTERISTICHE: Il piombo è un metallo bianco-azzurro, lucente in superficie, a bassa
durezza e basso punto di fusione, molto duttile e malleabile. E' un cattivo conduttore del
calore e dell'elettricità; possiede elevata densità e alto potere assorbente delle radiazioni. A
temperatura ambiente allo stato compatto si ossida all'aria solo superficialmente
(assumendo così il caratteristico colore grigio opaco), mentre è piroforico se è in forma
finemente suddivisa. Allo stato fuso (a temperatura superiore a circa 400°C) reagisce invece
facilmente con l'ossigeno dell'aria formando il monossido PbO, e il tetraossido o minio
Pb3O4. Gli acidi non ossidanti e le soluzioni alcaline diluite attaccano solo molto lentamente
il piombo a freddo, in seguito a passivazione superficiale dovuta alla formazione di sali
insolubili. Il piombo si discioglie invece facilmente a freddo in acidi nitrico diluito e, in
presenza di aria, negli acidi organici (acidi acetico, tartarico, citrico). All'ebollizione viene
attaccato sia dagli acidi cloridrico e solforico sia dalle soluzioni di idrossidi alcalini. Si combina
direttamente a temperature elevate con zolfo, selenio e tellurio, mentre con gli alogeni
reagisce tanto più facilmente quanto più alte sono la temperatura e l'elettronegatività
dell'alogeno.
Il piombo e i suoi composti sono molto tossici per l'uomo e gli animali in quanto danno
luogo a fenomeni di accumulo nell'organismo: particolarmente pericolosi sono, per
ingestione, i composti solubili in acqua (per esempio l'acetato), e per inalazione quelli volatili,
come i composti metallorganici impiegati come antidetonanti nelle benzine e le polveri. Le
norme attuali tendono a fissare limiti molto bassi per le concentrazioni massime di piombo
ammesse nell'aria degli ambienti di lavoro di industrie che producono o utilizzano questo
metallo o nell'aria inquinata dal traffico automobilistico.
METALLURGIA
Nella crosta terrestre il piombo non è molto abbondante e ne costituisce appena l‘0,0015%,
ma poiché si rinviene in gran parte concentrato in giacimenti relativamente ricchi, ne è
facilitata l'estrazione. Ciò ha permesso la sua utilizzazione fin dalle origini della metallurgia.
Il suo minerale più importante è la galena, costituita dal solfuro, PbS, che si rinviene in
giacimenti autonomi o più spesso in giacimenti misti, accompagnata da altri solfuri metallici,
principalmente dalla blenda, ZnS, e dalla pirite, FeS2; da questi la galena viene separata
meccanicamente o più spesso per flottazione. Una quantità assai minore di piombo si ricava
dalla cerussite, costituita dal carbonato, PbCO3, mentre altri minerali del piombo
presentano interesse soltanto scientifico, come l'anglesite, PbSO4, generalmente derivata
dall'alterazione della galena e della cerussite e presente appunto negli strati più esterni dei
loro giacimenti, la wulfenite, PbMoO4, la stolzite, PbWO4, la crocoite, PbCrO4, e la
cotunnite, PbCl2, ecc.
LEGHE METALLICHE
Il piombo presenta ottima resistenza alla corrosione, alto peso specifico, duttilità,
comportamento autolubrificante, ma modestissima resistenza meccanica e bassa durezza.
Gli elementi leganti utilizzati per la preparazione delle leghe hanno la funzione di ridurre i
difetti del metallo senza intaccarne i pregi. I più comuni sono antimonio, stagno e calcio, che
migliorano la resistenza meccanica e la durezza, mentre arsenico (migliora la resistenza alla
flessione) e rame (aumenta la resistenza alla corrosione) sono usati in piccole quantità. Il
principale uso delle leghe di piombo è nell'ambito delle batterie, che rappresentano circa un
terzo del consumo mondiale del metallo (leghe contenenti dal 2 all'8% di antimonio e
piccole quantità di arsenico). Le leghe di piombo con piccole quantità di stagno e di calcio
sono impiegate nelle batterie cosiddette “senza manutenzione”: lo stagno riduce
l'ebollizione dell'elettrolita e quindi il consumo di acqua durante la carica.
METODO DI PRODUZIONE
Il processo più usato per estrarre il piombo dal suo principale minerale, il solfuro o galena,
prevede tre stadi. Si inizia con un arrostimento (desolforazione) del minerale in aria per
ottenere l'ossido, che viene seguito da una fusione (riduzione) in presenza di carbone per
ottenere il piombo grezzo, e infine da una raffinazione del metallo. Il minerale viene
dapprima trattato in forni a suola rotante o a griglia rotante continua (arrostimento). Il
prodotto che si ottiene viene lavorato con coke e fondenti (ossido di ferro e calcio) e
sottoposto a riduzione in forni colanti. In questi l'ossido di piombo viene ridotto a piombo, il
silicato di piombo viene trasformato in ossido dai fondenti e quindi ridotto a piombo, mentre
il solfato di piombo viene ridotto a solfuro che reagisce con il ferro per dare piombo e solfuro
di ferro. Per la raffinazione del piombo ottenuto nei forni si usano i processi metallurgici,
qualora il contenuto di bismuto nel prodotto ottenuto sia basso, oppure i processi
elettrolitici. In entrambi i casi si separa dapprima il rame per liquefazione e schiumatura,
portando il piombo non raffinato a una temperatura leggermente superiore a quella di
fusione e asportando il rame residuo.
UTILIZZO
I campi di impiego del metallo sono numerosi. L'utilizzo principale si ha nella
costruzione di accumulatori elettrici, dove si usano negli elettrodi e nelle griglie sia
piombo metallico sia ossidi di piombo. Altri usi importanti si hanno nell'industria
chimica, in edilizia, nell'industria elettrica, nella fabbricazione di schermi protettivi
dalle radiazioni (in particolare neutroni, elettroni, raggi X e γ) e dai rumori, e infine
nella produzione di munizioni. È un componente di molte leghe a basso punto di
fusione, impiegate in circuiti elettrici, in sistemi di allarme antincendio e per saldature
a bassa temperatura, nonché di leghe antifrizione.
Minori quantità di piombo vengono utilizzate negli acciai per migliorarne la
lavorabilità. Una parte notevole della produzione di piombo è assorbita dalla
preparazione di composti sia inorganici (ossidi, carbonati, cromati, impiegati
nell'industria dei vetri e in quella delle vernici), sia soprattutto organici, quali
stabilizzanti per resine viniliche e insetticidi, additivi antidetonanti per le benzine. Tra
questi, il piombo tetraetile Pb(C2H5)4, uno dei principali responsabili
dell'inquinamento atmosferico prima dell'introduzione delle benzine senza piombo.
ECOLOGIA: EFFETTI AMBIENTALI
L'inquinamento da piombo riguarda soprattutto l'aria. La sua fonte principale risiede nella
combustione degli additivi antidetonanti contenuti nella benzina super tradizionale. A
questa forma di inquinamento si è cercato di ovviare con la graduale sostituzione di tale
combustibile con la benzina, che non contiene piombo o lo contiene in bassissima
concentrazione, detta perciò senza piombo. Nei Paesi che hanno provveduto a ridurre o
eliminare l'uso della benzina contenente piombo, tra i quali quelli dell'Unione Europea, le
concentrazioni medie di piombo nell'aria nelle aree urbane si sono sensibilmente ridotte
nel corso degli anni Novanta, tanto che nel 1999 una direttiva comunitaria ha introdotto un
valore limite di concentrazione di piombo nell'aria pari a 0,5 μg/m3, riducendo il valore di 2
μg/m3 precedentemente fissato. Anche le industrie che lavorano il piombo e quelle
ceramiche, che impiegano vernici a base di piombo, possono dare luogo a forte
inquinamento localizzato. L'organismo umano assorbe piombo dall'aria e attraverso cibi e
bevande; la parte che non viene espulsa (ca. il 10%) si accumula per il 90% nello scheletro.
L'intossicazione cronica nota come saturnismo, che si manifesta soprattutto come malattia
professionale, avviene quando la presenza di piombo nel sangue supera 60 μg/100 ml,
mentre per i bambini, che assorbono fino al 50% del piombo introdotto, si ritiene
allarmante una concentrazione di 10 μg/ml.
PIOMBO NELL’ACQUA DEGLI ANTICHI ROMANI
Secondo alcune testimonianze storiche, proprio l'avvelenamento da piombo sarebbe stato alla
base di alcuni dei malanni più diffusi nell'Antica Roma (come per esempio la gotta, una forma di
artrite infiammatoria) e avrebbe in qualche modo anche contribuito al declino dell'aristocrazia minata nella salute e alla caduta dell'Impero.
Per verificare queste ipotesi gli archeologi hanno prelevato campioni di sedimenti in alcune delle
più importanti vie d'acqua romane: nella zona che precede il delta del Tevere, nei canali limitrofi
e nelle vicinanze del Portus, l'antico Porto di Claudio e Traiano dove oggi si trova Fiumicino. Le
analisi geochimiche sono state confrontate con le testimonianze storiche della presenza umana
nelle varie aree e con le analisi di cinque tubature per l'acqua del I-II secolo d.C.
È emerso che nel periodo di splendore dell'Impero la contaminazione di piombo nell'acqua
raggiunse un picco, dovuto probabilmente alle condutture utilizzate per l'acqua. Gli isotopi di
piombo rinvenuti nei sedimenti sono infatti compatibili con quelli delle miniere di Spagna,
Francia, Inghilterra e Germania dove venivano estratte le materie prime per realizzare le fistulae,
le tubature idriche degli acquedotti romani.