.
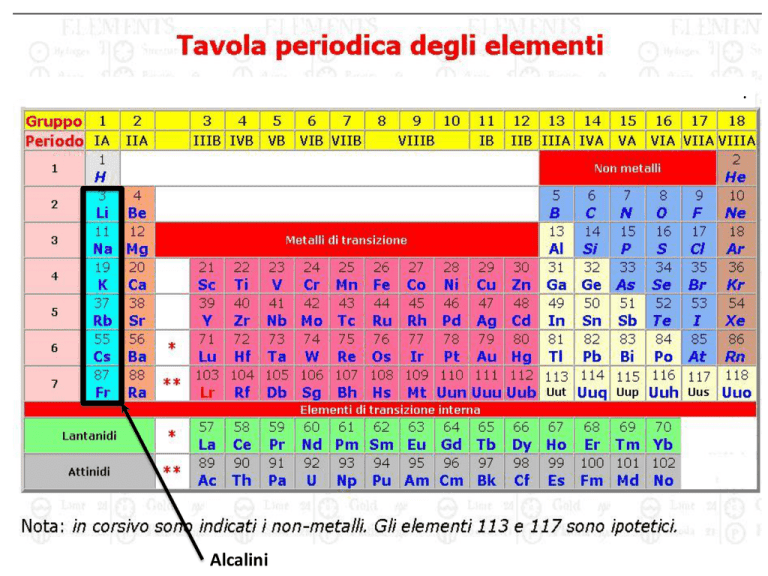
Alcalini
Shell atomi alcalini
Shell
K
L
Li
1s2
[He]
2s
Na
1s2
2s2 2p6
M
N
O
P
3s
[Ne]
K
1s2
2s2 2p6
3s2 3p6
[Ar]
4s
Rb
1s2
2s2 2p6
3s2 3p6 3d10
4s2 4p6
[Kr]
5s
Cs
1s2
2s2 2p6
3s2 3p6 3d10
4s2 4p6 4d10
5s2 5p6
[†e]
6s
pi2
Ze 2
e2
H [
]
2m 40 ri i j 4 0 rij
Campo medio centrale
2
i
2
p
Ze
H [
(ri )]
2m 4 0 ri
i
(ri ) e
2
dr
j i
(rj )
j
2
ri r j
Ze 2
V (ri )
(ri )
4 0 ri
(ri ) (ri ) Rn i l i (ri )Yli mi ( i ,i ) Si msi Campo medio centrale
i
i
Gli orbitali degli atomi polielettronici
• Gli orbitali degli atomi polielettronici sono qualitativamente
simili a quelli dell’atomo di idrogeno
• Valgono gli stessi numeri quantici n, l e ml
Livelli energetici negli atomi polielettronici
L’energia dei diversi orbitali degli atomi polielettronici non
dipende soltanto dal numero quantico principale n, ma
anche da quello secondario l
• A parità di n, l’energia dei diversi orbitali varia nell’ordine: s
<p<d<f…
• Il valore dell’energia dei livelli successivi varia al variare del
numero atomico Z
Atomi poliettronici
4
Modellizzazione della funzione d’onda del litio con un
potenziale medio di schermo
Si può trattare la funzione d’onda del litio come prodotto di una funzione d’onda
che descrive i due elettroni in singoletto di spin sullo stato 1s (shell chiusa
dell’elio, [He]) per la funzione d’onda del terzo elettrone sull’orbitale 2s o
sull’orbitale generico nl:
|1s> n=1, l=0
(r1 , r2 , r3 ) =[He(r1 , r2)] |nl(r3)>
Distribuzione sferica
Sub-shell chiusa
La shell chiusa dei due elettroni
interni crea uno schermo della
carica elettrica del nucleo
La carica elettrica del nucleo
viene vista non con la sua Z
reale ma con una “Z efficace”
|2s> n=2, l=0
Modellizzazione della
funzione d’onda del
litio con un potenziale
medio di schermo:
stato 2s
Funzione d'onda
calcolo analitico orbitale 1s blu - numerov rosso scuro
2,0
1,5
1s
1,0
2s (l=0) con
schermo ~ 1,8
0,5
0,0
-0,5
-1,580
Energia (eV)
Lo schermo dei 2 elettroni
sull’orbitale interno 1s è
maggiore sullo stato 2p
rispetto allo stato 2s:
E2s=-5,4 eV
Zeff ~ 1,26
D(r)=rf(r)
-1,0
r (angstrom)
70
-2,0
60
0,0
2,0
50
Potenziale coulombiano (verde),
4,0
6,0 di schermo
8,0 (rosso),
10,0
centrifugo
(fucsia),
totale (viola)
40
30
20
E2s
10
0
-10
-20
-30
0,0
1,0
2,0
3,0
r (angstrom)
4,0
5,0
6,0
Modellizzazione della
funzione d’onda del
litio con un potenziale
medio di schermo:
stato 2p
Funzione d'onda
calcolo analitico orbitale 1s blu - numerov rosso scuro
2,0
1,5
1s
2p (l=1) con
schermo ~ 1,97
1,0
0,5
0,0
-0,5
-1,0
80
-1,5
Energia (eV)
Lo schermo dei 2 elettroni
sull’orbitale interno 1s è
maggiore sullo stato 2p
rispetto allo stato 2s:
E2p=-3,6 eV
Zeff ~ 1,06
70
-2,0
600,0
r (angstrom)
2,0
50
Potenziale coulombiano (verde),
4,0
6,0
8,0
10,0
centrifugo (fucsia), di schermo (rosso),
totale (viola)
40
30
20
10
0
-10
-20
E2p
-30
0,0
1,0
2,0
3,0
r (angstrom)
4,0
5,0
6,0
Difetti quantici
Le energie dei livelli dell’elettrone ottico si calcolano come
E nl
R
dove Dnl viene chiamato difetto quantico e tiene conto della penetrazione
2
(n nl )
In generale Dnl :
a) diminuisce all’aumentare di l;
b) A parità di l non deve variare (diminuire) molto) al variare di n
E nl
l=0
1
2
3
4
Li (n=2)
0.4
0.04
0
0
0
Na (n=3)
1.35
0.85
0.01
0
0
K (n=4)
2.19
1.71
0.25
0
0
Rb (n=5)
3.13
2.66
1.34
0.01
0
R
Z eff (n,l) la penetrazione viene anche espressa tramite una Zeff(n,l)
2
n
Invece Zeff(n,l) tende a 1 (per atomi neutri) al crescere di n e l.
H Z=1
Li++ Z=3
Livelli energetici
- Zeff diminuisce al crescere
di n e, a parità di n, al
crescere di l;
- tende a 1 per grandi l
schermo completo (stessa
energia dell’elettrone
dell’atomo di idrogeno)
2
Z eff
,nl
E nl R
n2
E4f= -0,85 eV
E4d= -0,85 eV
E4p= -0,87 eV
E4s= -1,05 eV
E4,H= -0,85 eV
E4,Li++= -7,65 eV
E3d= -1,51 eV
E3p= -1,55 eV
E3s= -2,01 eV
E3,H= -1,51 eV
E3,Li++= -13,6 eV
E2p= -3,6 eV
E2s= -5,4 eV
E2,H= -3,4 eV
E2,Li++= -30,6 eV
Penetrazione delle orbite
Penetrazione orbitale più esterno nel core
Effetto sulle energie elettroniche
E
(eV)
H
E
(eV)
Li
0
0
-1
-2
4
4s
4p
3
4d
4f
3d
3p
-3
3s
-2
-3
-4
-4
-5
-1
Litio: Z=3
atomo “alcalino”
-1 solo elettrone
fuori della shell
chiusa del [He]
-2 elettroni
sull’orbitale 1s
-5
2
2p
-6
-6
2p+
2po
2p-
2s configurazione
elettronica del
Li nello stato
1s fondamentale
2s
idrogeno - litio
Somiglianze e differenze fra H e Li
-H e Li hanno una configurazione elettronica
simile per l’elettrone di valenza: 1 elettrone in un
orbitale s
- entrambi si legano bene all’ossidrile OH
2p+
2po
2p-
2s configurazione
elettronica del
Li nello stato
fondamentale
(LiOH ha importanti applicazioni, ad es. nelle pile alcaline)
però:
- l’elettrone di valenza del Li ha minore energia di
legame
- ha un livello eccitato 2p con energia poco
diversa e molti stati disponibili (6)
ciò fa sì che:
- il Li sia un solido metallico (“litium” perché si
trova nelle rocce), mentre l’idrogeno è un gas
- si trova facilmente in uno stato eccitato anche a
temperatura ambiente
1s
2s
1s
2p+
2po
2p-
configurazione
elettronica
dell’idrogeno nello
stato fondamentale
E
(eV)
H
E
(eV)
Li
0
nel lontano IR, Dn=0, D1=1
-1
4
-2
3
4s
4d
4p
4f
3d
3s
-1
-2
nell’IR, Dn=0, D1=1 -4
-4
-5
2
2p
-6
-6
nel visibile, Dn=0, D1=1,
rossa, molto intensa
2s
Transizioni nel litio
2p+
2po
2p-
2s configurazione
-3
3p
-3
-5
0
elettronica del Li
nel primo stato
1s eccitato:
i
tre stati
2p+, 2po, 2p- sono
degeneri
E
(eV)
H
Li
E
(eV)
Na
0
0
-1
-2
4
4s
4p
3
4d
4d
4p
3d
3d
3p
-3
3s
-5
-2
-4
-4
3p
2
-5
2p
-6
-6
3s
2s
idrogeno - litio - sodio
Na
Z=11
-1
-3
4s
Il sodio
atomo
“alcalino”
- 1 solo
elettrone fuori
della shell
chiusa del [Ne]
-bassa energia
di ionizzazione
E = -5,1 eV
- livelli
energetici
simili a quelli
del Li
E
(eV)
splitting dei livelli del sodio
0
DE 10-6eV
-1
4d5/2
4d3/2
-2
DE 7·10-4eV
4p3/2
-3
DE
4s1/2
-4
-5
3d5/2
4p1/2
DE 2·10-3eV
-6
3s1/2
3p3/2
3p1/2
6·10-5eV
Perché la linea gialla
del sodio è
sdoppiata?
3d3/2
Accoppiamento di spin-orbita:
il “buon numero quantico” è il
momento angolare totale j
dell’elettrone che può avere due
valori a parità di l:
j=l+1/2
j=l-1/2
Negli atomi,
- l’effetto sull’energia è piccolo
(accoppiamento magnetico fra il
momento magnetico di spin e il
campo magnetico visto
dall’elettrone in moto, per effetto
della trasformazione di Lorentz
del campo coulombiano)
- lo stato j=l-1/2 ha energia
minore
E
(eV)
principali transizioni radiative del sodio
0
DE 10-6eV
-1
4d5/2
4d3/2
-2
DE
4p3/2
7·10-4eV
3d5/2
4p1/2
3d3/2
-3
DE 6·10-5eV
4s1/2
proibita
in dipolo
elettrico
-4
3p3/2
-5
DE 2·10-3eV
3p1/2
-6
3s1/2
praticamente
coincidenti in
energia
linea “D”
doppietto giallo
del sodio
Regole di selezione
di dipolo elettrico:
Dl =1
D ml = 0, 1
D S= 0
D ms = 0
D j = 0, 1