gli esperimenti che misero in crisi
la meccanica classica
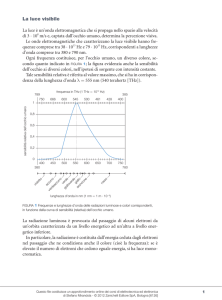
LO SPETTRO DEL CORPO NERO
Alla fine dell’Ottocento divenne centrale lo studio delle proprietà
di emissione e di assorbimento di un corpo nero.
Si chiama corpo nero un oggetto
capace di assorbire completamente
onde elettromagnetiche di
qualunque lunghezza d’onda.
Un corpo nero emette radiazioni
per irraggiamento. Lo spettro
della radiazione emessa dipende
solo dalla temperatura T e non
dalla composizione chimica del
corpo o dalle dimensioni del foro.
Animazione Java
Sperimentalmente si osserva come, fissata T, l’energia emessa
sia distribuita tra le varie lunghezze d’onda.
Al crescere della temperatura T la lunghezza d’onda λmax a cui
corrisponde il massimo della curva si sposta verso lunghezze
d’onda minori seguendo una legge sperimentale
LEGGE DI SPOSTAMENTO
DI WIEN
max
3
2,90 10 m K
T
In base all’esperimento, per lunghezze d’onda inferiori a
λmax l’intensità di irraggiamento scende rapidamente a zero.
Curva sperimentale
Previsione classica
In teoria (applicando al problema le equazioni di Maxwell)
per lunghezze d’onda inferiori a λmax l’intensità di
irraggiamento dovrebbe cresce indefinitamente.
La soluzione al problema arrivò nel
1900 ad opera di Max Planck.
Alla base della soluzione proposta
dalla meccanica classica vi era
l’assunzione che la radiazione
elettromagnetica venisse scambiata
dal corpo nero in modo continuo.
Planck ipotizzò che la radiazione elettromagnetica fosse
emessa o assorbita dagli atomi solo in pacchetti discreti di
energia, di entità proporzionale alla frequenza dell'onda
elettromagnetica.
Questi pacchetti di energia furono chiamati “quanti
elettromagnetici” o, più semplicemente “quanti”.
Secondo Planck, l’energia E scambiata dal corpo nero è
direttamente proporzionale alla frequenza f dell’onda
elettromagnetica assorbita o emessa secondo la formula
E = nhf
dove n è un intero positivo ed h è la “costante di
Planck”, il cui valore numerico attualmente accettato è
h = 6,62607 x 10 -34 J · s
La costante di Planck esprime il valore fisso e non
frazionabile in cui l’energia di una radiazione è divisa.
Ogni radiazione è caratterizzata dalla frequenza:
maggiore è la frequenza (più corta è la lunghezza
dell’onda) maggiore è l’energia racchiusa in un quanto.
L’energia cambia in
quantità, ma per essere
emessa viene racchiusa
sempre nel medesimo
quanto, della stessa
dimensione.
L’EFFETTO FOTOELETTRICO
Nel 1887 Hertz osservò che colpendo una placca di zinco con
delle radiazioni ultraviolette, il metallo si caricava elettricamente.
Il processo di estrazione
di elettroni ottenuto
illuminando un metallo è
chiamato comunemente
“effetto fotoelettrico”.
APPLICAZIONE: IL CANCELLO AUTOMATICO
Se l’energia della radiazione elettromagnetica incidente supera la
forza che tiene legati gli elettroni all’atomo, alcuni elettroni dello
zinco vengono espulsi, generando così una carica elettrica .
Secondo la meccanica classica la radiazione incidente di
qualsiasi frequenza avrebbe potuto possedere energia
sufficiente per emettere elettroni dal metallo colpito.
anodo
Tubo a vuoto
-
+
Nel 1902, Philipp Lenard ideò un esperimento che
contrastava la visione classica
Primo problema
catodo
Secondo la meccanica classica aumentando l’intensità
della radiazione incidente si deve rilevare una intensità di
corrente maggiore indipendentemente dalla frequenza
della radiazione monocromatica.
anodo
Tubo a vuoto
-
+
Secondo problema
catodo
Si ha emissione di elettroni per effetto fotoelettrico in
modo proporzionale all’intensità della radiazione incidente
soltanto per frequenze maggiori di un valore minimo.
Secondo la meccanica classica in che modo può
aumentare l’energia cinetica degli elettroni?
catodo
Tubo a vuoto
-
+
Aumentando l’intensità
della radiazione
luminosa.
terzo problema
anodo
Aumentando la
differenza di potenziale
tra anodo e catodo.
Secondo la meccanica classica l’energia cinetica degli
elettroni emessi aumenta in modo proporzionale
all’intensità della radiazione monocromatica.
anodo
Tubo a vuoto
-
+
Si osserva che l’energia cinetica degli elettroni emessi
aumenta in modo proporzionale alla lunghezza d’onda
della radiazione monocromatica.
terzo problema A
catodo
Secondo la meccanica classica aumentando la d.d.p. tra gli
elettrodi la corrente dovrebbe aumentare indefinitamente.
catodo
anodo
Tubo a vuoto
-
+
terzo problema B
Si osserva che esiste una corrente limite dipendente da λ
Secondo la meccanica classica diminuendo la d.d.p. tra gli
elettrodi la corrente dovrebbe diminuire fino ad annullarsi.
Si osserva che il valore nullo della corrente si raggiunge
per una d.d.p. di arresto che dipende esclusivamente da λ
Assumendo come stato iniziale quello in cui la lastra irradiata ha
il potenziale di 0V mentre l’altro elettrodo ha il potenziale
d’arresto -ΔVa, analizziamo il comportamento di un elettrone
emesso con energia cinetica Kmax.
Per il teorema di conservazione dell’energia:
tot
iniziale
E
E
tot
finale
Kiniziale U iniziale K finale U finale
K max (e)(0V ) 0 J (e)( V )
K max eV
LA SPIEGAZIONE DI EINSTEIN PER
L’EFFETTO FOTOELETTRICO
Einstein estense il concetto di quanto formulato da
Planck: non solo le variazioni di energia sono quantizzate,
ma anche la radiazione elettromagnetica, in virtù del fatto
di veicolare energia, esiste in qualità di quanti di energia.
Secondo tale ipotesi, la luce è
composta da un flusso di quanti
di energia, definiti
successivamente fotoni
Ogni fotone ha una massa nulla e trasporta un’energia E
direttamente proporzionale alla sua frequenza f
E = hf
Quindi nella radiazione elettromagnetica, l’energia è quantizzata.
Secondo la teoria della relatività, l’energia è legata alla quantità di
moto dalla relazione:
E c p m c
2
2
2 4
E hf h
p
c
c
c
f
Anche la quantità di moto è quantizzata.
L’effetto fotoelettrico si spiega ipotizzando che un singolo fotone
può interagire solo con un singolo elettrone.
L’elettrone può uscire dal metallo solo se l’energia del fotone è
almeno uguale al lavoro di estrazione.
hf We
We
f
h
Deve quindi esistere una frequenza minima al di sotto della quale
l’effetto fotoelettrico non può avvenire: fmin = We / h
L'apparente dipendenza del numero di elettroni emessi
dall'intensità della radiazione incidente, deriva dal fatto che
considerando semplicemente che una maggiore intensità significa
un maggior numero di fotoni e quindi di elettroni estratti.
Come spiegare l’energia cinetica massima degli elettroni emessi?
Analizziamo l’interazione elettrone/fotone.
Un elettrone emesso assorbe dal fotone l’energia E = hf ed esce
dal metallo con energia cinetica Kmax.
K max hf We
quindi l’energia cinetica massima dipende solo dalla frequenza e
dal tipo di metallo, in accordo con gli esperimenti.
inoltre, poiché We= h fmin, possiamo ottenere la relazione:
K max h( f f min )
Lo spettro dell’atomo di idrogeno.
Scomponendo con
un prisma la luce
emessa da un gas
monoatomico ad
alta temperatura o
percorso da
corrente si vede
uno spettro a
righe
1
1
f cRH 2 2
n
m
m, n Z
nm
Balmer determinò attraverso
esperimenti la serie spettrale
delle determinate frequenze
emesse dell’atomo di
idrogeno nel visibile
Questo esperimento metteva in
discussione il modello atomico
planetario proposto da Rutherford !
ve
Ogni carica accelerata emette energia.
L’emissione continua di energia da
parte dell’elettrone dovrebbe produrre
uno spettro continuo.
La perdita continua di energia
dovrebbe fare avvicinare l’elettrone
sempre più al nucleo collassando in
un tempo di 10-7 s.
Il danese Niels Bohr intuì che era necessario applicare anche
alla descrizione degli atomi le nuove idee della fisica dei
quanti e perciò avanzò due ipotesi:
Un elettrone non può percorrere qualsiasi
orbita intorno ad un nucleo, ma solo un
insieme discreto di orbite, dette orbite
stazionarie, ciascuna caratterizzata da un
preciso livello energetico.
Percorrendo un’orbita stazionaria
l’elettrone non emette energia ma può
emettere saltando da un’orbita
all’altra.
Bohr diede anche la condizione di quantizzazione che permette di
stabilire quali orbite sono permesse.
Se l’n-sima orbita ha raggio rn e quantità di moto pn, le sole orbite
permesse sono quelle per cui risulta:
2
rn pn nh
Imponendo l’equilibrio tra forza elettrica e
forza centripeta, si ricava dapprima il valore
di vn e sostituendo nella formula precedente
il valore di rn.
0h2
rn n
me e 2
2
Il valore dell’energia sull’orbita n è:
me e 4 1
E ( n)
8 02 h 2 n 2
Come avviene l’emissione di luce da parte degli atomi?
Bohr postulò che un fotone è emesso da un atomo quando un
suo elettrone passa da un’orbita permessa di energia maggiore
ad un’altra orbita permessa di energia minore.
Quando un elettrone salta da un’orbita n1 di energia maggiore ad una n2
di energia minore, la differenza di energia tra i due stati ammissibili è
E E(n1 ) E(n2 )
Questa energia è liberata sottoforma di un fotone di frequenza
E
E (n1 ) E (n2 )
me4
f
h
h
8 02 h3
1
1
2 2
n2 n1
In pieno accordo con l’esperimento di Balmer!
1
1
f cRH 2 2
n
m
LA FORMALIZZAZIONE DELLA
MECCANICA QUANTISTICA
La luce ha una doppia
natura: si presenta come
onda o come particella
a seconda delle
condizioni sperimentali.
Questa è una proprietà intrinseca di tutte le
radiazioni elettromagnetiche
Louis de Broglie
ipotizzo che anche
la materia deve
avere una doppia
natura corpuscolare
e ondulatoria.
Ad ogni particella con quantità di moto p deve essere
associata la lunghezza d’onda di de Broglie in modo tale che
h
p
Oggetti macroscopici hanno λ “piccola”.
Oggetti microscopici hanno λ “grande”.
La relazione di de Broglie:
E’compatibile con la meccanica classica
(vedi diapositiva precedente)
Ingloba la relazione di Planck
Giustifica le ipotesi di Bohr
Ingloba la relazione di Planck: E = h f
Ricordiamo che la quantità di moto di un fotone è
E
p
c
Il valore della lunghezza d’onda di de Broglie sarà allora
h
c
h
p
E
da cui
Eh
c
hf
Giustifica le ipotesi di Bohr
Nel modello corpuscolare l’elettrone gira
lungo un traiettoria circolare senza
irraggiare
Nel modello ondulatorio l’elettrone è
un’onda stazionaria
La lunghezza dell’orbita deve essere un
multiplo intero della lunghezza d’onda
dell’elettrone
2rn n
h
2rn n
pn
2rn pn nh
Il metodo sperimentale della
fisica ha come primo passo
l’osservazione di un fenomeno
Per osservare un fenomeno bisogna poterlo “vedere” cioè è
necessario colpirlo con un raggio di luce!
Non è possibile conoscere con precisione DOVE un
elettrone si trova senza impartirgli una quantità di
moto non determinabile
Questo è il contenuto del principio di indeterminazione
di Heisenberg nella sua prima forma
x p
Dove Δx e Δp sono le
indeterminazioni
rispettivamente sulla posizione e
sulla quantità di moto.
La seconda forma del principio di indeterminazione di
Heisenberg riguarda l’incertezza sul tempo e quella
sull’energia:
t E
Non posso conoscere contemporaneamente in modo
esatto la misura dell’energia di un sistema e la durata
del tempo in cui questa misura viene effettuata.
Funzione d’onda e dualismo onda
corpuscolo
Interpretazione di Copenaghen
Niels Bohr
P.A.M. Dirac
W. Heisenberg
E. Schrödinger
Principi fondamentali
1
Le
affermazioni probabilistiche della
meccanica quantistica sono irriducibili,
nel senso che non riflettono la nostra
conoscenza limitata di qualche variabile
nascosta. Nella fisica classica, si ricorre alla
probabilità anche se il processo è
deterministico (per esempio il lancio di un
dado), in modo da sopperire a una nostra
conoscenza incompleta dei dati iniziali. Per
contro, l'interpretazione di Copenaghen
sostiene che in meccanica quantistica i
risultati delle misurazioni di variabili
coniugate sono fondamentalmente non
deterministici, ossia che anche conoscendo
tutti i dati iniziali è impossibile prevedere il
risultato di un singolo esperimento, poiché
l'esperimento stesso influenza il risultato.
2
Sono prive di senso domande come:
«Dov'era la particella prima che ne
misurassi la posizione?», in quanto la
meccanica
quantistica
studia
esclusivamente
quantità
osservabili,
ottenibili
mediante
processi
di
misurazione. L'atto della misurazione causa
il «collasso della funzione d'onda», nel
senso che quest'ultima è costretta dal
processo di misurazione ad assumere i
valori di uno a caso dei possibili stati
permessi.
Cosa vibra in un «onda di materia»
E’ qualcosa che non ha un
analogo classico
Viene chiamata funzione
d’onda ed è la soluzione
dell’equazione di Schrödinger
Dipende dalle coordinate e
dal tempo ψ(x,y,z,t)
E’ proporzionale alla densità
di probabilità
La probabilità di osservare la particella è
proporzionale al |ψ|²
Interpretazione del principio di
Heisenberg
Se non sappiamo nulla
della posizione della
particella, possiamo
ipotizzare la sua ψ come
uniformemente
distribuita nello spazio.
Pertanto avrà una ben
precisa lunghezza d’onda
e, per la relazione di De
Broglie, una precisa
quantità di moto!
Se conosciamo con
esattezza la posizione,
invece, la sua lunghezza
d’onda sarà mal definita,
per cui la particella avrà
una grande incertezza
sull’impulso
«Coloro che non restano sconcertati quando
vengono in contatto per la prima volta
con la teoria quantistica sicuramente non
l’hanno capita»
Niels Bohr