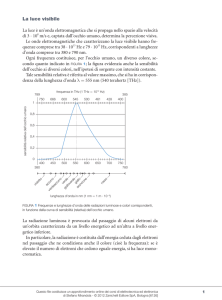
Che cos’è la costante di Planck?
La costante di Planck fu introdotta nel 1900 dal fisico
omonimo, e può essere definita coma la costante di
proporzionalità che lega l’energia di una radiazione e la
sua frequenza secondo la legge
E = hn
Ne consegue che ad ogni frequenza è associata una ben
determinata energia.
Fisica classica o
meccanica quantistica?
h = 6.626x10-34joule s (cost. di Planck)
J = momento angolare = [ joule s ]
J >> h
J h
fenomeno classico
fenomeno quantistico
The light blue glow given off by mercury
street lamps has a wavelength of λ = 436nm.
What is its frequency?
La frequenza, n , è il numero di oscillazioni che
un'onda compie nell'unità di tempo ed è quindi uguale
la velocità divisa per la lunghezza d’onda:
𝜈 =
𝑉𝑒𝑙𝑜𝑐𝑖𝑡à
𝜆
l'unità di misura è chiamata hertz (Hz), dal fisico
tedesco Heinrich Rudolf Hertz, dove 1 Hz caratterizza
una oscillazione che occorre una volta in un secondo.
Nel caso di una radiazione elettromagnetica la
velocità sarà c = 3 x 108 m/sec
The light blue glow given off by mercury street
lamps has a wavelength of λ = 436nm. What is its
frequency?
The unit s-1 is so common when talking about
waves that it was given the name Hertz. That is, 1
s-1 = 1 Hz. Thus, we would say that light with a
wavelength of 436 nm corresponds to a frequency
of 6.88 × 1014 Hertz.
Il numero d'onda, , è il numero di oscillazioni che un'onda
compie nell'unità di spazio ed è quindi l'inverso della
lunghezza d'onda:
La sua unità di misura nel Sistema Internazionale è il metro
alla meno uno, m-1, viene però più spesso impiegato il suo
multiplo cm-1.
Quindi, nel caso di una radiazione elettromagnetica, per
passare da numero d’onda a frequenza basta moltiplicare il
numero d’onda per c
n=
c
Una delle prime osservazioni interessanti avvenne nel 1884
quando Johann Balmer, insegnante svizzero, osservò che
alcune righe dello spettro di emissione dell'idrogeno potevano
essere calcolate utilizzando la formula:
Balmer suppose che tale formula fosse, in realtà, un caso
particolare di una legge più generale, che venne trovata da
Johannes Rydberg e Walter Ritz e nota come legge di RydbergRitz:
con n1>n2 ed R la costante di Rydberg.
•As n increases (holding Z constant), then the
energy increases (becomes less negative). In the
limit that n goes to infinity then the energy goes to
zero.
•As Z increases (holding n constant), then the
energy decreases (becomes more negative). This
makes sense, since a higher Z means a more
positively charged nucleus, which holds the
electron tighter.
For the hydrogen atom Z=1 so En= - RH/n2
Ef= -R
1
𝑛𝑓 2
Ei= -R
Ef-Ei= -R
1
𝑛𝑓 2
- (-R
ΔE= -R (
1
𝑛𝑓 2
1
𝑛𝑖 2
ΔE= -hc RH (
-
1
𝑛𝑓 2
-
1
𝑛𝑖 2
1
𝑛𝑖 2
)
1
𝑛𝑖 2
)
E= h n
E=h c n
ν = RH (
1
𝑛𝑓 2
-
1
𝑛𝑖 2
)
)
Formula di Rydberg
Calcolare la lunghezza d’onda in nanometri della
transizione n= 4 → 2 nell’atomo di idrogeno.
RH = 109677 cm–1
(costante di Rydberg)
RH = 109677.76 cm–1 (costante di Rydberg).
ni → nf Wavelength
3 → 2 λ=657 (red)
4 → 2 λ=487 (green)
5 → 2 λ=435 (blue)
∞ → 2 λ=365 (purple)
photoelectric effect
2 parametri per radiazione incidente:
1) INTENSITÀ LUMINOSA (proporzionale all’ampiezza dell’onda)
2) FREQUENZA della radiazione
2 parametri per gli elettroni emessi:
1) NUMERO di elettroni emessi
2) ENERGIA CINETICA di ogni elettrone emesso (1/2 mv2) o velocità di
emissione.
1) Aumentando l’intensità luminosa aumenta il
numero elettroni emessi, ma solo se la radiazione
ha n> n0 (frequenza critica).
2) Aumentando l’intensità luminosa non aumenta
l’energia cinetica degli elettroni emessi
3) Aumentando la frequenza della radiazione (con
valori superiori a n0) aumenta l’energia cinetica
degli elettroni emessi
Ephoton = h n
h = 6.63 × 10-34 J · s ← Planck's Constant
Natura corpuscolare e ondulatoria
dell’elettrone secondo De Broglie
Un’onda stazionaria è un’onda che non si
propaga, ma rimane sempre nella stessa
zona di spazio.
Orbita dell’elettrone come onda stazionaria circolare
l=
2π𝑟
𝑛
2pr=nl
2pr =
ℎ
n
𝑚𝑣
mvr = n
ℎ
2p