metalli
Sintesi
Metalli
PERCHE’?
plastici
Conducono
calore ed
elettricità
lucenti
metalli
Legame metallico
i metalli hanno tendenza a
cedere i loro pochi elettroni di
valenza e a trasformarsi in
cationi (possiedono bassi valori
di elettronegatività e di energia
di prima ionizzazione).
.
Metalli
Questo è ciò che fanno tutti gli atomi, per
esempio di argento, quando costituiscono
un pezzetto di argento puro.
In questo processo si creano ovviamente
tante cariche positive quanto negative e
perciò anche nei metalli è rispettata
l'elettroneutralità.
Metalli
I cationi formatisi occupano posizioni fisse
e ordinate nei cristalli metallici mentre gli
elettroni ceduti vengono messi in comune
e costituiscono una nuvola elettronica
molto mobile responsabile delle proprietà
macroscopiche di questi elementi.
Questa nuvola elettronica si muove
facilmente tra i cationi e funge da
"collante" poiché esiste un'attrazione
reciproca tra cationi e nuvola elettronica
in quanto portatori di carica elettrica di
segno opposto
Legame metallico
Il legame metallico è l'attrazione che si instaura
tra i cationi formatisi dagli atomi metallici e la
nuvola elettronica in cui questi sono immersi.
Si ha la sovrapposizione degli orbitali
atomici di ciascun atomo con la
formazione di una nube di elettroni,
liberi di spostarsi da un atomo all’altro
Legame metallico
Il modello della loro struttura può
essere pensato come formato da ioni
positivi immersi in una nube di elettroni
mobili (quelli di valenza) diffusa per
tutto il reticolo.
Da ciò l’alta
conducibilità elettrica e l’elevata
duttilità.
Legame metallico
Solo la presenza di elettroni liberi di
muoversi riesce a spiegare l'elevata
conducibilità elettrica dei solidi metallici.
Legame metallico
Gli atomi sono strettamente impaccati in
strutture semplici.
In una struttura cristallina ordinata di atomi
metallici si possono individuare delle unità
ripetute di base.
Legame metallico
La presenza di elettroni non legati a uno
specifico atomo, determina una non
direzionalità del legame.
Lo slittamento dei piani reticolari lascia
inalterate le interazioni di legame.
Il metallo si presenta duttile e malleabile
Non si stabiliscono repulsioni tra piano
e piano come nel caso dei solidi ionici.
Lo stretto
impaccamento
degli atomi
favorisce la
trasmissione di
calore
Legame metallico
Proprietà del materiale
Caratteristiche del legame
metallico
Punti di ebollizione e di
fusione molto alti
Alta densità
Non solubilità
Legame forte
Duttili
Malleabile
Legame non direzionato
Buoni conduttori di calore ed
elettricità
Opacità e lucentezza
Elettroni delocalizzati
Teoria delle bande
Quando
mettiamo
assieme
due atomi
di li tio
possiamo
pensare
che la
situazione
sia questa
Teoria delle bande
Bande in un conduttore metallico
Bande di conduzione
in un non metallo
isolante
Bande di un semiconduttore drogato
drogaggio p (Si:B) ed n (Si:P)
elettroni
donatore
accettore
drogaggio p
lacune
drogaggio n
Gap
originario
Conduttori e isolanti
Gli elettroni sono posti su orbitali molecolari
estesi questi ultimi su tutto il cristallo.
Gli elettroni sono delocalizzati
3. BANDA DI CONDUZIONE la
prima banda
oltre la banda di Valenza E3 - E4
2.INTERVALLO PROIBITO ossia intervallo
energetico E2 - E3 tra il massimo valore
energetico della banda di valenza e la
successiva banda vuota.
1.LA BANDA DI VALENZA ossia intervallo
energetico E1 - E2 in cui ci sono gli elettroni
di valenza.
Conduttori e isolanti
ISOLANTE Se l'intervallo proibito
ha un'ampiezza superiore ad 1 eV
SEMICONDUTTORE Se esiste
intervallo proibito di ampiezza
inferiore ad 1 eV
CONDUTTORE Se la banda di
valenza è parzialmente
sovrapposta a quella di conduzione
leghe
Soluzioni solide
Miscela solida di due o più sostanze unita in
una
unica fase.
Si identificano soluzioni solide:
• Sostituzionali
• Interstiziali
leghe
Sostituzionali
Soluzione solida in cui gli atomi di un elemento
(soluto)
possono sostituire gli atomi dell’altro elemento
(solvente).
In alcune soluzioni solide si possono avere
sostituzioni
da poche unità atomiche a quasi il 100%
LEGHE
leghe da fonderia, cioè quelle destinate alla
realizzazione di getti per colata in terra ("in
sabbia"), in forma metallica (" in conchiglia") o
sotto pressione ("pressofusione");
- leghe da lavorazione plastica, cioè quelle
destinate a lavorazioni per deformazione
plastica sia a caldo che a freddo (laminazione,
estrusione, fucinatura, imbutitura, trafilatura,
ecc.).
Tale distinzione associata alle tecnologie di
trasformazione è solo in parte giustificata: essa
risponde soprattutto a criteri pratici.
LEGHE
Interstiziali
Soluzione solida in cui gli atomi di un elemento
(soluto) possono entrare negli interstizi o nei
vuoti
dell’altro elemento (solvente).
Interstiziali
Elementi che possono dare soluzioni solide
sono
Idrogeno, carbonio, ossigeno, azoto
Es Lega ferro-carboni
è l’acciaio (lega Fe-C),
Due parole sui
metalli
In queste diapositive sono illustrate le
caratteristiche più salienti di ogni
metallo
In alcuni casi si indicano solo
video,testi o simili dove reperire il
materiale.
Metalli alcalini
• Vedi video
•
•
•
•
•
•
Li
Na.
K
Rb
Cs
Fr
metalli leggeri
leghe leggere
• Alluminio
• Processo di
anodizzaione
• Produzione e riciclo:la
produzione di un
oggetto con alluminio
riciclato costa 70% in
meno che con Al puro.
• Importanti le leghe
• Magnesio. Puro non ha
utilizzi importanti
• Leghe leggere con Al
• Titanio biocompatibile,
• Si colora per
interferenza
Metalli nobili
•
•
•
•
•
Argento
Oro
Rame
Platino
Palladio
• Si trovano allo stato
nativo
• Non reagiscono con O2
• Alto potenziale di
riduzione
CFC
Ferro e sue leghe
• Ferro
• Vedi ppt
• La maggior parte dei
manufatti metallici sono
inn lega di ferro
• Ferro puro non
utilizzabile
ccc
• Acciaio
• ghisa
• Vedi ppt
Rame e sue leghe
•
•
•
•
•
Rame
Colore
Ottimo conduttore
insetticida
Vedi ppt
• Ottone
• Bronzo
• Vedi ppt
Metalli di transizione
•
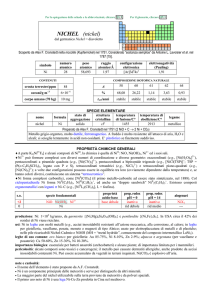
Nichel
•
L'uso principale di nichel è nella preparazione delle
leghe. Le proprieta' principali delle leghe del nichel
sono resistenza, duttilità e resistenza alla corrosione
ed al calore. Molti acciai inossidabili contengono il
nichel: circa il 65 % del nichel consumato nel mondo
occidentale sono usati per fare acciaio inossidabile,
la cui composizione può variare ma e' tipicamente
ferro con 18% cromo e 8% nichel. Il 12 % di tutto il
nichel consumato va a finire nelle superleghe. Il
23% restante è diviso tra acciai legati, batterie
ricaricabili, catalizzatori e gli altri prodotti chimici,
coniatura, prodotti di fonderia e placcatura.
Il nichel è facile da lavorare e può essere modellato
in cavi. Resiste alla corrosione anche a alte
temperature e per questo motivo è usato in turbine
a gas e motori oscillati. Il Monel è una lega di nichel
e rame (per esempio 70% nichel e 30% rame con le
tracce di ferro, manganese e silicio), che è non
soltanto duro ma può resistere alla corrosione
dall'acqua di mare; è quinid ideale per l'elica delle
barche e pe impianti di desalificazione.
•
Cobalto
•
Il cobalto è usato in molte leghe (superleghe, per
parti nei motori delle turbine a gas dei velivoli,
leghe resistenti alla corrosione, acciai ad alta
velocità, carburi cementati), nei magenti e nei mezzi
magnetici per la registrazione, come catalizzatore
per l'industria chimica e petrolifera, come agenti
essiccante per vernici e inchiostri. Il blu cobalto è
una componente importante della gamma di colori
degli artisti ed è usato in lavori in porcellana,
ceramica, vetro macchiato, mattonelle e smalti per
gioielleria. Il suo isotopo radiattivo, il cobalto-60, è
usato nelle cure mediche ed anche per irradiare gli
alimenti, per conservarli e proteggere il
consumatore.
Terre rare
Sono costituiti da due serie di 14 elementi e si dispongono nel 6° e 7° periodo, tra il 3°
ed il 4°
Attinidi
•
•
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
Torio Protoattinio Uranio Nettunio Plutonio Americio
Curio Berkelio Californio Einsteinio Fermio Mendelevio
Nobelio Lawrenzio
•
Sono elementi dal carattere metallico, di colore
bianco-argenteo, reattivi. Sono tutti elementi
radioattivi, con tempi di semivita relativamente
brevi (tranne 232Th, 235U e 238U che hanno t½
paragonabili all'età della terra e sono detti di
origine primaria).
•
•
•
.
gruppo della tavola periodica
• Lantanidi
•
L'uranio è l'elemento più utilizzato della
serie e trova applicazione principalmente
come combustibile nei reattori nucleari.
•
•
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Cerio Praseodimio Neodimio Promezio Samario Europio Gadolinio Terbio
Disprosio Olmio Erbio Tulio Itterbio Lutezioinidi
•
I lantanidi esistono tutti in natura,
con la sola eccezione del promezio
(Pm, Z = 61, ottenuto per via
sintetica), nella quale si trovano
esclusivamente nei composti. Pur
essendo comunemente chiamati
terre rare, in natura hanno una certa
abbondanza. Ad esempio, il Ce
(6.6·10-3% in peso nella crosta
terrestre; 25° elemento per
abbondanza) ha un'abbondanza
simile a quella del Cu ed è circa
quattro
volte più abbondante del Pb.
•
•
•
•
Semiconduttori semimetalli
•
•
•
•
Silicio
Germanio
Antimonio
selenio
• gallio