Anatomia della tiroide
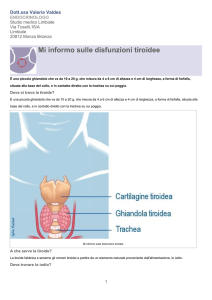
La tiroide è una delle ghiandole endocrine più grandi e
nell’adulto pesa circa 20 gr. È composta di due lobi (forma
a farfalla) che giacciono ai lati della trachea sotto la laringe.
I due lobi sono connessi fra loro da un lembo di tessuto
detto istmo. Contrae rapporti con le ghiandole paratiroidi
che appaiono come 4 piccoli noduli di colore più chiaro.
Secerne gli ormoni tiroidei che hanno la funzione di
aumentare la rate metabolica dell’organismo. Secerne
anche calcitonina.
istmo
La ghiandola è molto vascolarizzata, tanto da essere uno
degli organi più vascolarizzati dell’organismo e ha anche
un’elevata capacità di crescita come si dimostra in casi di
carenze di iodio in cui si verifica una condizione patologica
nota con il nome di gozzo.
Molto caratteristica è la struttura interna della tiroide che
risulta essere organizzata in follicoli (100-300 µm)
strettamente stipati. Nell’adulto sono circa 3 milioni. Nello
spazio fra due follicoli si trovano le cellule parafollicolari
che secernono l’ormone calcitonina.
L’ultrastruttura microscopica delle paratiroidi è invece molto
diversa perché le cellule sono invece strettamente
assiepate ed organizzate in una sorta di rete a stretto
contatto con i capillari sanguigni
L’epitelio follicolare è monostratificato e cuboidale e
l’interno del follicolo è riempito con un liquido che
prende il nome di colloide la cui componente principale
è una proteina detta tireoglobulina che serve come
precursore degli ormoni tiroidei.
Ogni follicolo è circondato da una fitta rete capillare.
Vediamo come sono sintetizzati gli ormoni tiroidei.
T3 e T4
L’ormone principale prodotto dalla tiroide è il T4 o
tiroxina, mentre l’ormone T3 è prodotto in quantità
decisamente inferiori. I composti monoiodotirosina
(MIT) e diiodotirosina (DIT) non sono praticamente
secreti nel sangue. Parte fondamentale della molecola
di ormoni tiroidei è lo iodio. Poiché lo iodio non sempre
è presente nella dieta in quantità adeguate, la tiroide
ha la capacità di concentrarlo.
Struttura degli
ormoni tiroidei
La tireoglobulina è una grossa (MW 660 kDa) glicoproteina la
cui parte glicidica viene aggiunta alla parte proteica a livello
dell’apparato del Golgi. Contiene 134 tirosine di cui solo
alcune sono usate per fare T3 e T4. Dal Golgi la
tireoglobulina viene secreta dal lato apicale delle cellule nel
lume del follicolo. Qui viene iodinata ed immagazzinata come
parte del colloide.
Steps per la formazione degli ormoni tiroidei:
– Captazione di iodio in forma ionica (I-) dal plasma
attraverso un trasporto attivo secondario che è un
simporto Na+/I- (iodine trap), il quale determina un
elevato gradiente di iodio fra esterno e interno della
cellula (circa 30 volte in condizioni normali e fino a
250 volte in casi di iperfunzionamento della
ghiandola). A questo proposito va detto che è
necessario ingerire con la dieta circa 1mg/settimana
di iodio.
2.
1.
– Diffusione verso la parte apicale della cellula e da
qui verso la colloide. Nel follicolo lo iodio viene
ossidato dall’enzima perossidasi tiroidea, che è una
proteina integrale della membrana apicale della
cellula, a formare iodio. La tireoglobulina viene
organicata, cioè lega iodio sulle Tyr sostituendo uno
ione H e questo processo è molto velocizzato
dall’azione di un enzima detto iodinasi. Si forma così
un residuo MIT che resta legato alla tireoglobulina
mediante legami peptidici. Se viene aggiunto un altro
iodio si forma DIT.
A questo punto due Tyr iodinate adiacenti danno luogo ad
un accoppiamento con formazione di tironina. 1MIT +
1DIT= T3 e 2DIT= T4
Quando è indotto il rilascio di ormoni tiroidei la cellula
epiteliale emette pseudopodi nel lume del colloide
circondando gocce di colloide e formando vescicole
pinocitotiche che inglobano la tireoglobulina.
All’interno della cellula la
goccia di colloide si fonde con
i lisosomi a formare un
fagolisosoma i cui enzimi
digeriscono la tireoglobulina e
liberano gli ormoni tiroidei.
Questi ultimi, a livello della
parte basale della cellula,
sono rilasciati in forma libera
e passano nel sangue e
quindi in circolo (90% T4 e
10% T3)
MIT e DIT liberati nella
cellula sono deiodati da una
deiodinasi che permette di
riciclare lo iodio per la
formazione di nuovi ormoni.
Il principale fattore di controllo per il rilascio degli
ormoni tiroidei è il TSH (28 kDa) per il quale
esistono specifici recettori a livello della membrana
basale delle cellule epiteliali del follicolo. Tali
recettori sono accoppiati all’adenilato ciclasi che
porta ad un aumento del c-AMP. Quali sono gli
effetti del TSH sulle cellule follicolari?
Effetti del TSH. Il TSH stimola:
1.
Captazione di iodio
2.
Sintesi di tireoglobulina
3.
Ossidazione dello iodio
4.
Formazione di pseudopodi e inglobamento di colloide
5.
Movimento dei lisosomi dalla parte basale a quella
apicale
6.
Movimento dei fagolisosomi in senso opposto
7.
Attività di deiodinasi
8.
Crescita delle cellule follicolari
Tutto il sistema è sotto
controllo ipotalamico
attraverso l’asse ipotalamoipofisario. Infatti sappiamo che
esiste un fattore TRH
ipotalamico che interagisce
con le cellule secernenti
dell’adenoipofisi attraverso un
meccanismo mediato dalla
fosfolipasi C e quindi dal DAG
e IP3.
Lo stimolo principale per la secrezione di TRH e TSH è il
freddo. Tuttavia gli ormoni tiroidei rispondono anche
all’assunzione di cibo e alla diminuita rate metabolica
durante il digiuno.
Come sono trasportati nel sangue gli ormoni tiroidei? Essi
circolano legati a proteine plasmatiche e fra queste in
particolare alla globulina legante la tiroxina (TBG) di origine
epatica, ma anche all’albumina e alla transtireina. In questo
modo si mantiene un pool stabile di ormoni tiroidei da cui
gli ormoni liberi sono rilasciati per legarsi alle cellule target.
Nell’organo bersaglio il T4 viene convertito in T3 che è
molto più attivo, anche se, di tutti gli ormoni tiroidei liberati,
il T3 rappresenta solo il 7% e il T4 il 93%.
Recettori per T3 e T4
Appartengono alla superfamiglia dei recettori nucleari e
agiscono modulando l’espressione genica. I recettori per
T3 e T4 si legano al DNA in assenza dell’ormone
determinando in generale repressione della trascrizione. Il
legame dell’ormone determina un cambiamento
conformazionale del recettore che causa il suo
funzionamento come attivatore della trascrizione.
Il recettore degli ormoni tiroidei nei Mammiferi è codificato
da due geni designati α e β. Inoltre il trascritto primario di
ciascun gene può subire splicing alternativo generando
diverse isoforme. Comprende tre domini funzionali:
- Dominio di transattivazione: all’N-terminale interagisce
con altri fattori di trascrizione a formare complessi che
attivano o inibiscono la trascrizione.
- Dominio che lega il DNA: si lega a sequenze del
promotore dette hormone-responsive-elements
- Dominio di legame dell’ormone e di dimerizzazione: al Cterminale
The different forms of thyroid receptors
have patterns of expression that vary
by tissue and by developmental stage.
Effetti degli ormoni tiroidei
L’effetto generale degli ormoni tiroidei è quello di
determinare un aumento della trascrizione nucleare di molti
geni che codificano per proteine strutturali, enzimi, proteine
di trasporto etc. con un generale aumento del metabolismo
corporeo. Si può dire che rivestano un ruolo fondamentale
nella regolazione dello sviluppo corporeo e nel controllo
della velocità con cui avvengono le reazioni metaboliche
dell’organismo.
Non sono ormoni indispensabili per la vita, ma la loro
mancanza determina un accrescimento corporeo più lento
e non corretto, un’attività basale rallentata.
L’ipotiroidismo ha comunque conseguenze più o meno
gravi in funzione dell’età. Hanno un ruolo importante nella
produzione di calore e nell’aumentato consumo di O2.
Conseguenza ne è una forte vasodilatazione ed un
aumento di frequenza e gittata cardiaca per distribuire più
sangue, nonché un aumento della rate respiratoria.
Sono essenziali per l’accrescimento corporeo e
determinano regolazione del gene per il GH.
N.B.: conversione
di T4 in T3 che
determina una
percentuale del tipo
10% T4
90% T3
Una forte secrezione di ormoni tiroidei induce un aumento
del metabolismo fra il 70 e il 100% che determina:
Accelerazione dei processi metabolici per la
conversione dei nutrienti in energia
Accelerazione del catabolismo
Eccitamento dei processi mentali (stimolano lo
sviluppo del sistema nervoso fetale e neonatale)
Aumento dell’attività cardiaca (aumento di
frequenza, contrattilità e volume sistolico)
Aumento della rate respiratoria
Aumento della sudorazione
Aumento delle secrezioni ghiandolari
Aumento ovviamente del consumo di ATP
Metabolismo
Metabolismo lipidico: stimola la mobilitazione dei grassi con
un aumento di acidi grassi nel sangue. Incrementa
l’ossidazione degli acidi grassi.
Metabolismo glucidico: potenziano l’ingresso di glucosio
mediato da insulina nelle cellule, aumentano la
gluconeogensi e la glicogenolisi per generare glucosio
libero
Nei soggetti giovani gli ormoni tiroidei hanno anche
pesanti ripercussioni sulla crescita, tanto che soggetti
ipotiroidei in fase giovanile manifestano problemi di
accrescimento. Nella vita fetale sono fondamentali per il
corretto sviluppo del cervello: la carenza durante lo
sviluppo determina cretinismo.
massa magra
richiesta di vitamine
uptake di glucosio
gluconeogenesi
assorbimento intestinale
secrezione di insulina
massa adiposa
T3 , T4
colesterolo, fosfolipidi e
trigliceridi nel plasma
output cardiaco
frequenza cardiaca
volume ematico
rate respiratoria
secrezioni e motilità gi
mobilizzazione dei grassi dai tessuti
ossidazione degli acidi grassi
Uno degli effetti principali degli ormoni tiroidei è l’induzione
della termogenesi. Gli ormoni tiroidei agiscono infatti per
disaccoppiare la funzione mitocondriale dalla produzione di
ATP determinando la trascrizione di geni che codificano
per proteine a funzione disaccoppiante. Il gradiente
protonico mitocondriale viene sfruttato per produrre calore
invece che per la formazione di ATP. Questo avviene
soprattutto nel tessuto adiposo bruno che deve il suo
colore proprio all’elevato numero di mitocondri presenti.
Brown adipose tissue varies in color from dark red to tan,
reflecting lipid content. Its lipid reserves are depleted when
the animal is exposed to a cold environment, and the color
darkens. In contrast to white fat, brown fat is richly
vascularized and has numerous unmyelinated nerves
which provide sympathetic stimulation to the adipocytes.
Brown fat is most prominent in newborn animals. In human
infants it comprises up to 5% of body weight, then
diminishes with age to virtually disappear by adulthood.
Brown fat is of particular importance in neonates, small
mammals in cold environments, and animals that
hibernate, because it has the ability to dissipate stored
energy as heat.
In contrast to other cells, including white adipocytes,
brown adipocytes express mitochondrial uncoupling
protein, which gives the cell's mitochondria an ability to
uncouple oxidative phosphorylation and utilize substrates
to generate heat rather than ATP.
Exposure to cold leads to sympathetic stimulation of brown
adipocyte via norepinephrine binding to beta- adrenergic
receptors. As in white fat, sympathetic stimulation promotes
hydrolysis of triglyceride, with release of fatty acids and
glycerol. However, within brown adipocytes, most fatty
acids are immediately oxidized in mitochondria and,
because of the uncoupling protein, a large amount of heat
is produced. This process is part of what is called non-
shivering thermogenesis.
Tessuto adiposo
giallo
vs
tessuto adiposo
bruno
Gozzo
Un tipico esempio di cattivo
funzionamento della tiroide in
seguito a mancanza di iodio
nella dieta è lo sviluppo del
gozzo.
Senza iodio gli ormoni tiroidei
non possono essere formati
dai loro precursori
1. L’assenza di ormoni tiroidei determina il rilascio del
fattore ipotalamico TRH
2. Questo stimola la secrezione di TSH ipofisario
3. Questo stimola la sintesi dei precursori di T3 e T4
che tuttavia non sono formati per mancanza di
iodio. I precursori si accumulano determinando
ingrossamento della tiroide e quindi il caratteristico
gozzo.
Ipertiroidismo e…..
Quali sono le cause di ipertiroidismo?
• morbo di Basedow -Graves
• gozzo iperfunzionante
• un nodulo iperfunzionante (adenoma
tossico)
• inappropriata secrezione di TSH
• secrezione tumorale di fattori TSH simili
• tiroiditi
• assunzione farmacologica in eccesso di
ormone tiroideo
• tumori ovarici
• metastasi di tumori tiroidei differenziati
Si tratta nella maggior parte dei casi di una forma ad
origine autoimmune. Le patologie autoimmuni della tiroide
rappresentano, dopo il diabete, la forma più diffusa di
malattie endocrine. Altre volte può trattarsi di una forma
tumorale
Gli effetti sono:
Aumento della rate metabolica
Scarsa tolleranza al caldo e sudorazione eccessiva
Tendenza a perdere peso
Affaticamento muscolare per catabolismo delle proteine
contrattili
Palpitazioni e tachicardia
Irritabilità nervosa, tensione, ansia
Esoftalmo per edema oculare
….ipotiroidismo (sindrome di Hashimoto)
La tiroidite di Hashimoto è causata da
anticorpi prodotti dal sistema immunitario
che distruggono la tiroide.
L’ipotiroidismo (nell’adulto detto mixedema) può essere
dovuto a:
Mancata produzione di T3 e T4
Carenza di TRH o TSH per cui la tiroide è
scarsamente stimolata
Carenza di iodio nella dieta e quindi mancata
produzione di ormoni
Gli effetti sono:
Ridotta rate metabolica
Scarsa tolleranza al freddo
Tendenza ad aumentare di peso
Scarsa resistenza muscolare
Movimenti lenti e deboli
Riflessi lenti e scarsa attenzione
Gonfiore della faccia, mani e piedi per accumulo di
mucoproteine nel tessuto connettivo (mixedema)
Capelli ruvidi e scarsi; pelle secca e giallastra
Tireotossicosi da hamburger
Gli ormoni tiroidei si dice che siano oralmente attivi perché il
consumo di carne proveniente dalla tiroide determina una
caratteristica forma di ipertiroidismo. Diverse forme di questo
ipertiroidismo erano dovute alla pratica, comune negli USA e
ora abolita, di utilizzare la carne proveniente dal collo di
animali macellati per fare hamburger. Poichè la carne della
tiroide ha un colore rosso ed è localizzata nel collo, non veniva
facilmente individuata e separata da altri tipi di carne e finiva
nell’impasto di hambuger e salsicce. Il consumo di questi cibi
facilmente induceva nei consumatori abituali una forma di
ipertiroidismo anche con pesanti conseguenze.
Quadro clinico
dell’ipotiroidismo
congenito
Cretinismo
Il cretinismo si sviluppa in neonati che manchino
della funzione tiroidea. Prima della nascita il bambino
riceve gli ormoni dalla mamma, ma poche settimane
dopo la nascita inizia a manifestare difficoltà nei
movimenti e la crescita fisica e mentale è molto
rallentata. Insorge nanismo disarmonico perché gli
ormoni tiroidei regolano con il GH l’accrescimento
corporeo
A 44 yr. old man who has always been
cared for by his mother is presented.
He is severely retarded and cannot
communicate. He is only 40” tall, his
epiphyses are still open, although
severely damaged. He has very thick,
dry skin. His tongue is thick, and he has
a saddle nose. He still has his primary
teeth; the secondary teeth have not
erupted.
Il sistema delle ghiandole paratiroidee insieme alla
secrezione di calcitonina da parte della tiroide
costituisce un sistema fondamentale per la
regolazione del calcio e del fosfato plasmatico i cui
sali sono fondamentali per la formazione delle
ossa e dei denti.
Prima di parlare dell’ormone PTH e della
calcitonina vediamo qualcosa su calcio e fosfato e
sul loro ruolo nel processo di ossificazione.
Calcio e fosfato sono entrambi assorbiti per via
intestinale. Il normale turnover di calcio giornaliero in
un adulto è come segue:
mg
Intake
1000
Assorbimento intestinale
350
Secrezione nei succhi
gastrointestinali
150
Assorbimento netto
(350-150) 200
Perdita con le feci
800
Escrezione con le urine
200
Quanto calcio?
Da dove?
Per quanto riguarda il fosfato questo viene escreto
con le urine. Quando la concentrazione plasmatica
è uguale o inferiore a 1mM/l allora il rene non ne
elimina perché viene tutto riassorbito per essere
utilizzato. Se la concentrazione è superiore allora il
rene ne elimina con le urine in accordo con la
concentrazione plasmatica.
Vedremo che l’azione del PTH e della calcitonina
è coadiuvata dall’azione della vitamina D che
deve essere attivata attraverso una serie di
passaggi che avvengono nel fegato e nel rene
portando alla formazione di un composto attivo
che viene chiamato 1,25-(OH)2 -D3 (1,25diidrossicolecalciferolo).
PELLE
Colecalciferolo (D3)
FEGATO
7-deidrocolesterolo
25-OH-colecalciferolo
RENE
1,25-(OH)2-colecalciferolo
EPITELIO INTESTINALE*
Ca-binding-protein
Ca-stimulated ATPase
Fosfatasi acida
Assorbimento intestinale di calcio
* Effetto ormonale dell’ 1,25-(OH)2-colecalciferolo
Calcio nel plasma e nel fluido interstiziale
La concentrazione del calcio nel plasma è circa 9-10mg/dl
ed è presente in tre diverse forme:
9%ca
Ca legato a sali
(diffusibile)
non ionico
41% ca
Ca legato a
proteine,
principalmente
albumina
(non diffusibile)
50%
ionico
diffusibile
metabolicamente
attivo
Ca2+
Fosforo nel plasma e nel fluido interstiziale
Il fosforo è presente in diverse forme:
A. 30% fosforo inorganico
10% legato a proteine (non filtrabile)
90% ionico (liberamente filtrabile)
•
5% esiste come sale di fosfato divalente di Ca
o Mg
•
30% come sale di Na
•
65% ione fosfato libero
20% H2PO480% HPO42-
B. 70% fosforo organico (fosfolipidi, fosfoproteine,
fosfonucleotidi)
Ormone paratiroideo: PTH
Il PTH (ormone ipercalcemizzante) è secreto dalle
ghiandole paratiroidee che sono 4 e localizzate subito
dietro alla tiroide. Sono molto piccole e difficili da
localizzare. Queste ghiandole, assolutamente vitali,
contengono le cosiddette cellule principali che secernono
PTH, oltre alle cellule ossifile che sono probabilmente
cellule principali invecchiate. Lo stimolo principale per la
secrezione di PTH è una diminuzione della concentrazione
plasmatica di calcio.
• Polipeptide finale attivo di 84 aminoacidi (9kDa)
• Sintetizzato come parte di un pre-pro-ormone di 115
aminoacidi di cui una parte eliminata a livello del Golgi
• Gene localizzato sul cromosoma 11
Osso
Le ossa dello scheletro sono di due tipi:
Osso corticale più esterno che forma la parte più compatta
e forte, densamente impaccata, molto densa. L’osso
corticale comprende l’85% dello scheletro. Non ha contatti
con il midollo osseo.
L’osso trabecolare è la parte spugnosa più interna
composta da una matrice di collagene. Costituisce il 15%
della massa scheletrica ed ha una rigidità ed elasticità che
sopporta gli stress meccanici. Contiene al suo interno il
tessuto ematopoietico.
Il rimodellamento dell’osso avviene lungo tutto l’arco
della vita, anche se rallenta con l’età. Il bilanciamento
fra attività degli osteoblasti e degli osteoclasti risulta in
degradazione e sintesi di nuovo osso. L’attività di
questi due tipi cellulari si condiziona a vicenda
attraverso una modulazione paracrina.
Gli osteoblasti derivano da cellule mesenchimali e sono
adagiati sopra l’osso. Sono cellule mononucleate e
contengono la fosfatasi alcalina che ha una funzione
importante nella mineralizzazione dell’osso. Depositano
calcio nella matrice cioè formano l’osso corticale e
producono collagene e altre proteine per formare la matrice
interna. Dagli osteoblasti derivano gli osteociti che restano
intrappolati nelle lacune interne pur rimanendo in contatto
con gli osteoblasti di superficie.
La matrice osteoide è formata da sali minerali e calcio sotto
forma di idrossiapatite, mentre la parte organica è costituita
da collagene.
Sotto l’azione del PTH il calcio è catturato dagli osteociti,
trasportato in superficie agli osteoblasti che lo pompano nel
liquido extracellulare
Gli osteoclasti sono cellule di origine macrofagica,
plurinucleate che sono localizzate nella matrice dell’osso e
vicino al sito di riassorbimento (lacune di Howship).
Contengono fosfatasi acida contro il substrato minerale.
Dapprima liberano calcio e poi degradano la matrice ossea.
Fasi dell’ossificazione intramembranosa
Differenziazione degli osteoblasti nel connettivo
Formazione di gruppetti di osteoblasti che iniziano a
secernere le componenti organiche della matrice
La matrice (sostanza osteoide) va incontro a
mineralizzazione
Alcuni osteoblasti rimangono intrappolati in lacune ossee e
si differenziano in osteociti
L’osso si espande in direzione centrifuga rispetto al centro
di ossificazione, formando estroflessioni dette spicole
4 tipi di cellule
tre stadi
evolutivi
periostio
della
stessa
cellula
osteoblasto
osteoide
matrice ossea
mineralizzata
canalicolo
osseo
fibre collagene
preosteoblasto
osteoclasto:
cellula derivante
dallaosteoclasto
linea
monocitoorletto increspato
macrofagica
lacuna di Howship
osteocito
Gli osteoclasti riassorbono l’osso. Sono cellule grandi,
plurinucleate, di forma irregolare, che derivano dalla linea
cellulare ematopoietica. Gli osteoclasti hanno recettori
specifici per la calcitonina e per 1,25(OH)2D3 , PTH.
+
-
La secrezione di PTH è sotto controllo stretto dellla
concentrazione del calcio plasmatico. Le cellule principali
delle ghiandole paratiroidee portano infatti in superficie un
recettore (140kDa) per il calcio legato a G-proteine. Se la
concentrazione di calcio è elevata la subunità α della Gproteina mantiene attiva la PLC con formazione di IP3 e
DAG. La produzione di cAMP è inibita e così la produzione
di PTH. L’opposto avviene per basse concentrazioni di
calcio con stimolazione del PTH. Quando il calcio è in
valori fisiologici c’è un bilanciamento fra i due meccanismi
che mantengono una valore basale di PTH.
The calcium-sensing receptor is a member of the G
protein-coupled receptor family. The large (~600 amino
acids) extracellular domain is known to be critical to
interactions with extracellular calcium. The receptor also
has a rather large (~200 amino acids) cytosolic tail.
Gli organi bersaglio dell’ormone PTH sono:
Osso: riassorbimento di calcio e fosfato
dall’osso stimolando l’attività degli osteoclasti
Rene: riassorbimento tubulare di calcio dalle
urine e formazione di 1,25-(OH)2D3.
Intestino: riassorbimento di calcio grazie
all’attivazione della vitamina D a livello renale.
L’azione del PTH è mediata dal cAMP che funziona
come secondo messaggero
Parathyroid hormone (PTH) acts via a G-protein (G)
linked receptor (R) to activate adenyl cyclase (AC) which
converts ATP to cAMP. This second messenger
stimulates signal transduction processes that activate
various functions on bone cells and kidney tubular cells
Assorbimento di calcio dall’intestino
Il calcio entra attraverso i microvilli degli enterociti
attraverso canali del calcio la cui apertura e chiusura è
regolata dalla concentrazione del calcio stesso. Gli ioni
sono trasportati verso la membrana basolaterale con
una serie di proteine (calmodulina, calbindina e pompa
Na+/Ca2+) che hanno un’affinità via via crescente per il
calcio. In assenza di vitamina D l’assorbimento di
calcio è fortemente compromesso.
Un meccansimo alternativo prevede il passaggio
transcellulare……
…..oppure formazione di vescicole endocitotiche.
Tutti i meccanismi di trasporto richiedono Ca-BPs la cui
sintesi è incrementata dalla vitamina D.
Sindromi delle paratiroidi
Elevati livelli ematici di PTH determinano
iperparatiroidismo: se la causa risiede nelle ghiandole si
parla di iperparatiroidismo primario (adenomi, iperplasia
e cancro delle paratiroidi), mentre se dipende da cause
esterne si parla di iperpartiroidismo secondario (disordini
renali)
Bassi livelli di PTH determinano ipoparatiroidismo. Le
cause più comuni includono incidenti chirurgici derivanti
da un’errata asportazione della tiroide, malattie
autoimmuni ed errori metabolici congeniti
Calcitonina
L’ormone calcitonina è
l’antagonista del PTH, nel senso
che è un ormone
ipocalcemizzante.
È secreto dalle cellule
parafollicolari della tiroide ed è un
ormone proteico di 32aa (MW
3400) che deriva da un pre-proormone più grande. Contiene un
singolo legame S-S.
Lo splicing alternativo del trascritto primario dà origine al
calcitonin-gene-related-peptide (CGRP) che funziona come
mediatore a livello di SNC e sistema cardiovascolare. Il
recettore per la calcitonina appartiene alla famiglia dei 7helix-spanning-receptors e attiva l’enzima AC.
L’effetto principale della calcitonina è quello di diminuire i
livelli di calcio plasmatico agendo su due bersagli principali:
- Osso: inibisce l’azione degli osteoclasti
- Rene: promuove l’escrezione urinaria di calcio e fosfato
inibendo il riassorbimento tubulare
L’ organo bersaglio principale della calcitonina è
l’osso, mentre l’azione sul rene è più ridotta e
sull’intestino praticamente assente. A livello dell’osso
la calcitonina riduce la formazione di nuovi osteoclasti
e ne riduce l’attività di riassorbimento.
Sono due ghiandole, ciascuna del peso di circa 4 gr,
che si trovano al di sopra dei reni da cui il nome
surrenale. La loro integrità anatomica e funzionale è
fondamentale per la sopravvivenza. Ciascuna
ghiandola comprende due diverse entità funzionali:
una parte corticale (circa l’80-90% del peso
totale)
una parte midollare.
La parte midollare deriva
ed è correlata al sistema
nervoso autonomo
simpatico derivando dalle
cellule neuroectodermiche
dei gangli simpatici.
Secerne adrenalina e
noradrenalina nelle
reazioni di fight-and-fly
response.
Le ghiandole surrenali
sono molto vascolarizzate
ed hanno un flusso
sanguigno per grammo di
tessuto fra i più alti di tutto
l’organismo.
La parte corticale di derivazione epiteliale è suddivisa a sua
volta in tre zone:
Glomerulare (elettroliti → mineralcorticoidi): secerne
aldosterone. Sovraintende al mantenimento
dell’equilibrio idrico-salino
Fascicolata (effetti sul glucosio → glucocorticoidi):
secerne cortisolo, cortisone, corticosterone (è la zona
più grande). Ha effetti anche sul metabolismo dei
grassi e delle proteine
Reticolare (ormoni androgeni): secerne ormoni
sessuali ma di scarsa importanza
Glucocorticoids & sex steroids support growth &
development, especially in the embryo, gonads,
brain, & pubertal animal. Glucocorticoids helps
maintain glucose homeostasis & modulate stress
responses
Mineralocorticoids help maintain sodium balance
& blood pressure
Sex steroids regulate & maintain gametogenesis
& reproductive function
Sono stati individuati almeno 30 ormoni secreti dalla
corticale. Gli ormoni della parte corticale sono di
natura steroidea e sono definiti corticosteroidi. Essi
hanno come precursore comune il colesterolo.
Indispensabile per
azione gluco- o
mineralcorticoide
Indispensabile per
azione
glucocorticoide
The broad spectrum of physiological functions
steroids control steroid over- or under- production
are key features of many health problems:
• Delayed or precocious growth or development
• Diabetes
• Abnormal immune response
• High blood pressure or sodium imbalance
• Female infertility, endometriosis, cystic ovaries,
ovarian failure, hirsutism, early pregnancy loss,
menopausal symptoms, osteoporosis, lactational
failure
• Male infertility, spermatogenic insufficiency,
erectile dysfunction, prostatic hyperplasia
• Reproductive cancers: breast, ovary, cervix,
endometrium; testicular, prostate
Nelle cellule il colesterolo è assunto per endocitosi mediata
da recettori.
Il colesterolo è veicolato dalle
lipoproteine a bassa densità
(LDL) che contengono elevate
concentrazioni di colesterolo e
si legano a recettori presenti
sulla superficie cellulare.
La maggior parte dei processi
che portano alla formazione
degli ormoni surrenalici avviene
in mitocondri e reticolo
endoplasmico.
*Attività note
regolate da ACTH
Desmolase
17-α Hydroxylyase
3-β Hydroxysteroid
21-β-Hydroxylyase
11-β-Hydroxylyase
17-20 Lyase
colesterolo
cortisolo
MEMBRANA PLASMATICA
Recettore LDL
colesterolo
Esteri del colesterolo
VACUOLI
colesterolo
cortisolo
MITOCONDRI
11-desossicortisolo
pregnenolone
pregnenolone
progesterone
RETICOLO ENDOPLASMICO
17-OH-progesterone
11-desossicortisolo
Nel sangue il cortisolo è legato ad una globulina detta
transcortina, mentre altro è legato all’albumina. Solo il 5%
circola in forma libera.
Tutti i corticosteroidi sono degradati a livello epatico
mediante ossidazione e coniugazione con acido
glucuronico. Sono eliminati con la bile nelle feci e in
maggior quantità con le urine.
Ruolo di ACTH
ACTH (ormone corticotropo), che deriva da un precursore
di grosse dimensioni il POMC, regola la produzione della
zona fascicolata e in minor misura della reticolare. ACTH si
lega al suo recettore con la produzione di cAMP. L’effetto
sulla produzione di cortisolo è abbastanza importante con
un classico feed-back negativo nel controllo della
secrezione di corticotropina, ACTH e cortisolo.
La produzione di ACTH è sotto controllo del CRH
ipotalamico che determina il rilascio di ACTH con un
meccanismo cAMP dipendente.
ACTH
cAMP
Peptide
attivatore della
steroidogenesi
Peptide di
induzione
dell’ormone
steroideo
IGF-2
immediato
successivo
lungo termine
Colestrolo esterasi
Produzione di pregnenolone
Legame al P450
Colestrolo estere sintetasi
Trascrizione di:
P450
Recettore LDL
Dimensione e
complessità degli
organelli
Numero e
dimensioni delle
cellule
La secrezione di mineralcorticoidi dalla zona
glomerulare è stimolata da meccanismi differenti. Uno
degli stimoli principali è il legame dell’angiotensina II a
recettori di membrana accoppiati alla PLC. Si ha
produzione di PKC e aumento del Ca2+ intracellulare.
A livello renale l’aldosterone prodotto regola la
ritenzione del sodio inducendo la trascrizione del gene
per la Na+/K+ ATPasi responsabile della ricaptazione
del sodio dalle urine.
Glomerulare: mineralcorticoidi
Manca l’enzima 17-α-idrossilasi e quindi non vengono
sintetizzati né cortisolo né
androgeni. Sono prodotti
17-α Hydroxylyase
solo mineralcorticoidi la cui mancanza causa la morte
entro 2-3 giorni. Infatti la concentrazione di NaCl
scende sotto i valori normali per eccesso di
escrezione urinaria e di conseguenza, il LEC
diminuisce e quindi il volume ematico. L’output
cardiaco diminuisce molto e sopravviene morte per
shock.
L’aldosterone rappresenta il principale
mineralcorticoide responsabile del riassorbimento
di Na+ e dell’escrezione di K+.
Quando per situazioni patologiche l’aldosterone
non viene secreto, grandi quantità di sali sono
perse con le urine causando non soltanto un
pericoloso sbilanciamento degli elettroliti, ma
anche una diminuzione del LEC.
L’aldosterone (steroideo) si lega ad un recettore
citoplasmatico con cui penetra nel nucleo
stimolando la trascrizione di mRNA e in particolare
stimola la sintesi di nuove Na-K ATPasi e
trasportatori apicali per il sodio
Sono noti 4 fattori che controllano la secrezione di
aldosterone dalla ghiandola surrenale che, in ordine di
importanza sono:
un aumento del potassio extracellulare (aumenta
moltissimo la secrezione di aldosterone)
un aumento dell’attività del sistema reninaangiotensina (aumenta moltissimo la secrezione di
aldosterone)
un aumento del sodio extracellulare (debolmente
riduce la secrezione di aldosterone)
ACTH rilasciato dall’adenoipofisi è fondamentale
per il rilascio di aldosterone, ma non ha effetto sul
controllo della rate di secrezione.
L’aldosterone è un ormone liposolubile che si lega la
recettore citoplasmatico attivando la sequenza di
attivazione del DNA. Specifici geni
sono trascritti
come il gene
della Na-K ATPasi
e di chinasi che
fosforilano
proteine
cromatiniche.
Fascicolare: corticosteroidi
Almeno il 95% degli effetti legati a questi ormoni sono
dovuti al cortisolo. Un’alterata funzionalità delle
ghiandole surrenali si ripercuote anche su un cattivo
utilizzo delle sostanze nutritive, su problemi mentali di
scarsa resistenza allo stress e su infezioni
specialmente respiratorie. Si dice che il cortisolo è un
ormone permissivo, nel senso che la sua importanza
non è tanto nell’iniziare i processi, quanto piuttosto nel
consentire che essi avvengano
L’effetto principale del cortisolo è la sua capacità a stimolare
la gluconeogenesi epatica (effetto anti-insulinico o
diabetogeno). Viene indotta anche glicogenosintesi e quindi
lo storage di glicogeno epatico (anabolismo epatico).
Questo comporta un aumento dell’attività degli enzimi
coinvolti nel processo, specialmente quelli destinati a
convertire aminoacidi in glucosio. Aumenta l’attività della
G6Pasi che libera glucosio in circolo. Mobilita aa extraepatici
(specie dal muscolo, catabolismo muscolare) che entrano
nel processo di gluconeogenesi epatica.
La glicemia aumenta considerevolmente (+50-100%): si parla
di diabete surrenalico.
Effetto antinfiammatorio
Per quanto riguarda il metabolismo proteico, il
cortisolo induce la riduzione degli stores proteici in
tutte le cellule, fatta eccezione per quelle epatiche, sia
stimolando il catabolismo, sia inibendo nuova sintesi
proteica. Gli aa sono mobilitati dai tessuti extraepatici.
Le proteine epatiche e le proteine plasmatiche, che
sono sintetizzate a livello epatico, aumentano.
In presenza di grandi quantità di cortisolo il muscolo
scheletrico può diventare talmente debole da non consentire
la posizione eretta. Al contrario la sintesi proteica a livello
epatico aumenta e così pure il livello delle proteine
plasmatiche.
Per quanto riguarda il metabolismo lipidico il cortisolo aiuta
noradrenalina e glucagone a mobilitare gli acidi grassi dal
tessuto adiposo (azione permissiva del cortisolo) e stimola
l’ossidazione degli acidi grassi nelle cellule. Questo avviene
soprattutto in caso di necessità per ricavare energia dai
depositi adiposi.
Il rilascio di cortisolo è fortemente stimolato da ACTH in
condizioni di stress fra cui:
Traumi di qualunque tipo
Infezioni
Caldo o freddo intensi
Iniezioni di norepinefrina o sostanze simpaticomimetiche
Interventi chirurgici
Immobilizzazione
Malattie debilitanti
Stress emotivi forti
Il cortisolo ha anche importanti effetti anti-infiammatori
bloccando il processo infiammatorio nei primi stadi poiché
inibisce la sintesi di acido arachidonico e quindi la
produzioni di fattori infiammatori; inoltre stabilizza le
membrane lisosomiali e riduce quindi la liberazione di
enzimi proteolitici limitando i danni tissutali.
I gluco-corticoidi riducono anche il numero di linfociti T e il
reclutamento di linfociti B.
RISPOSTA
INFIAMMATORIA
Fosfatidilcolina
Fosfolipasi
Lipocortina
Acido arachidonico
ciclossigenasi
lipossigenasi
Prostaglandine
trombossani
Leucotrieni
Vasodilatazione
Funzione neutrofila
Permeabilità
Fagocitosi
INIBIZIONE
Azione battericida
Lo stimolo principale per il rilascio
di cortisolo è ACTH ipofisario
La via del POMC
CRH stimola la
produzione di POMC
che aumenta la
produzione di
β-lipoproteine
All’interno della loro
sequenza esse
contengono β–MSH e
β –endorfine che si
legano a recettori per
gli oppiacei e modulano la percezione al dolore
Pro-opiomelanocortin (POMC) is a precursor polypeptide
with 241 amino acid residues.
This gene encodes a polypeptide hormone precursor that
undergoes extensive, tissue-specific, post-translational
processing via cleavage by subtilisin-like enzymes known as
prohormone convertases. There are eight potential cleavage
sites within the polypeptide precursor and, depending on
tissue type and the available convertases, processing may
yield as many as ten biologically active peptides involved in
diverse cellular functions
It is synthesised by
corticotrope cells of the anterior pituitary gland
melanotrope cells of the intermediate lobe of the
pituitary gland
about 3000 neurons in the arcuate nucleus of the
hypothalamus
smaller populations of neurons in the dorsomedial
hypothalamus and brainstem
melanocytes in the skin
Reticolare: ormoni androgeni
Gli ormoni androgeni della reticolare hanno scarsa
importanza in condizioni normali, ma possono conferire
caratteri sessuali secondari particolari nel caso in cui
vengano secreti in maniera anomala per disfunzioni della
ghiandola sessuale. Comprendono il DHEA
(deidroepiandrosterone) ed il suo solfato che hanno però
un’affinità molto inferiore per il recettore degli androgeni
rispetto al testosterone del testicolo. Sono trasformati in
testosterone, che, rispetto a quello di origine testicolare è
trascurabile.
Nelle femmine invece il testosterone surrenalico è
importante per mantenere alcuni caratteri sessuali
secondari. Anche progesterone ed estrogeni, che sono
ormoni tipicamente femminili sono secreti dalla ghiandola.
Hanno alcuni effetti sui caratteri sessuali secondari
Anomalie della secrezione surrenalica
Perdita di grandi quantità
di Na+ e acqua
Diminuzione dell’output
cardiaco
IPOFUNZIONAMENTO
Sensibilità a stress
Forte diminuzione del LEC e diminuzione del volume
ematico
Alterazione del glucosio ematico
Forte pigmentazione dovuta alla melanina
IPERFUNZIONAMENTO
Increase in abdomen size
Rounded face
Increased fat on upper back
Thinning of the skin
Thinning and weakness of the muscles of the upper arms and upper legs
Increased acne
Scalp hair loss in women
Excess facial hair in women.
Irregular menstrual
Severe fatigue
Weak muscles
High blood pressure
Irritability, anxiety and depression
Formata dalle cellule cromaffini, la zona midollare è il
principale sito di conversione dell’aminoacido tirosina nelle
catecolammine adrenalina e noradrenalina. Le cellule della
midollare derivano dalla cresta neurale embrionale e quindi
sono sostanzialmente neuroni. In particolare, sono neuroni
post-gangliari del sistema simpatico che hanno perso i loro
assoni e dendriti ricevendo innervazione delle
corrispondenti fibre pre-gangliari (nervo splancnico). La
midollare del surrene è di fatto un ganglio del sistema
nervoso simpatico.
In risposta a stress quali esercizio fisico o pericolo
imminente, le cellule della midollare rilasciano
catecolammine nella percentuale di 70:30 di
adrenalina : noradrenalina allo scopo di mobilitare
rapidamente substrati energetici. Gli effetti si
manifestano in:
aumento della frequenza cardiaca, vasocostrizione,
dilatazione bronchiolare e aumento del metabolismo,
effetti caratteristici della risposta “fight-and-fly”
Questi ormoni sono poi veicolati dal torrente
ematico e si legano ai recettori adrenergici
presenti sulla membrana delle cellule bersaglio,
dove inducono gli stessi effetti dell’innervazione
simpatica.
Rate limiting step
DOPA decarbossilasi
Dopamina β-idrossilasi
N-metil transferasi
Adrenalina e noradrenalina sono impaccate in granuli
elettron-densi che contengono anche ATP e diversi
neuropeptidi fra cui le enkefaline. La secrezione di questi
ormoni è stimolata da ACh rilasciata dalle fibre pre-gangliari
che innervano la midollare. Diversi stress stimolano il
rilascio, quali esercizio intenso, ipoglicemia e traumi.
Granuli elettron-densi
Recettori adrenergici e
meccanismo d’azione
• I recettori adrenergici appartengono alla categoria dei 7-
helix-spanning receptors, accoppiati a proteine G che
stimolano o inibiscono alcune pathways metaboliche
cellulari.
• La risposta fisiologica è complessa perché esistono
diverse sottoclassi di recettori differenzialmente espressi
in tessuti e cellule. I due gruppi di recettori α- e βadrenergici sono stati identificati sulla base di agonisti e
antagonisti farmacologici
Receptor
Effectively Binds
Effect of Ligand
Binding
α1
Adrenalina,
Noradrenalina
Increased free
calcium
α2
Adrenalina,
Noradrenalina
Decreased cyclic
AMP
β1
Adrenalina,
Noradrenalina
Increased cyclic
AMP
Adrenalina
Increased cyclic
AMP
β2
L’azione dello stesso ormone su due recettori differenti
produce spesso effetti opposti. Ad esempio la noradrenalina
induce vasocostrizione quando si lega ai recettori α e
vasodilatazione quando si lega ai recettori β.
Quando si legano allo stesso recettore adrenalina e
noradrenalina hanno praticamente lo stesso effetto.
)
)
Risposta adattativa allo stress
Descritta per la prima volta da Walter Cannon nel 1951.
Normalmente in condizioni normali i neuroni del locus
ceruleus hanno una frequenza di scarica piuttosto bassa.
Uno stimolo di allerta viene percepito dalla corteccia
sensoriale e, attraverso il talamo stimola il tronco encefalico,
determinando un aumento della scarica di questi neuroni nel
locus ceruleus che è appunto preposto alla risposta
fisiologica a panico e stress. In casi di pericolo prolungato i
neuroni del locus ceruleus attivano la branca simpatica del
sistema autonomo che rilascia noradrenalina su vari target
A livello di surrenali l’acetilcolina rilasciata dal nervo pregangliare determina il rilascio delle catecolammine midollari
che intervengono nella risposta fight and fly
Esistono fondamentalmente due tipi di agenti stressogeni:
Fattori che sono processati a livello cosciente di corteccia
cerebrale: sono tali quei fattori che coscientemente sono
considerati pericolosi nell’ambiente esterno.
Stress sistemici: sono variazioni dell’omeostasi corporea
come ipossia, ipotensione, necrosi. Sono stress in genere
accompagnati da dolore e/o emozioni intense