STORIA DELLA FISICA ATOMICA
-400ac Democrito riteneva inconcepibile che i corpi materiali potessero
essere divisi indefinitamente. Propose che tutte le sostanze fossero fatte
di parti invisibili, chiamate atomi che legate insieme formavano i corpi.
Riteneva che gli elementi fondamentali fossero 4: Terra, Acqua, Aria e
Fuoco. Anassimandro pensava invece che le sostanze fossero costitute
da vortici di fluidi particolari. La teoria dei 4-elementi più l’Etere o
Quintessenza, senza l’atomismo fu la più accreditata fino a 200 anni fa.
Aristotele la incluse nella sua filosofia, e in forme molto simili fa parte
del induismo e di altre filosofie.
~1780 A.L.Lavoisier dopo una lunga serie di eperimenti quantitavi con
bilancie e misure di volumi formula la legge della conservazione della
massa.
-1789 J.B.Richter tesi dott. a Koninsberg
De usu mateseos in chemia e
llll
nel 1792 publica Anfangsgrunde der Stochyometrie. In questi scritti
dichiara, contrariamente a quanto riteneva Kant, che la chimica era particolarmente adatta alla matematizzazione ed indicò nella stechiometria
un nuovo campo di indagine della chimica. Formula la legge delle proporzioni equivalenti: Le quantità di basi che saturano un acido stanno
sempre nella stessa proporzione l’una rispetto all’altra anche quando
saturano acidi diversi. Il lavoro di Richter fu fortemente contrastasto da
filosofi kantiani come J.F.Fries, chimici come C.L.Berthollet e fisici
come E.G.Fisher, anche se nel 1802 riunì i dati numerici di Richter, in
una tavola dei pesi equivalenti. Questi pensavano la reattività chimica
come una delle forze della natura, analoga alla gravitazione, ed ovvianon produceva solo combinazioni fisse ma aggregati, teorie in qualche
modo parenti delle idee di Cartesio.
-1807 J.Dalton pubblicaNew system of chemical philosophy, dove1espone
la legge delle proporzioni multiple nelle reazioni chimiche. Egli non fu il
primo a ritenere che le varie specie di sostanze chimiche sono composte di particelle dotate di pesi differenti, questa idea era comune a vari chimici del tempo.
Dalton fu il primo a dare delle regole valide di combinazione chimica,
proponendo che gli atomi si combinavano solo nelle forme più semplici
e a comprendere l’importanza dei pesi atomici per la teoria chimica. Le
regole di combinazione e i pesi daltoniani consentirono una vera e propria fondazione quantitativa della chimica moderna.
Dalton inizia come fisico interessato alla Metereologia. Si interessava della dissoluzione del
vapore d’acqua nell’aria e nel 1802 pubblica nei Memoirs di Manchester i concetti principali
sulle pressioni parziali nelle miscele di gas, concetti molto criticati da Bertholet ed altri
Importanti contributi alla teoria atomica vennero da W.H.Wollaston e da J.J.Berzelius.
-1815 W.Prout legato alla metafisica riduzionista nella quale si ipotizzava che tutti gli
elementi erano prodotti da una sola materia originaria cercò di dimostrare che tutti
gli elementi erano formati da idrogeno, basandosi sul fatto che i pesi atomici degli elementi erano multipli approssimati del peso atomico dell’H.
I contemporanei non condividevano le sue vedute citando per esempio che i pesi Cloro e del
Cadmio erano rispettivamente 35.46 e 112.41, che non sono multipli dell’H. La soluzione è
arrivata 100 anni dopo, con gli isotopi e con la equivalenza tra massa ed energia di legame.
-1823 A.Avogadro formula la legge: volumi uguali di gas alla stessa
temperatura contengono lo stesso numero di molecole. Fu largamente accettata dai chimici solo dopo il congresso di Chimica di Karlshrue del 1860 dove
S. Cannizzaro chiari il problema dei gas biatomici.
-1829 J.W.Dobereiner, (dopo la scoperta di numerosi elementi chimici vi fu all’inizio dell’800 la evidente la necessità di classificarli in qualche modo), richiamò l’attenzione che elementi con proprietà chimiche simili, si ritrovavano in gruppi di tre e che la media aritmetica dei pesi atomici del più leggero e del più pesante corrispondeva con buona aprossimazione al peso
atomico del terzo elemento del gruppo. Le triati citate compredevano:
calcio, stronzio e bario; litio, sodio e potassio; zolfo, selenio e tellurio;
2
cloro, bromo e iodio. Queste ricorrenze suggerono a molti
che gli atomi non fossero gli ultimi elementi della materia
ma che fossero composti di elementi più semplici.
D.I.Mendeleev nel 1867 iniziò il suo Osnovi khimii (Principi di chimica)
dove iniziava classificando gli alogeni (Cl,Br,I) ed i metalli alcalini(Li,Na,K),
in modo da far emergere, nonostante la stessa valenza, la loro contrarietà
chimica. Divenne consapevole che per la classificazione degli elementi,
oltre che delle loro proprietà chimiche, della necessità di una variabile
quantitativa come il peso atomico. Nel marzo del 1869 trovò la soluzione
del problema sistemando gruppi di elementi con proprietà simili secondo
l’odine dei pesi atomici:
Ca = 40
Sr = 87.6
Ba = 137
Li = 7
Na = 23
K = 39
Rb = 85.4
Cs = 133
F = 19
Cl = 35.5
Br = 80
Te = 127
Gli elementi classificati secondo il valore dei loro pesi atomici presentavano un evidente periodicità di proprietà. Questo metodo permetteva di
riempire i posti rimasti vuoti con altri elementi ancora non scoperti e di
riclassificarne alcuni, per esempio: propose di cambiare il valore del peso
atomico del Berillio da 14 a 9.4 e di attribuire al suo ossido la formula
BeO per analogia con MgO invece di Be2O3 formula che era nata per
analogia con l’allumina Al2O3 determinando così il posto esatto del Be
nella tabella periodica degli elementi.
L’attribuzione a Mendeleev della tabella periodica non è stata fatta senza
contestazioni infatti J.L.Meyer aveva pubblicato una tabella per per
pesi atomici e valenze già nel 1864 ma non aveva valutato le contrarietà
per elementi con la stessa valenza.
-1833 M.Faraday enuncia le leggi dell’elettrolisi dove mette in evidenza
la stretta relazione per l’elettrolisi tra massa e quantità di carica. Nel 1838
esegue i primi esperimenti di scarica nei gas dove scopre per scariche con pressioni di aria <5mmHg la “Farady dark space” che si produce sul polo negativo,
e predice per le scariche nei gas un
futuro importante per lo studio
della filosofia della natura
3
dell’elettricità.
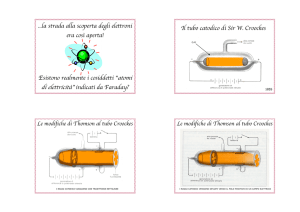
-1874 W.Crookes esperto nelle pompe da vuoto e nella soffiatura del vetro inizia a sperimentare con scariche nei gas. Dopo Farady le scariche nei gas
sono state studiate da J.Pluker,W.Hittorf,H:Gaissler e da E.Goldstein. Questi lavori sono la
base della moderna tecnologia delle lampade che noi chiamiamo al neon o allogene.
Crookes scoprì che se abbassava molto la pressione nel tubo di scarica la luminosità generale
si trasformava in un fascio ben definito che collegava il catodo con l’anodo. Questo fascio che
quando tocca il vetro produce una luce verdastra e stato chiamato “raggi catodici”. Qualunque
oggetto posto sul suo cammino produce una ombra netta ed è deviato dal
campo magnetico allo stesso di una corrente elettrica. Crookes non aveva nel-
l’ambiente scientifico una buona reputazione perchè credeva nell’occultismo e nello spiritismo
Va ricordato che il tubo di Crookes è stato utilizzato da Rongten per scoprire i raggi X.
Nello stesso anno J.Perrin scoprì che una lastra metallica interposta sul
cammino dei raggi catodici si elettrizzava negativamente.
Tutti i dati portavano a pensare al passaggio di particelle negative in un gas rarefatto. P.E.Lenard era contrario a questa ipotesi perche aveva visto che i raggi catodici ruiscivano ad attraversare alcuni schermi sottili, e deduceva che era costituito
da onde elettromagnetiche, stava diventando l’opinione prevalente. Il Council
for Science Progerss incarica J.J.Thompson di chiarire la natura dei raggi catodici.
-1897J.J.Thompson pubblica sul Philosophical Magazine On CathodeRays
la misura del rapporto e/m per i raggi catodici con un tubo di Crookes.
Deviando i raggi catodici con un campo elettrico (mv2/e) compensato da
un campo magnetico (mv/e). Vide che v dipendeva dalla differenza di
potenziale del tubo ed e/m era costantemente uguale a 5.28x1017ues/g.
4
Il tubo usato da Thompson è il primo acceleratore di particelle e cento anni
dopo lo abbiamo in tutte le case nei nostri video...........
Sebbene apparisse chiaro che e doveva avere lo stesso valore della carica elementare scoperta da Faraday nell’elettrolisi dei liquidi Thompson volle misurarla: a questo
scopo utilizzo una camera nebbia inventata
da C.T.R.Wilson poco prima. In una camera
satura di vapor d’acqua priva di polvere,
abassando rapidamente la pressione si forma
una goccia di acqua su ogni ione. Per piccole
espansioni le goccie condensano solo sulle
cariche negative, mentre per espansioni maggiori del 30% anche su quelle positive.
Thompson produsse con un tubo a raggi X
della ionizzazione in una camera di Wilson.
Raccolse le goccie in un piatto metallico collegato a un elettroscopio, avendo contato le
goccie precedentemente, con vari metodi.
Trovò e=4.77x10-10ues, uguale al valore della carica elementare che Faraday trovò nell’elettrolisi. Dal valore di e/m e da e ricavò m=9x10-28g per i raggi catodici, ben 1840 inferiore alla massa dell’idrogeno. Grande scoperta: Thompson aveva trovato una particella ~2000 volte più leggera del atomo di
idrogeno e con carica negativa che chiamò elettrone. Thompson concluse
che nelle celle elettrolitiche venivano trasportati atomi carichi positivamente ed i
raggi catodici erano costituite da particelle leggere negative, gli elettroni.
Thompson a questo punto, comprende che gli atomi non sono le particelle
più piccole della materia, ma anche che gli stessi atomi hanno una struttura
fatta di particelle positive pesanti e di elettroni negativi molto più leggeri.
Propose un modello statico dell’atomo costituito da una miscela di cariche
positive e negative in equilibrio statico dovuto alle forze atrattive e
repulsive elettriche. Furono fatti molti complicati calcoli nel tentativo di
5
correlare le frequenze delle vibrazioni elettroniche con
le righe spettrali caratteristiche degli spetti di emissione di ogni atomo, ma
non fu trovata nessuna correlazione.
Nel 1907 J.J.Thompson, studiò
N
con un suo tubo invertendo le
polartà i raggi che dall’anodo
vanno verso il catodo.
Questi sono chiamati Raggi
S
Canale perchè il catodo aveva dei buchi
(canali) per far passare i raggi analizzati poi con un campo elettrico E
(e/mv2) e un campo magnetico B (e/mv) paralleli. Ovviamente trovò che
i raggi erano fatti di atomi positivi e per ogni elemento si aspettava
variando i campi E e B una parabola sullo schermo fluorescente C.
Thompson osservò le parabole ma invece di una per ogni elemento ne trovò varie. Nel caso del Cloro ne trovò una che corrispondeva 34.98 ed un
altra a 35.98. Le percentuali di atomi di cloro con diversi pesi atomici
(calcolate dall’annerimento relativo ad una lastra fotografica risultarono
essere il 75.4% e 24.6% e dava per il cloro un peso atomico medio di
35.457. Il problema sollevato da Prout cento anni prima cominciava a
risolversi. Gli stessi atomi di uno stesso elemento con diversi pesi atomici furono chiamati Isotopi, avevano evidentemente le stesso proprietà
Chimiche ed occupavano lo stesso posto nella tabella di Mendeleev.
Sucessivamente, sempre nel laboratorio di Thompson a Cambridge,
F.W.Aston mise in evidenza il fenomeno per molti altri elementi chimici
per esempio il Cadmio è composto da ben 8 isotopi.
-1896 H.Becquerel, conservatore come suo padre e suo nonno di un museo delle pietre
luminescenti a Parigi si entusimò della scoperta dei raggi X e volle provare de venivano emessi dalle sue pietre. Espose al sole del un minerale chiamato uranile (solfato doppio di uranio
e potassio), e trovo che la lastra fotografica ben coperta dal sole mostrava una macchia di radiazione corrispondente al minerale. In un periodo senza sole depose casualmente, un pezzo
di uranile sopra una chiave ed una lastra fotografica ben incartata in un cassetto. Espose poi il
minerale al sole e finalmente sviluppò la lastra e trovò la macchia del minerale con dentro la
forma della chiave. Immediatamente comprese che il minerale da solo emana6
va una radiazione nuova più penetrante dei raggi X e che nulla
aveva a che fare con la luninescenza, era la Radioattività.
Immediatamente molti scienziati si dedicarono a studiare la radioattività
Marie Sklodowska Curie separò chimicamente gli elementi dell’uranile
ed ha scoperto che l’uranio metallico era 5 volte meno attivo del uranile.
Qundi cercò qualche altra sostanza che giustificasse il fatto così scopri
un altra sostanza attiva con proprità simili al Bismuto che chiamò Polonio, ed un altra simile al Bario ~ 2x106 di volte più attiva dell’Uranio, il
Radio. Molte altre sostanze radioattive sono state scoperte in seguito
O.Hann nel 1938 ha scoperto la fissione del uranio che con la scoperta di
E.Fermi della attivazione con neutroni lenti portò all’energia nucleare ed
alle bombe atomiche. L’attivazione con protoni accelerati produsse molti
isotopi radioattivi artificiali attualmente molto usati un diagnostica (scintigrafie, PET positron emissiom tomography) ed in terapia dei tumori come
nel caso delle bombe al cobalto che sono sostanzialmente formate da
grandi quantità di 60Co che emette raggi gamma. Per questo tipo di cure
attulmente sono usati anche elettroni accelerati e protoni e ioni accelerati
per esempio nella cosidetta terapia adronica. Questi metodi sono 7
superiori alla cura con 60Co perchè rilasciano meno radiazione nei
tessuti sani.
-1899 E.Rutherford, neozelandese che andò a
Cambridge a studiare con J.J.Thompson, a 28 anni
scoprì l’esistenza di tre tipi di radiazione:
-Alfa, ioni positivi di Elio, si arresta facilmente
con un foglio di carta.
-Beta, elettroni molto veloci, attraversano spessori
di alluminio anche di 3mm.
-Gamma, radiazione elettromagnetica con lunghezza d’onda molto più corta dei raggi X, capace di
attraversare schermi di Piombo di alcuni cm.
La radioattività produce danni biologici dato che ionizza gli atomi
producendo radicali chimici liberi che ricombinandosi possono produrre mutazioni genetiche.
Sucessivamente Rutherford ed il suo allievo F.Soddy scoprirono che la
radioattività era il risultato di una trsformazione spontanea di un elemento
in un altro. ( Ci si avvicinava alla pietra filosofale degli alchimisti?)
DECADIMENTI DALL’URANIO AL PIOMBO
attraverso i decadimenti alfa e beta
Sono dati numero e peso atomico, il simbolo
dell’elemento e la vita media
VITA MEDIA
N=N0e-λt
8
Alcuni esperimenti fatti, da Thomoson, Lenard ed altri, con urti di elettroni su materiali confermarono il modello dell’atomo di Thompson.
Rutherford a seguito di una disputa sulla natura dei raggi alfa con Becquerel, dove si erano manifestati urti a grandi angoli di alfa, che passavano in
aria, propone un esperimento, eseguito nel suo Laboratorio di Manchester,
da H.Geiger e E.Marsden sull’urto di particelle pesanti come le alfa su
foglietti molto sottili di Oro. Verificarono che 1/8000 le alfa era respinte
a 1800 e la distribuzione angolare delle alfa dopo l’urto era incompatibile
con urti multipli come prevedeva il modello di Thompson. L’esperimento
dava evidenza di urti singoli e forti secondo la formula sviluppata dal matematico R.H.Fowler. Rutherfor nel 1911 pubblica sul Ph, M. un saggio:
The scattering of alfa and beta particles by matter and the stucture of the atom.
La massa dell’atomo era concentrata in un raggio 10-5 volte più piccolo
del raggio dell’atomo cioè 10-12cm. Gli elettroni negativi simili a pianeti
ruotavano intorno al nucleo positivo. Questo modello spiegava l’urto di
particelle pesanti come le alfa e gli urti multipli degli elettroni sulla nuvola
elettronica. Questo modello ( già proposto da J.Perrin nel 1901) che rispondeva
bene ai risultati sugli urti, poneva grossi problemi:
- Come stavano insieme i nuclei fatti di particelle positive? Era necessaria una nuova forza che contrastasse e superasse quella di Coulamb.
9
- Come facevano gli elettroni a ruotare intorno ai nuclei senza
irraggiare e poi cadere sui nuclei stessi?
LUCE E RADIAZIONE EMESSE DALLA MATERIA
Si è sempre saputo che la materia preventivamente riscaldata emette radiazione luminosa e calorica. Gli studiosi del 700 sapevano che aria rarefatta eccitata dall’elettricità produceva luci colorate. Risultati simili si
ottenevano anche evaporando sostanze alla fiamma. La luce analizzata
con un prisma, eccitando liquidi e solidi, mostrava spettri piuttosto continui, mentre i gas presentavano spettri parziali che li caratterizzavavo.
~1802 W.Wollaston riprese l’esperimento di Newton sullo spettro della luce solare
ma con un prisma più sensibile e trovò che allo spettro continuo newtoniano,
quando la fessura della finestra era sufficientemente stretta, si sovrapponevano sette righe scure. Questa osservazione rimase senza spiegazioni.
J.vonFraunhofer un costruttore di strumenti ottici di Monaco di Baviera, pochi
anni dopo riprese lo studio di Wollaston, con strumentazione molto
sensibile, egli individuò nella luce solare una serie di ben 700 righe
scure, determinò per alcune di esse la lunghezza d’onda corrispondente
designando le righe principali a partire dal rosso con lettere dell’alfabeto
da A sino ad H.
Estese poi l’analisi spettroscopica ad altri corpi celesti, verificando che
gli spettri aveno un certo ordine interno.
Suggerì l’idea che la luce del Sole e delle altre stelle era assorbita in
corrispondenza delle righe scure, di sostanze specifiche. Questa idea ha
aperto la porta all’Astrofisica con sviluppi spettacolari e sorprendenti.
Per migliorare le sue misure Fraunhofer introdusse il reticolo difrattivo il
primo costruito con fili d’Argento su supporti, e poi incidendolo su vetri.
-1823 J.Herschel propose che lo studio delle righe scure dello spettro
stellare potesse essere utilizzato per determinare la presenza di elementi
chimici negli astri. All’epoca alcuni filosofi pensavano che era
totalmente inutile pensare a composizioni chimiche delle
10
stelle perchè mai si sarebbero potuto verificare.
-1854 R.Bunsen e G.R.Kirchhoff intrapresero uno studio sistematico dei
colori alla fiamma di vari elementi e scoprirono che ogni elemento ha
righe di emissione a diversi colori caratteristiche di ogni elemento. Anche poche righe spettrali sono sufficienti per rivelare la presenza di un
elemento. Con un buon spettroscopio coprirono così nuovi elementi alcalini come il Cesio (1860) ed il Rubidio (1861). Diedero anche le basi teoriche per
spiegare l’emissione e l’assorbimento della luce ed avviarono ed inizia-
rono, su basi solide lo studio della composizione del Sole.
Spettri atomici
Spettro dell’idrogeno
Spettro di assorbimento dell’idrogeno
Spettro solare
11
-1995 P.Zeeman fisico olandese, che lavorava nel famoso laboratorio di
H.Kamerling Omnes famoso perchè per primo raggiunse temperature vicine
allo zero assoluto scoprendo la superfluidità dell’elio ed anche la superconduttività di alcuni metalli, aproffittando del assenza per una vacanza di Omnes,
che lo obbligava a studiare solo sistemi criogenici, compì ricerche
sull’influenza del campo magnetico sulle righe spettrali. Scoprì così
l’allargamento della riga D (gialla) del sodio che ben presto si rivelò come una scissione della riga in un gruppo di tre righe. Questo effetto è
denominato Effetto Zeeman.
Successivamente l’effetto Zeeman fu inerpretato da Lorentz come la
presenza di cariche elettriche rotanti dentro al nucleo con orbite che
venivano modificate dal campo magnetico. In base a questa ipotesi
calcolò il rapporto e/m che era uguale a quello trovato da Thompson per
i raggi catodici quindi si poteva dedurre che gli elettroni erano presenti
all’interno dell’atomo con le stesse caratteristiche dei raggi catodici.
-1916 ESPERIMENTO DI STEWART E TOLMEN
Per comprendere la natura dei portatori di carica delle
correnti eletriche omiche eseguirono un esperimento con
una bobina mobile fatta velocemente ruotare con velocità
. Dopo in certo tempo anche le cariche che trasportano
la carica si metteranno a ruotare, si blocca con un freno
la rotazione e se le cariche hanno massa per inerzia si
muoveranno nel filo dando luogo al movimento istantaneo di una carica
dq che misurata con un galvanometro balistico permentte di risalire al
rapporto e/m dei portatori di carica nei conduttori.
F = eE in dt l'impulso di F è uguale a mdv
mdv = Fdt = eEdt = e(ΔV/l)dt = e(Ri/l)dt = (eR/l)dq
∫vmdv = eR/l ∫ dq
mv = eRq/l
e/m = lv/Rq
e/m = -1.6x10-11C/g
qe = 1.6x10-19C m =10-27g = me
GLI ELETTRONI SONO I PORTATORI
DI CARICA NEI CONDUTTORI
12
L’indagine su emissione ed assorbimento di luce implicava questioni
generali sulla radiazione. Kirchhoff formula questa legge:
Ima LEGGE DI KIRCHHOFF:
In un sistema isolato, un corpo rinchiuso
dentro un altro, dopo un certo tempo, raggiunge la temperatura dell’involucro, anche
se sono legati solo il vuoto più spinto.
T0 T1
t
T0
T1
T0 T1
Kirchhoff suggerì che in una cavità a temperatura T, riempita con radiazione luminosa di una certa lunghezza d’onda , nell’ipotesi che si raggiunga l’equilibrio tra emissione ed assorbimento si poteva studiare l’emissione di radiazione tra
e d di un elemento di superficie. Si trattava
di trovare una funzione W ( , T ) che esprima il rapporto tra energia emessa e ed energia assorbita a alla
temperatura T: e / a W ( , T )
IIda LEGGE DI KIRKHHOFF:
Il rapporto tra il potere emittente ed il potere assorbente è identico
per tutte le superfici alla stessa temperatura, all’equilibrio.
Il caso è particolarmente interessante quando a 1 , quindi quando c’è
assorbimento totale. La cavità di questo tipo sono
chiamate cavità di corpo nero. Quale forma a W?
e W ( , T )
13
W
Per rispondere a questa domanda furono fatte molte
misure da molti studiosi: J.J.H.Muller, L.Nobili,
M.Melloni e J.Tindall e successivamente con
metodi più precisi, introdotti da A.Rowland che
usava un reticolo sviluppato da J.A.Anstrom,
A.P.P.Crova e S.P.Langley mostrarono
che la funzione K era assimmetrica e
nel 1899 E.Prinsgsheim e Lammer diedero gli spettri finali.
La linea tratteggiata rappresenta la leggedi W. Wien che da
ragione dello spostamento del massimo di emmissione in funzione
di λ con la temperatura
λ maxT = 2.8971
T
λ max
Negli ultimi 20 anni dell’800 molti fisici come Wien,
Thiesen, Jens, Lord Rayley ed altri, cercarono senza
riuscirci di interpretare i risultati sperimentali.
I tentativi furono numerosi ma nessuno si avvicinò
alla soluzione del problema.
Infatti il problema del corpo nero come quello della
emissione delle righe spettrali comportava un tipo di
fisica fino ad allora completamente sconosciuta la
Meccanica Quantistica.
-1905 A.Einstein pubblica il suo terzo articolo, questa volta suggerisce di
utilizzare il moto Browniano per determinare la dimensione degli atomi,
e fa il calcolo per determinare il N0 di Avogadro misurando il libero cammino medio nel moto Browniano. Il risultato dell’esperimento fu pubblicato da J.Perrin nel 1916. Coincideva perfettamente con il N0 di Avogadro calcolato con le leggi di Faraday dell’elettrolisi e la carica dell’elet14
trone misurata da Thompson. Dopo questo risultato nessuno
dubitò più della natura atomica della materia.
DEDUZIONI DI LORD RAYLEIGH E SIR JAMES JEANS
Nm
Con il principio di equipartizione
dell’energia dedotto dalla meccanica
Newtoniana, Maxwell dedusse le distribuzioni delle velocità delle molecole nei gas (teoria cinetica dei gas).
Rayleigh e Jeans osservarono che lo
spettro del corpo nero in funzione delle frequenze assomigliava molto allo
spettro delle velocità delle molecole della teoria cinetica dei gas. Questa osservazione gli indusse ad applicare alla radiazione termica lo
stesso principio di equipartizione
che tanto successo aveva avuto con
i gas. Proposero cioè che l’energia
raggiante totale sia ugualmente distribuita fra tutte le possibili frequenze di vibrazione e dedussero:
Wbb = 8πν2kT/c3
Prevede che ad alte frequenza ci sia una
grande emissione, fatto non vero e assurdo per cui nasce un grave problema, vale
a dire, la natura in questo caso non
rispetta il principio di equipartizione dell’energia.
(In
un recipiente per quanto grande il numero di molecole è sempre
finito mentre in una cavità radiante le frequenze sono infinite)
15
A.Einstein
W. Wien
MAX PLANK E IL QUANTO DI ENERGIA
1900-Max Plank si limitò inizialmente a trovare una formula empirica
che fosse in accordo con le misure sperimentali del Wbb :
8h
1
Wbb
3
h / kT
c e
1
3
In seguito dedusse, con grande difficoltà, la formula dal elettromagnetismo sostituendo gli integrale con delle serie e ponendo la condizione
che l’energia delle onde elettromagnetiche può esistere soltanto sotto
forma di pacchetti discreti, o quanti, essendo il contenuto di energia di
ogni quanto proporzionale alla frequenza corrispondente.
n numero intero
h costante di Plank
ν frequenza
E nh
SIGNIFICA CHE L’ENERGIA È QUANTIZZATA
Fu una vera rivoluzione, da qui inizia la meccanica quantistica
LEGGE DI STEFAN BOLTZMANN
Il massimo dello spettro del corpo nero:
Wbb = σT4
Trovata da Stefen e dedotta da Boltzmann dalla formula di Plank
16
EFFETTO FOTOELETTRICO
Un metallo illuminato da raggi UV
emette elettroni:
-esiste una soglia in frequenza
- il numero di elettroni dipende dalla
intensità della radiazione
-l’energia degli elettroni dipende da ν
- il processo è molto rapido < 10-9sec
Con la teoria classica il fenomeno non
si spiega, per esempio l’energia degli
elettroni dovrebbe dipendere dall’intensità della radiazione e non da ν.
1905 Einstein con l’ipotesi di Plank
E=hν spiega il fenomeno con il fatto
che quando l’elettrone è colpito da un
quanto di radiazione acquista tutta
l’energia del quanto o non acquista
nulla mv2max/2 = hν - Φ
dove Φ lavoro di estrazione. 17
CONFERMA LA QUANTIZZAZIONE DELL’ENERGIA
QUANTIZZAZIONE DELLA CARICA ELETTRICA
-1909 fino al 1917 R.A.Millikan esegue una serie di esperimenti
E
qE Fe
mg Fg
goccioline di olio
elettrizzate cadono
dentro un campo E
m?
per tensione superf. sfera raggio r
F 6rv
legge di Stokes
4 3
Fg mg vol.dens. g r g
3
peso+attrito
velocitá costante
con
E=0 si misura v m
4 3
Fg F r g 6rv
3
con E0 qE=mg
q=mg/E
si cambia la carica irradiando con una sorgente radioattiva
q1, q2 , q3 , q4 ,...........qi
qi ni e
La carica elettrica è quantizzata e la carica dell’elettrone è
la carica minima.
18
-1919 E.Rutherford seguendo un lavoro del suo allievo Marsden, che
mostrava che in urti di particelle alfa con gas molto rarefatto di Idrogeno,
mentre tutte le alfa si fermavano dopo un certo percorso, in questo caso
qualche particella andava oltre. Fino ad allora i nuclei si erano manifesti
interi o come radiazione alfa, cioè solo i nuclei di Elio. Rutherford si convinse che le particelle viste da Marsden fossero nuclei di Idrogeno urtati
dalle alfa. Fece una serie di esperimenti con particelle alfa che urtavano
gas rarefatti di elementi leggeri come Litio, Berilio, Boro e Fluoro. In tutti questi casi trovò particelle che percorrevano distanze maggiori delle
alfa e quindi più leggere e cariche positivamente e simili a i nuclei di
idrogeno del esperimento di Marsden. Chiamò questa particella Protone
e si comprese che dentro ai nuclei esistevano i protoni.
Il nucleo costituito di soli protoni non era credibile per via dell’esistenza
degli isotpi. Si pensò alla presenza di un certo numero di elettroni nel nucleo, una riedizione in piccolo del atomo di Thompson. Ma era noto che
per ragioni quantistiche gli elettroni confinati nelle dimensioni di un nucleo dovevano avere energie dell’ordine del miliardo di eV e non sembrava ragionevole. Nel 1920 Rutherford propose l’esistenza di una particella neutra con massa simile al protone. Al laboratorio Cavendish di Cambridge organizzarono la caccia a queste particelle. Per anni non trovarono
nulla, ma finalmente:
-1932 J.Chadwich sempre al Cavendish bombardando con delle alfa del
berilio trovò una radiazione molto penetrante neutra con massa simile al
protone che fu chiamata Neutrone. Finalmente tutti gli attori arano nella
commedia si poteva pensare per esempio alle alfa (nuclei di elio) costituite da 2protoni e due neutroni, il carbonio di massa 12 costituito ma con
solo 6 elettroni, costituito da 6 protoni e 6 neutroni ecc. ecc.
In questo modo ebbe inizio la fisica Nucleare che portò alla comprensione del funzionamento delle stelle, dei reattori nucleari, della bomba atomica, e delle applicazioni mediche come l’NMR e la medicina nucleare.
19
-1923 A.H.Compton pubblicava sul Physical Review A quantum theory
of scattering of X-rays by light elements, dove dava i risultati di urti di
raggi X su elettroni orbitanti in elementi leggeri.
Faceva osservare che la teoria classica prevedeva che i raggi X interagivano con l’intera nuvola elettronica mentre la teoria quantica ogni X utrava
un elettrone che rinculava singolarmente e risultava dopo l’urto una radiazione X con una lunghezza d’onda inferiore al incidente e legata all’angolo di emissione dalla relazione:
0 0 (2h / mc) sin 2 / 2
che era in perfetto accordo con i dati sperimentali. Con questo esperimento che confermava i risultati dell’effetto foteletrico si era accertata in
modo definitivo la doppia natura delle onde elettromagnetiche 20
come corpuscoli ed onde.