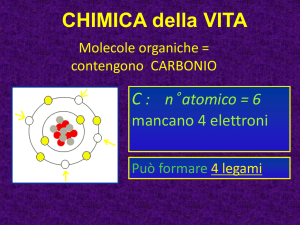
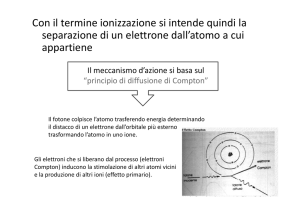
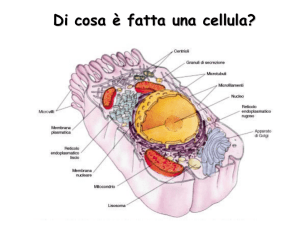
Lezione 2
Molecole biologiche nella cellula
1
Le sostanze presenti nei viventi
Gli esseri viventi terrestri sono costituiti da sostanze
chimiche basate sul carbonio
I composti organici sono costituiti da uno scheletro di
atomi di carbonio e idrogeno che può legare altri
atomi: ossigeno, azoto, zolfo, fosforo
La maggior parte dei composti organici degli
organismi è rappresentata da macromolecole
(polimeri) prodotte attraverso l’unione con legami
covalenti di molecole più piccole (monomeri)
2
Molecole biologiche
I quattro tipi di grandi molecole che
contraddistinguono i viventi sono le proteine, i
lipidi, i carboidrati e gli acidi nucleici.
La maggior parte di queste molecole biologiche
sono
polimeri,
costituiti
da
subunità
monomeriche unite tra loro; polimeri molto
grandi sono chiamati macromolecole
3
Le sostanze presenti nei viventi
H2O
(50-90%)
4
Savada D et al., Elementi di biologia e genetica
I polimeri
Le macromolecole di carboidrati, proteine e acidi
nucleici sono molecole a lunga catena (polimeri)
costituite da numerose subunità (monomeri)
identiche o simili unite da legami covalenti
5
Sintesi dei polimeri
Reazione di condensazione: il legame fra i vari
monomeri avviene mediante una reazione in cui si ha la
perdita di una molecola di H2O. Ogni volta che si forma
un legame uno dei monomeri perde un gruppo ossidrile,
l’altro un atomo di idrogeno
Reazione catalizzata da
polimerasi
6
Degradazione dei polimeri
Reazione di idrolisi: rottura dei legami covalenti tra
monomeri per aggiunta di una molecola di H2O. Un
atomo di idrogeno dell’acqua attacca un monomero e il
gruppo ossidrile lega il monomero adiacente
H2O
Reazione catalizzata
da idrolasi
7
CARBOIDRATI
Molecole che contengono atomi di carbonio
affiancati da atomi di idrogeno e gruppi
ossidrilici (H-C-OH)n
(C:H:O = 1:2:1)
8
Carboidrati funzione
*
*
*
*
Fonte di energia (es. glucosio, polisaccaridi di
deposito)
Fonte di atomi di C per la biosintesi di
molecole organiche (aa, acidi grassi)
Funzione strutturale (cellulosa, chitina)
Legati a proteine o lipidi costituiscono
antigeni di superficie (sostanze in grado di
essere riconosciute dal sistema immunitario)
9
Monosaccaridi 1
Zuccheri semplici che contengono generalmente da
tre (triosi) a sette (eptosi) atomi di carbonio
Classificati in base al numero degli atomi di C e alla
presenza di un gruppo chetonico o aldeidico
Esoso
aldoso
C6H12O6
isomeri
10
Esoso
chetoso
Monosaccaridi 2
In soluzione acquosa le molecole di molti
monosaccaridi (C>4) assumono una struttura ad anello.
La forma ciclica è la più stabile in condizioni
fisiologiche.
Reazione tra gruppo aldeidico
sul C1 e gruppo ossidrilico sul
C5 del glucosio
11
Monosaccaridi 3
Due pentosi (ribosio e desossiribosio) hanno particolare
importanza biologica, in quanto costituiscono parte
dello scheletro dell’ RNA e del DNA
12
Disaccaridi
Costituiti dall’unione di due monosaccaridi
attraverso un legame covalente glicosidico
glucosio
lattasi
13
fruttosio
Lattasi e intolleranza al lattosio 1
La lattasi ha localizzazione intestinale (tenue).
La diminuzione nella produzione di questo
enzima (in alcuni individui adulti) è legata
all’intolleranza al lattosio.
lattasi
14
Lattasi e intolleranza al lattosio 2
*
In tutte le specie di mammiferi, i geni per la digestione del latte
vengono silenziati subito dopo lo svezzamento (lattasi non più
necessaria ed è costoso produrla).
*
Una parte della popolazione umana attuale è in grado di digerire
questo alimento anche in età adulta.
Distribuzione mondiale dell’intolleranza al lattosio
15
Lattasi e intolleranza al lattosio 3
.
*
C.a. 10 000 anni fa viene introdotta la pastorizia e inizialmente si
utilizzava solo di latte fermentato che ha minore contenuto di
lattosio (a quell’epoca tutti gli adulti di h. sapiens erano intolleranti)
*
Una mutazione casuale insorta c.a. 7500 anni fa in Europa centrale
ha consentito la persistenza della lattasi negli adulti
*
Una mutazione indipendente (ma con uguale effetto sul fenotipo) è
insorta nelle popolazioni africane nello stesso periodo
*
Dopo la comparsa di mutazioni il latte diventa alimento anche per
gli adulti; i portatori hanno un vantaggio selettivo (fonte di energia,
calcio, vit D, H2O); aumenta la frequenza del carattere “persistenza
dell’enzima” nella popolazione (35% attualmente)
16
Ötzi, la mummia del Similaun,
intollerante al lattosio
5000 anni fa
Gruppo sanguigno 0, probabili occhi marroni
Predisposizione genetica a malattie coronariche
Infettato da Borrelia burgdorferi
Polisaccaridi
Macromolecole lineari o ramificate formate dalla
polimerizzazione di monosaccaridi uniti da legami
glicosidici (amido, glicogeno, cellulosa, chitina)
Amilosio, amilopectina, glicogeno, cellulosa: polimeri del glucosio. Cambia il tipo di legame tra i
19
monomeri e il grado di ramificazione.
Polisaccaridi strutturali
Chitina:
polimero di N-acetilglucosammina
esoscheletro artropodi
parete cellulare di funghi e batteri
Cellulosa:
polimero del glucosio
pareti cellule vegetali
degradata (cellulasi) da alcuni batteri,
funghi e protozoi
20
Erbivori che “digeriscono” la cellulosa 1
Ruminanti:
microrganismi simbionti nello stomaco che digeriscono la cellulosa.
Lo stomaco è diviso in quattro parti: rumine, reticolo, omaso e
abomaso. I vegetali grossolanamente masticati scendono nel rumine,
dove i microrganismi simbionti demoliscono la cellulosa.
Successivamente, l’impasto vegetale viene rigurgitato in bocca,
rimasticato e nuovamente inghiottito. Questa volta, però, il cibo passa
nelle altre tre camere, dove viene ulteriormente demolito, e da qui
nell’intestino dove il glucosio proveniente dalla digestione della
cellulosa viene assorbito.
Erbivori che “digeriscono” la cellulosa 2
Conigli e roditori: batteri simbionti nell’intestino cieco.
Topi e conigli ingeriscono le proprie feci, in cui sono contenuti i
prodotti di digestione della cellulosa per assorbirli a livello
intestinale a un secondo passaggio, evitando perdita di nutrienti
inizialmente eliminati.
Batteri simbionti
Assorbimento
nutrienti
22
⃰
⃰
⃰
Insetti che “digeriscono” il polistirolo
Le larve del coleottero Tenebrio molitor, o tarma della farina,
possono sopravvivere nutrendosi di polistirolo.
Per questa capacità di metabolizzare la plastica pare siano
responsabili particolari batteri che vivono nel loro apparato
digerente.
Se si riuscisse a produrre su vasta scala gli enzimi digestivi di
questi batteri si potrebbero utilizzare per lo smaltimento dei
23
rifiuti.
Polisaccaridi di riserva
*
*
*
Il glucosio è lo zucchero direttamente ossidato
per liberare energia
Il glicogeno e l’amido sono polimeri del
glucosio (G)n, dove n può raggiungere le
centinaia di unità
Perché il G deve essere immagazzinato nelle
cellule come polimero? Perché la cellula non
accumula il glucosio monomero?
24
Osmosi 1
L’osmosi è quel fenomeno per cui si assiste
al movimento di acqua da una soluzione
meno concentrata a una soluzione più
concentrata,
attraverso
una
membrana
semipermeabile.
Membrana
semipermeabile
permette
il
passaggio del solvente (acqua) ma non di
determinati soluti (es. zuccheri)
25
H2O
Osmosi 2
Le membrane cellulari sono semipermeabili
Cellula che
accumulasse
G monomero
rischierebbe
di scoppiare
26
Osmosi 3
La pressione osmotica dipende dal numero di molecole in soluzione, non dalle
loro dimensioni, quindi 100 molecole di G esercitano una pressione osmotica 100
volte superiore a una singola molecola di glicogeno formata da 100 molecole di
glucosio.
Abbassando il n° netto di molecole (da G a glicogeno) diminuisce la pressione
osmotica nella cellula.
glucosio
ambiente extracellulare
glicogeno/amido
cellula
Con la polimerizzazione il numero di molecole all’interno della cellula viene riportato
uguale a quello dell’ambiente extracellulare
LIPIDI
*
*
*
*
*
Idrocarburi insolubili in acqua a causa dei loro
numerosi legami covalenti apolari
Non costituiscono polimeri
Grassi e oli (grassi neutri/gliceridi): deposito
energetico
Fosfolipidi: funzione strutturale
nelle
membrane biologiche
Steroidi: funzione di regolazione, strutturale,
digestiva
28
Trigliceridi
*
*
Costituiti da una molecola di glicerolo (alcol a
tre atomi di carbonio) unita a tre molecole di
acido grasso
I trigliceridi sono i gliceridi più comunemente
presenti in grassi animali e vegetali
29
Acidi grassi 1
L’acido grasso è costituito da una lunga
catena idrocarburica non ramificata alla
cui estremità si trova un gruppo
carbossilico (-COOH).
Acidi grassi saturi: tutti i legami sono
saturati da atomi di H. Le molecole
risultano rigide e si impacchettano tra di
loro. I grassi ricchi di ac. grassi saturi
tendono ad essere solidi a temperatura
ambiente
polare
30
apolare
Acidi grassi 2
Acidi grassi insaturi: la catena
idrocarburica contiene uno o più
doppi legami che introducono delle
“pieghe” nella molecola. Le pieghe
impediscono alle molecole dei grassi
insaturi di allinearsi con le molecole
adiacenti. I lipidi contenenti ac.
grassi insaturi tendono ad essere
fluidi a temperatura ambiente (oli)
Riserve energetiche
*
*
*
I grassi costituiscono una forma di riserva
energetica concentrata: a parità di peso producono
una quantità di energia più che doppia rispetto a
quella contenuta nell’amido
Le piante essendo immobili possono permettersi di
accumulare pesanti riserve energetiche sotto forma
di amido
Per gli animali, che devono portare sempre con sé i
propri depositi di energia, risulta vantaggioso che
tali depositi siano concentrati; le riserve
energetiche a lungo termine vengono depositate
sotto forma di lipidi nelle cellule adipose
Riserve energetiche: glicogeno
*
Le riserve di glicogeno degli animali servono solo per le
“emergenze”
*
Le riserve muscolari sono quasi doppie rispetto a quelle del
fegato, ma in entrambi i casi sono a breve termine: subiscono
drastiche riduzioni in caso di esercizio fisico o di digiuno
*
Il glicogeno muscolare serve come fonte di energia del
lavoro meccanico, quello epatico a regolare la glicemia
*
Il grosso delle riserve energetiche (in termini di Kcal quasi
200 volte in più) è costituito dai lipidi
33
Fosfolipidi 1
Formati da una molecola di glicerolo esterificata da
due acidi grassi e legata a un fosfato che a sua volta
lega un gruppo organico generalmente azotato.
Sono molecole anfipatiche
Carica elettrica
negativa
34
Fosfolipidi 2
In presenza di acqua le estremità polari idrofile si
dispongono verso l’ambiente acquoso, mentre le code
apolari idrofobe si orientano in direzione opposta
35
35
Membrana cellulare
Le membrane sono formate da un doppio strato di
fosfolipidi
36
36
Steroidi
Composti organici che contengono tre anelli di
cicloesano (A, B, C) e un anello di ciclopentano (D)
37
37
Steroidi: funzioni
Costituenti delle membrane biologiche (colesterolo regola la fluidità della membrana)
Ormoni (sessuali, surrenalici)
Funzione digestiva (sali biliari)
38
PROTEINE
*
*
Singolo polimero non ramificato di aminoacidi
(catena polipeptidica) che si ripiega in una specifica
struttura tridimensionale
Aminoacidi: molecole organiche che recano sia il
gruppo aminico (-NH2) che quello carbossilico
(-COOH)
Carbonio
R: gruppo laterale differisce in
ciascuno dei 20 aa
39
Aminoacidi
I 20 amminoacidi possono essere divisi in gruppi a seconda della carica e
della polarità delle loro catene laterali:
Catene laterali neutre apolari
Catene laterali neutre polari
Catene laterali cariche acide
Catene laterali cariche basiche
40
Legame peptidico
Gli aminoacidi si uniscono tra loro mediante un legame
covalente che si forma tra il carbonio del gruppo
carbossilico di un aa e l’azoto del gruppo aminico
dell’aa adiacente
41
Struttura primaria
La sequenza aminoacidica della catena polipeptidica
costituisce la struttura primaria di una proteina
42
Polipeptidi
Numero teorico di polipeptidi diversi:
20n (20 numero di aa diversi, n lunghezza del
polipeptide)
20 2 (400) dipeptidi diversi
20 3 (8000) tripeptidi diversi
…..
Lunghezza delle proteine negli eucarioti:
minima 110 aa (insulina umana)
media c.a. 360 aa
massima 27.000 aa (Titine)
43
Struttura secondaria 1
Segmenti di catena polipeptidica avvolti o
ripiegati in modo ripetitivo a formare strutture
che contribuiscono alla forma complessiva della
proteina. Queste configurazioni sono determinate
dalla formazione di numerosi legami a idrogeno
tra gli aminoacidi che costituiscono la struttura
primaria.
44
Struttura secondaria 2
elica: è comune nelle proteine
strutturali fibrose (cheratine) per quasi
tutta la lunghezza del polipeptide.
*
Legami H tra l’ossigeno di un gruppo
C=O e il gruppo N-H nel giro
successivo dell’elica, a 4 aa di
distanza.
45
Struttura secondaria 3
sheet: due o più regioni di una singola catena polipeptidica tra
loro parallele vengono a formare una struttura planare attraverso
la formazione di legami idrogeno
Legami H tra gruppi NH su un
segmento della catena e i gruppi
C=O sull’altro segmento
46
La presenza di numerosissimi legami idrogeno nei foglietti beta della seta
del ragno rende ogni fibra della seta più resistente di un filo d’acciaio dello
stesso peso (nonostante il legame H a livello molecolare sia da 100 a 1000
volte più debole del legame metallico)
47
47
GFP
myoglobin
eliche
Foglietti
Aequorea victoria
48
48
Struttura terziaria
Le interazioni tra i gruppi R delle catene laterali
degli aminoacidi determinano la formazione di
ripiegamenti che portano alla formazione di una
struttura tridimensionale definita (struttura terziaria)
49
Interazioni deboli con un grande
effetto
Le interazioni di van der Waals tra le molecole presenti all’apice delle setole
sulle dita e quelle della superficie del muro sono così numerose che, sebbene
prese individualmente siano estremamente deboli, nel loro complesso sono
sufficienti a sostenere il peso del geko 50
Struttura della cheratina
cheratina è una proteina fibrosa.
Nell'uomo
è
il
principale
costituente di capelli, peli e unghie,
nei mammiferi di peli, artigli e
zoccoli. È costituita da alfa eliche
destrorse avvolte a due a due a
formare dimero. A loro volta i
dimeri si associano attraverso la
formazione di ponti disolfuro a
formare
protofilamenti,
poi
filamenti…
51
Ponte disolfuro
legame covalente che stabilizza la
struttura terziaria della proteina e che si
origina per ossidazione di due gruppi SH,
ciascuno appartenente a una cisteina
H
ossidazione
H
dimero
52
dimero
Permanente
B
Fase 1: trattamento con agente
riducente (rottura dei ponti disolfuro)
Fase 2: capelli arrotolati su supporto
(stiramento delle fibre e slittamento)
Fase 3: trattamento con agenti ossidanti
(si riformano i ponti disolfuro in posizione
slittata che esercitano una torsione delle
fibre)
Struttura quaternaria
Successivo livello di organizzazione: complesso di subunità
proteine sono costituite dall’aggregazione di più catene
polipeptidiche (subunità) L'emoglobina è una proteina globulare la cui
struttura quaternaria è costituita da quattro
sub-unità.
L’ emoglobina lega l'ossigeno durante il
passaggio del sangue nei polmoni, e lo cede
successivamente ai tessuti.
L'emoglobina è necessaria, nonostante
l'ossigeno si sciolga nell'acqua, perché la
quantità normalmente solubilizzata sarebbe
troppo bassa per le esigenze metaboliche di un
animale di dimensioni superiori a 1 mm.
54
Hb adattate a vita sotterranea
Bassa tensione di O2, alta %CO2
Scapanus orarius
Una mutazione nell’emoglobina (cambiamento di 1 aa) ne aumenta
l’affinità per la CO2, aumentando la velocità con cui l’organismo si
55
libera del gas tossico
Struttura tridimensionale
*
La particolare sequenza aminoacidica di ogni proteina ne
determina la struttura tridimensionale
*
La conformazione di una proteina ne determina la funzione
*
Un cambiamento della sequenza aa (mutazione) può avere
effetti drastici sulla sua funzione
Ligando-recettore
56
Substrato-enzima
Effetto di una mutazione puntiforme sulla
struttura della proteina: anemia falciforme
aa carico (Glu)
aa apolare (Val)
La sostituzione di un aa con caratteristiche di polarità/carica elettrica o con ingombro
sterico differenti può influire sulla struttura e sulla funzione di una proteina
Proteine: funzioni
Proteine enzimatiche che catalizzano le reazioni chimiche
(lattasi)
Proteine strutturali (cheratina, collageni, distrofina, seta)
Proteine di trasporto di piccole molecole (emoglobina,
albumina)
Proteine ormonali (insulina, paratormone)
Proteine recettoriali (recettore dell’insulina)
Proteine contrattili (actina, miosina)
Proteine di difesa (anticorpi) riconoscono molecole estranee
(antigeni)
…
58
ACIDI NUCLEICI
*
Gli acidi nucleici sono polimeri di nucleotidi e sono
specializzati nella conservazione, trasmissione e uso
dell’informazione genetica
*
DNA
(DeoxyriboNucleic
l’informazione
ereditaria,
Acid)
la
contiene
trasferisce
alle
generazioni successive (eccezione alcuni virus) e,
attraverso un intermedio a RNA (RiboNucleic Acid),
specifica la sequenza aminoacidica delle proteine
59
Nucleotidi
5’
3’
Zucchero pentoso + gruppo fosfato + base azotata
60
Perché negli acidi nucleici non c’è
il glucosio?
Gli zuccheri a 6 atomi di C sono molto più comuni in natura,
allora perché ribosio?
Analisi di DNA sintetico realizzato con glucosio ha evidenziato
che tale molecola:
*
permette anche appaiamenti «non canonici» (AA e GG)
*
non è in grado di appaiarsi con altri acidi nucleici (RNA)
* quindi non è adatto a conservare e trasmettere l’informazione
genetica
61
DNA vs RNA, composizione
Pentoso
Basi azotate
62
DNA
RNA
Struttura
Le molecole degli acidi nucleici sono costituite da
catene lineari di nucleotidi uniti tra di loro da un legame
covalente tra il carbonio 3’ dello zucchero di un
nucleotide e il gruppo fosfato in posizione 5’ dello
zucchero
del
nucleotide
fosfodiesterico)
63
adiacente
(legame
Condensazione
5’
3’
64
DNA doppio filamento
Due catene lineari antiparallele
65
DNA struttura 1
*
*
*
*
*
*
Doppia elica
Distanza tra due coppie di basi 0.34nm
Passo dell’elica 3.4 nm (1 giro = 10
bp)
Diametro dell’elica 2 nm
Filamenti dell’elica sono antiparalleli
Lo scheletro zucchero-P costituisce
l’impalcatura esterna dell’elica…
2 nm
66
DNA struttura 2
… mentre le basi azotate di ciascun filamento si appaiano nella parte
centrale dell’elica secondo le regole della complementarietà.
Il diametro della molecola si mantiene costante perché una purina si
appaia a una pirimidina
2nm
G ≡ C: 3 legami H
A = T: 2 legami H
67
DNA vs RNA, struttura
Singolo filamento
con possibili
regioni di «self
pairing» (es.:
tRNA)
o appaiamento
transitorio con
DNA (trascrizione)
o altri RNA
Doppio
filamento
con struttura
a doppia
elica
68
Il 2’-OH del ribosio impedisce la formazione di una doppia elica stabile nell’RNA
RNA struttura
mRNA
rRNA
69
tRNA
RNA funzione
*
*
*
*
*
mRNA (messaggero)1-3% dell’RNA cellulare fornisce
le istruzioni (sequenza nucleotidica) per la sintesi delle
proteine
rRNA (ribosomale) >80% dell’RNA cellulare
componente essenziale dei ribosomi (sintesi proteica)
tRNA (transfer) traduce il linguaggio del messaggero
(triplette nucleotidiche) in aminoacidi
RNA non codificante che regola l’espressione genica
Genoma (alcuni virus)
70
71
⃰
⃰
Chiralità 1
Qualunque oggetto (e quindi qualunque molecola) ha
un'immagine speculare…con l'eccezione dei vampiri.
Alcuni oggetti sono però identici (sovrapponibili) alla
propria immagine speculare.
72
⃰
Chiralità 2
Altri oggetti non sono identici (sovrapponibili) alla
propria immagine speculare.
73
Molecole chirali
74
⃰
Proprietà biologiche delle molecole
chirali
Una molecola si adatta perfettamente a un sito
recettoriale esercitando il suo effetto biologico,
mentre la molecola speculare non si può legare e non
«mano» dx
«mano» sx
produce l’effetto
«guanto» dx
75
«guanto» dx
Esempi molecole chirali con differenti
proprietà
Abbiamo bisogno di assumere zuccheri, ma se mangiassimo la
forma speculare di tali zuccheri moriremmo di fame, perchè noi
siamo in grado di metabolizzare solo la forma D
⃰
D glucosio dolce, L glucosio salato e non nutriente perché
non si lega ai recettori per il dolce e agli enzimi che lo
dovrebbero degradare per ricavare energia
⃰
⃰
76
Esempi molecole chirali con differenti
proprietà
limonene
cumino
Menta
piperita
77
propoxyphene
Che odore avrà la gomma da masticare
alla menta dall’altra parte dello specchio?
78