HPV:
human papilloma virus
Gruppo I ( Virus a DNA )
Nudo ( senza pericapside )
Genoma a DNA circolare ds
Genetica dei virus a dsDNA
1.
2.
3.
4.
5.
6.
Trascrizione primaria, mediante l’uso di
enzimi cellulari;
Traduzione con produzione di proteine
“precoci” (regolatrici );
Replicazione del DNA genomico virale da
parte di enzimi della cellula ospite;
Trascrizione tardiva per mezzo di enzimi
virali;
Sintesi di proteine “tardive” (strutturali);
Assemblaggio delle proteine strutturali e
del DNA nei nuovi virioni.
Le cellule bersaglio dell’HPV sono gli epiteli della cute e delle
mucose, che si rigenerano in continuazione. A seconda del
luogo dell’infezione si avranno dunque verruche nella cute e
papillomi nelle mucose.
Alcuni tipi di HPV possono causare, sia nell’uomo che nella
donna, tumori benigni, quale il condiloma genitale, e anche
maligni, quale il cancro al collo dell’utero, al cavo orale,
all’ano, all’ esofago ed alla laringe.
Gli HPV si contraggono tramite contatto diretto ( sessuale, orale
e cutaneo). Non sono presenti in liquidi biologici quali sangue
o sperma.
Il virus è più frequentemente trovato tra le popolazioni
promiscue e in condizioni precarie di igiene. L’uso del
profilattico non ha azione protettiva completa in quanto
l’infezione è spesso diffusa anche alla cute della vulva e del
perineo.
Le lesioni da HPV del collo uterino possono essere riconosciute
mediante il Pap Test.
Genoma dell’ HPV
8 Open Reading Frames ( ORF )
6 Proteine Precoci ( early proteins ) ( E1, E2, E4, E5,
E6, E7 ) che servono a modificare il metabolismo della
cellula ospite per metterlo al servizio dell’HPV. Infatti
favoriscono la crescita e la divisione della cellula, dal
momento che l’HPV può replicare il proprio genoma
solo nelle cellule in replicazione, in quanto non codifica
per una sua DNA polimerasi e ha bisogno della
polimerasi della cellula ospite.
2 Proteine tardive o strutturali ( late proteins ) ( L1, L2
) che associandosi tra loro formano la struttura
icosaedrica del capside virale ( composto da 72
capsomeri ).
Regione di controllo ( LCR ).
La proteina E2, è una proteina regolatrice, infatti se un DNA virale
si dovesse associare ad un DNA cellulare con la rottura di zone che
codificano per l’espressione di proteine regolatrici come la E2 si
avrebbe una sovraespressione di oncoproteine come la E6 e la E7.
Tra le oncoproteine E5, E6 ed E7, la proteina E5 è deputata a
mantenere bassi i livelli dell’ MHCI, un complesso proteico che
servirebbe alle cellule immunitarie T-cell al riconoscimento dell’
HPV, senza il quale la riproduzione procede senza intoppi
immunitari.
La proteina E6, è una proteina associata, che si lega con la p53,
interferendo e annullandone le proprietà attivatore-repressore
trascrizionale. Che se libera si attiverebbe in caso di danni al DNA
per bloccare il ciclo cellulare riparando il DNA stesso, o innescando
l’apoptosi per non diffondere la patologia.
La proteina E7, una piccola fosfoproteina, si lega alla Rb, una
proteina soppressore tumorale, destabilizzando il fattore
trascrizionale della cellula e impedendo il blocco del ciclo cellulare.
TIPI DI HPV
Circa 30 tipi infettano primariamente l’epitelio squamoso
del basso tratto genitale, dando origine a: condilomi
acuminati o verruche “a cavolfiore”, e “condilomi piani”
(malattia subclinica)
Gli HPV tipo 6, 11, 42, 43, o 44 di norma si presentano
come condilomi acuminati, ma possono anche
presentarsi come lesioni piane che possono o no essere
visibili a occhio nudo: sono i tipi “a basso rischio”
I tipi 16, 18, 31, 33, 35, 45, 51, 52, e 56 sono
considerati “ad alto rischio” essendo stati riscontrati nei
carcinomi della cervice e altre neoplasie del basso tratto
genitale
LESIONI
“SUBCLINICHE” DA HPV
VISIBILI DOPO
INGRANDIMENTO E
APPLICAZIONE DI
ACIDO ACETICO
La Piramide di Koutsky
(popolazione femminile U.S.A. 1997)
lesioni clinicamente manifeste
lesoni subcliniche
HPV DNA pos
75%
1%
4%
100%
90%
10%
80%
presenza di anticorpi
70%
60%
60%
50%
40%
nessuna infezione
25%
30%
20%
10%
EPIDEMIOLOGIA:
la grandezza del problema
Prevalenza mondiale femminile: 270.000.000
Ogni donna ha il 79% di possibilità di
incontrare il virus nella vita
Fattori di rischio
ABITUDINI
SESSUALI
ETA’
IMMUNODEPRESSIONE
CONTRACCEZIONE
n. partners
20-30
Diabete
orale
Età p.r.:
<17 aa
Gravidanza
HIV
chemioterapia
Trapianto d’organo
FUMO
PREVALENZA DI HPV DNA
Donne con citologia normale
Tutte le età
Meno di 30 anni
LESIONI PREINVASIVE
CAMPIONI DI CANCRO CERVICALE
100%
4-10%
25-35%
80-90%
95-
MESSAGGIO CHIAVE
Avere
l’HPV non è sinonimo di un certo
comportamento sessuale, di infedeltà o del
momento in cui si è contratta l’infezione.
HPV
va considerato come un commensale e
non come una malattia venerea
Il
cancro cervicale è una rara conseguenza di
una comune infezione virale genitale
IL CICLO VITALE DELL’ HPV
La natura transitoria della maggior
parte delle infezioni da HPV è
confermata dai dati che documentano
che il numero di partners durante
tutta la vita non è significativamente
correlato con la positività all’HPV, in
contrasto con il rischio associato con il
numero di partners negli ultimi cinque
anni.
DEFINIZIONE DI SCREENING
“ L’esame di una popolazione asintomatica per
selezionare i casi con alta probabilità di
sviluppare o avere la malattia oggetto di
screening” (Morrison, 1985)
“L’esame di una popolazione asintomatica che
consenta la identificazione del più iniziale stadio
di sviluppo biologico e/o clinico del tumore in
esame” (Burgarth, 1994)
REQUISITI STANDARD
“agevole” per l’utenza
ben tollerato
bassi costi
eseguito su tutta la popolazione
asintomatica
STRUMENTI DISPONIBILI
PAP test tradizionale
PAP test “a strato sottile”
HPV test
– HCR
– PCR
HPV-DNA testing: Hybrid Capture II
1
1.
2.
3.
4.
5.
2
3
4
5
Rilascio e denaturazione degli acidi nucleici
Ibridazione della sonda dell'RNA con il DNA bersaglio
Cattura degli ibridi dell'RNA: DNA in una fase solida
Reazione degli ibridi catturati con anticorpi coniugati multipli
Rilevamento del segnale chemiluminescente amplificato
Sierotipi
disponibili
Basso Rischio
6, 11, 41, 42, 43, 44
Rischio Intermedio
31, 33, 35, 39, 51, 52
Alto Rischio
16, 18, 45, 46
HPV-DNA testing: Polymerase Chain Reaction
costo più elevato
sensibilità migliore
tipizzare i diversi tipi di HPV
DNA ESTRATTO
BUFFER
PRIMERS
NUCLEOTIDI
DNA-POLIMERASI
TERMOCYCLER
1 DENATURAZIONE
2 ANNEALING
3 POLIMERIZZAZIONE
ELETTROFORESI SU
GEL DI AGAROSIO
2 VOLTE:
• Presenza DI HPV DNA
• Basso rischio o Alto rischio?
HPV-DNA testing:
non screening per cancro ma diagnosi di MTS
L’infezione da HPV rappresenta un fattore
necessario ma non sufficiente
nell’etiopatogenesi del cervicocarcinoma.
Quasi tutti i tumori della cervice sono HPV+ ma
la maggior parte delle donne HPV+ non
svilupperà mai il tumore della cervice
•
Gli attuali tests stratificano il rischio in base al
genotipo virale (HR:16-18 LR:6-11), ma non in
base all’attivita’ virale
(J Clin Virol,2005)
INDICI DI RISCHIO PER CANCRO
• genotipo virale HR: HPV DNA TEST
• quantità DNA infettante
• stato fisico del virus (episomale-integrato)
HPV
OSPITE
COFATTORI
INDICI DI RISCHIO PER CANCRO
genotipo virale HR
quantità DNA infettante
PCR-real time
Carica virale
stato fisico del virus (episomale-integrato)
INDICI DI RISCHIO PER CANCRO
genotipo virale HR
quantità DNA infettante
Southern blotting
E6-E7 nel DNA cellulare
O
Amplificazione m-RNA
stato fisico del virus (episomale-integrato)
INDICI DI RISCHIO PER CANCRO
La p16 è una chinasi capace di inibire il ciclo cellulare
attraverso l’attivazione di un gene oncosoppressore (Rb).
HPV attraverso l’integrazione di E7 è capace di inattivare Rb
e di determinare una iperespressione cellulare di p16.
La concentrazione di p16 è quindi un indice di rischio per K
HPV - Ruolo clinico in ginecologia
In teoria HPV DNA
può essere cercato
su tutti i campioni
biologici
Sangue con EDTA
2ml
urine
5ml
Liquido seminale
1ml
Tampone cervicale
Tampone vaginale
Tampone vulvare
Tampone orofaringeo
In ambito clinico è
stato approvato
HPV DNA testing
solo in patologia
cervicale
1. Screening
2. Gestione ASC US
3. Gestione LSIL,HSIL
4. Follow up post
trattamento
HPV - Ruolo clinico in ginecologia
HPV - Ruolo clinico in ginecologia
No uniformità protocolli gestione follow up post trattamento
conservativo per CIN di alto grado
NOSTRA PROPOSTA:
SENSIBILITÀ: CONFRONTO TRA
SCREENING DELL’HPV E PAP TEST
Sensitivity % for CIN 3
100
80
60
Pap
HPV
Pap+HPV
40
20
1.
Lorincz, et al. Arch Pathol Lab Med. 2003;127:959-968.
or
el
os
M
ov
er
an
x
i
H
an
e
Sh
To
w
te
C
ap
na
ca
s
nd
G
ua
N
ew
fo
un
dl
a
ei
m
s
R
n
0
VALORE PREDITTIVO NEGATIVO:
CONFRONTO TRA SCREENING
DELL’HPV E PAP TEST
100
NPV, %
Pap
HPV
99
Pap +
HPV
98
Reims
1.
New Foundland
Guanacaste
Cape Town
Lorincz, et al. Arch Pathol Lab Med. 2003;127:959-968.
Shanxi
Hannover
Morelos
SPECIFICITÀ: CONFRONTO TRA
SCREENING DELL’HPV E PAP TEST
100
Specificity % for CIN 3
80
60
Pap
HPV
40
Pap+HPV
20
Study
1.
Lorincz, et al. Arch Pathol Lab Med. 2003;127:959-968.
or
el
os
M
r
an
ov
e
H
ha
nx
i
S
n
To
w
ap
e
as
te
C
G
ua
na
c
la
nd
fo
un
d
N
ew
R
ei
m
s
0
Circa una donna su sei con
un test hc2 positivo
svilupperà un’anormalità
citologica rilevabile entro i 5
anni successivi.
PE Castle, S Wacholder, ME Sherman, AT Lorincz, AG Glass, DR Scott,
BB Rush, F Demuth, M Schiffman
Cancer (2002) 95, 2145-2151
VANTAGGI DELL’ HPV TEST RISPETTO AL
PAP TEST COME STRUMENTO DI
SCREENING PRIMARIO
sensibilità
pari o superiore
capacità di individuare le donne a
rischio di contrarre la malattia in
futuro
minori competenze tecniche richieste
possibilità che le donne possano
prelevare da sé i campioni.
Per le donne con un risultato ASCUS allo
screening biennale mediante esame
citologico tradizionale o in fase liquida, il
reflex test del DNA dell’HPV è meno costoso
di un test dell’HPV ritardato, della ripetizione
dell’esame citologico o della colposcopia
immediata. Un programma di screening
biennale che utilizzi un esame citologico in
fase liquida e un test riflesso dell’HPV risulta
inoltre più efficace e meno costoso
dell’esame citologico annuale tradizionale
con la ripetizione dell’esame citologico o la
colposcopia.
JJ Kim, TC Wright, SJ Goldie. JAMA (2002) 287(18), 2382-2390
LINEE GUIDA DI CONSENSO
1
DELL’ASCCP
Il
reflex test per i tipi di HPV ad alto
rischio è la strategia d’elezione per
la gestione del Pap test anormale
bordeline.
1.
Wright T, et al. JAMA, 2002;287:2120-2129.
ASCUS CYTOLOGY
HPV test
+High-Risk
HPV
-High-Risk
HPV
Colposcopy
Repeat cervical
cytology
in 4-6 months
RACCOMANDAZIONI
DELL’ACOG
“L’impiego combinato di un
esame citologico della cervice
uterina e dello screening del
DNA dell’HPV è adatto per le
donne dai 30 anni in poi..”
ACOG Practice Bulletin, Number 45, August 2003. Replaces Committee
Opinion Number 152, March 1995.
HPV Prevalence (%)
30
25
25
HPV (HC2)
20
20
15
15
Cancer
10
10
5
5
0
30
Age (Years)
0
Cancer incidence per 100,000
PERCHÉ SOTTOPORRE AL TEST DELL’HPV
SOLO LE DONNE DAI 30 ANNI IN POI?
15- 20- 25- 30- 35- 40- 45- 50- 55- 6019 24 29 34 39 44 49 54 59 65
Le donne di età <30 anni presentano una maggior prevalenza di infezioni da
HPV e più infezioni transitorie.1
La prevalenza dell’HPV diminuisce nelle donne a partire dal 30° anno di età.2,3
L’incidenza del cancro del collo dell’utero aumenta nelle donne a partire dal
30° anno di età.2,3
1)Saslow, D. et al. CANCER. 52(6) 342-362., 2)Melkert PW, et al. Int J Cancer, 1993;53:919-923. 3)NCI SEER Data, 1990-1994.
CARTA INTERNAZIONALE DI
EUROGIN
“L’età ideale per iniziare lo screening con l’esame
citologico associato al test dell’HPV sono i 30 anni.
Sottoporre a test le donne di età > 30 anni per gli
HPV ad alto rischio è un metodo più efficace come
screening primario rispetto all’esame citologico della
cervice uterina attualmente praticato.
Le donne positive all’HPV, ma con referto citologico
normale, non devono essere sottoposte
immediatamente a colposcopia salvo in presenza di
altre valide indicazioni cliniche. La risposta clinica più
adatta consiste nel ritestarle dopo 1 anno per
verificare la persistenza dell’HPV.
Conclusions: Cervical Cancer Control, Priorities and New Directions. International Charter.
European Research Organization on Genital Infection and Neoplasia. April 2003
LINEE GUIDA
1
DELL’ACS
“Il test del DNA dell'HPV presenta una
maggior sensibilità rispetto all'esame
citologico nel rilevare lesioni clinicamente
rilevanti” e “l'elevato valore predittivo
negativo derivante dallo screening
concomitante con esame citologico e test del
DNA dell'HPV DNA potrebbe consentire di
allungare in sicurezza gli intervalli di
screening, riducendo in questo modo i
costi”.
1.
Saslow, D. et al. CANCER. 52(6) 342-362..
Poiché le donne con risultati negativi ad entrambi i test corrono un
rischio molto basso, l’impiego del test dell’HPV consentirebbe di
prolungare, in sicurezza e con un miglior rapporto costo-beneficio,
l’intervallo di screening a cinque anni. (J-P Bory1, J Cucherousset, M Lorenzato, R
Gabriel, C Quereux, P Birembaut, C Clavel, Int. J. Cancer (2002) 102,519–525)
CONCLUSIONI
L’associazione HPV DNA + PAP test è sensibilissima e il
valore predittivo negativo della combinazione è del 100%
L’impiego del HPV test in un programma di screening del
cancro del collo dell’utero fornisce ai medici e alle donne
una maggior garanzia che i risultati negativi siano precisi
Le donne negative al HPV test possono essere rassicurate
dicendo loro che corrono un rischio molto basso di
sviluppare il cancro del collo dell’utero
Lo screening concomitante con esame citologico e test del
DNA dell'HPV potrebbe consentire di allungare in sicurezza
gli intervalli di screening, riducendo in questo modo i costi.
VACCINI:
E’ impossibile utilizzare virus
inattivati come vaccino per
l’uomo
Percio’ si sfrutta la capacità
immunogenica dei singoli
antigeni capsidici(L1 e L2)
Si creano vaccini
PROFILATTICI
completamente privi di
rischio come vaccino ep. B
SINTESI
La capacità immunogenica delle proteine
capsidiche dell’HPV ( L1 e L2) è legata alla
conformazione sterica delle stesse
si utilizzano insetti, lieviti e batteri esprimenti
antigeni ricombinanti
Strutture proteiche
morfologicamente
simili ai virioni
reali(virus like
particles o VLPs)
L1 HA PIU’ ALTO POTERE IMMUNOGENICO
CON PRODUZIONE DI ANTICORPI HPV
SPECIFICI NELL’OSPITE
LE L1VPLs SONO GENOTIPO
SPECIFICHE E PROTEGGONO DAL TIPO
VIRALE DA CUI DERIVANO MA NON DA
ALTRI
Vaccino approvato sia dalla Food and
Drug Administration che dall’EMEA e già
in commercio anche in Italia
NOME COMMERCIALE: gardasil
DISTRIBUTORE: sanofi-pasteur
RANGE D’AZIONE: sierotipi 16,18,11,6
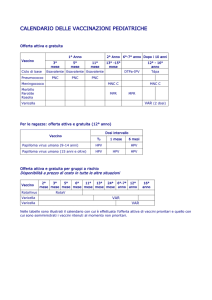
Attuale protocollo di applicazione
3 somministrazioni consecutive: 0, 2, 6 mesi i.m.
A soggetti mai esposti al rischio (no rapporti sessuali)
tra i 9 e 26 anni
attualmente a pagamento con un costo di circa
180 euro a somministrazione
protocollo Regione Toscana: in fascia A per le
bambine di 11 anni +1 e 12 anni –1
Cosa ci si aspetta dal vaccino
100% riduzione condilomi
90% riduzione lesioni preinvasive
cervicali
Koutsky, 2005
Ridurre la frequenza dei controlli citocolposcopici
Ridurre le terapie conservative per lesioni
preinvasive
CONTENIMENTO DEI COSTI