EPILESSIE
Prevalenza 0,5 - 2 % abitanti
Incidenza 20-70 casi/100.000
50 milioni di pazienti nel mondo
CRISI O ACCESSO EPILETTICO
• Scarica occasionale, improvvisa, esagerata e ipersincrona di un
grande numero di neuroni (J. Hughlings Jackson).
• La manifestazione comportamentale dell’accesso epilettico
dipende dalla localizzazione dei neuroni coinvolti.
• L’accesso può essere convulsivo (cioè accompagnato da
manifestazioni motorie) oppure presentarsi con diversi sintomi
neurologici.
L’epilessia è una sindrome cronica caratterizzata da crisi
epilettiche spontanee e ricorrenti.
FOCUS EPILETTICO
E’ il punto di partenza della scarica elettrica patologica (non
sempre individuabile). L’attività elettrica anomala può poi
diffondersi a tutta la corteccia.
Substrato neuronale dell’epilessia
La sinapsi
ioni
Il cervello
Il canale ionico/Recettore
Epilessia primaria o idiopatica
70%
Epilessia secondaria o sintomatica 30%
ORIGINI PATOLOGICHE DEL FOCUS:
•
•
•
•
•
•
genetica, spesso nell’ambito di sindromi complesse
traumatica
flogistica
neoplastica
ischemica
… sconosciuta
In alcuni casi, il trattamento della patologia sottostante
può risolvere la situazione. Negli altri casi, si deve
instaurare una terapia cronica per prevenire le crisi.
FATTORI SCATENANTI L’ATTACCO:
• variazioni di glicemia, pH plasmatico, equilibrio elettrolitico
• anossia
• alterazioni metaboliche o endocrine
• affaticamento
• stress
• carenze nutrizionali
• interventi farmacologici (intossicazione o brusca sospensione di
farmaci)
• … indeterminati
Storia
•
•
•
•
•
•
•
•
•
Phenobarbitone 1912
Phenytoin
1938
Primidone
1952
Ethosuximide 1955
Carbamazepine 1965
Sod. Valproate 1973
Valproic acid
1993
Clonazepam
1974
Clobazam
1979
•
•
•
•
•
•
•
•
Vigabatrin
Lamotrigine
Gabapentin
Tiagabine
Topiramate
Levetiracetam
Fosphenytoin
Zonisamide
1989
1991
1993
1995
2000
2001
2005
Strategie
•
Modificazioni della conduttanza ionica.
•
Aumento della trasmissione GABAergica.
•
Diminuzione dell’attività eccitatoria
(glutamatergica)
FARMACI ANTIEPILETTICI “CLASSICI”
Farmaci efficaci sulle crisi parziali
e tonico-cloniche generalizzate
IDANTOINE
IMINOSTILBENI
BARBITURICI
DEOSSIBARBITURICI
fenitoina
carbamazepina
fenobarbitale
primidone
Farmaci con ampio spettro di attività antiepilettica
BENZODIAZEPINE
ACIDI CARBOSSILICI
diazepam, lorazepam,
clonazepam, clobazam
acido valproico
Farmaci efficaci sulle assenze
SUCCINIMIDI
etosuccimide
Struttura chimica
X:
Barbiturici - C – N IDANTOINE
-N–
derivati ossazolidinici – O –
Succinimidi
–C–
Fenacemide: E’ attiva in alcune forme di
epilessia ma mostra un’elevata tossicità
pertanto viene usata solo in caso di crisi
epilettiche non controllabili con altri farmaci
Acetilurea
- NH2 –*
*(N connesso al C2)
Piccoli cambiamenti alterano l’attività ed il sito d’azione.
e.g. R1, un gruppo fenilico (phenytoin) conferisce attività contro l’epilessia ma un
Gruppo alchilico (ethosuximide) conferisce attività contro l’assenza.
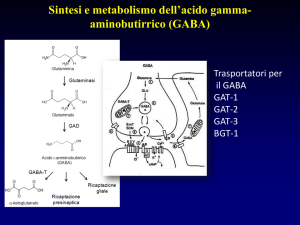
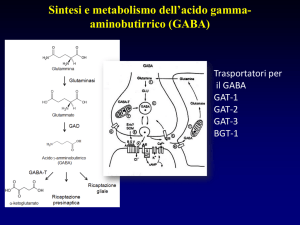
GABAergic SYNAPSE
Drugs that Act at the
GABAergic Synapse
•
•
•
•
•
GABA agonists
GABA antagonists
Barbiturates
Benzodiazepines
GABA uptake inhibitors
Goal : GABA Activity
BARBITURICI: fenobarbitale
1912
Usi terapeutici
E’ oggi scarsamente utilizzato
• crisi tonico-cloniche
generalizzate, anche
secondariamente
Effetti collaterali
• sedazione
• confusione nell’anziano
• alterazioni cognitive e
irritabilità nell’infanzia
• nistagmo, atassia
• effetti gravi da
sovradosaggio
H
H
Meccanismo d’azione
• a basse dosi, potenziamento
della trasmissione mediata
dal GABA (prolungamento
del tempo di apertura del
canale GABAA)
• ad alte dosi, attivazione
diretta del canale GABAA
DEOSSIBARBITURICI: primidone
Usi terapeutici
E’ oggi scarsamente utilizzato
• crisi tonico-cloniche
generalizzate, anche
secondariamente
Effetti collaterali
• sedazione
• nistagmo, atassia, vertigini
• reazioni psicotiche
• raramente: rash, tossicità
midollare
H
H
Viene metabolizzato a
feniletilmalondiamide (PEMA)
e a fenobarbitale, entrambi
metaboliti attivi
Meccanismo d’azione
• analogo a quello del
fenobarbitale
Synthetic Routes to Butenyl GABA Uptake Inhibitors:
SINTESI TIAGABINA
Final stages:
Tiagabina
H2N
COOH
GABA
H2N
COOH
VIGABATRIN
Anticonvulsants
Gamma- Amino- Butyric- Acid (GABA)
Before 1883 known as a metabolite of plants
and microorganisms (Basidio-, Streptomycetes)
1883 synthesized
1949 identified in animal tissue not incorporated in proteins !!!
1956 first indications on an inhibitory activity on nervous tissue
main inhibitory fuctions in the vertebrate CNS
Gamma Amino Butyric Acid
• An inhibitory neurotransmitter of the Central Nervous system.
• Binds to GABA receptors on the cell membrane of the post synaptic
neuron.
• Causes the GABA receptor to open a coupled chloride ion channel.
• Chloride enters the neuron causing hyperpolarization and inhibiting
transmission of the action potential.
Pathophysiology of GABA
Reduced GABA-activity
in local cell assemblies:
Overexcitability / Epilepsy
In striatal output neurons:
Chorea Huntington
Enhanced GABA-activity
In local cell assemblies:
reduced excitability
inhibition of learning
anxiolytic
anesthetic
The GABAa Receptor
• Consists of 5 subunits.
– 2 alpha units
– 2 beta units
– 1 gamma units
• Functions as a ligand
gated chloride channel
on the post-synaptic
cell.
Different Possible States of the
GABA Receptor
• 5 protein subunits (2 alpha, 2 beta, 1
gamma)
6 different forms of the alpha subunit
4 different forms of the beta subunit
3 different forms of the gamma subunit
• Possible number of states of the receptor
= 3 X 4 X 6 X 4 X 6 = 1728.
• At least 19 different states identified.
Transmembrane domains of the
subunits
Three of the
transmembrane
domains, (M1, M3, and
M4),
are identical in their 3dimensional structure
The M2 domains ,which
form the inner wall of
the channel, have a
specialized 3-D
structure.
Mechanism of opening and
closing of the channel
• When GABA binds to the recognition site, it induces
several conformational changes in the receptor
molecule.
• One of these changes involves the rotation of the
five protein subunits such that the diameter of the
channel is widened.
• The channel opens because the subunit proteins rotate
sideways.
• The "kinks" that keep the channel closed swivel and
open the channel.
• The kink is formed at a specific sequence of amino acids
on the M2 transmembrane domain.
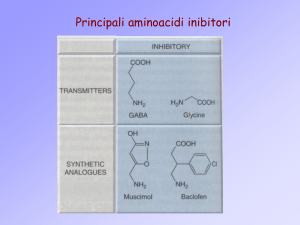
LIGANDS AT GABA-RECEPTORS
1. GABA – site of GABAA-REC.
agonist
antagonist
OH
O
H2N
N
O
N
O
MUSCIMOL
CH3
O
O
O
pro-convulsive
O
BICUCULLIN
(BARBITURATES)
Th: former hypnotics
antiepileptic
(Cordyalis lutea = Lerchensporn)
PICROTOXIN
(Anamyrta cocculus = Scheinmyrte)
BZD: Mechanism of action
α β γ subunits assemble in an uncertain
stechiometry to form a pentameric :
GABA-A receptor
LIGANDS AT GABA-RECEPTORS
2. BDZ – site of GABAA-REC.
(BZ1 & BZ2)
agonists
H3C
N
Cl
O
ACTION
OF
plus GABA
N
Th: hypnotic
(MIDAZOLAM, FLUNITRAZEPAM)
antiepileptic / anticonvulsive
(CLONAZEPAM, DIA
BENZODIAZEPINS
anxiolytic
(DIAZEPAM)
myotonolytic
(TETRAZEPAM)
IMIDAZOPYRIDINES
(Zolpidem)
Th: hypnotic
anxiolytic
LIGANDS AT GABA-RECEPTORS
2. BDZ – site of GABAA-REC.
(BZ1 & BZ2)
agonists
H3C
N
Cl
O
antagonist
ACTION
OF
plus GABA
N
N
O
O
O
N
pro-convulsive
CH3
Th: antidot
FLUMAZENIL
inverse agonists
N
H
O
N
F
minus
BENZODIAZEPINS
O
N
-CARBOLINES
(-CCB)
LIGANDS AT GABA-RECEPTORS
3. GABAB – receptor
agonist
antagonist
Cl
Cl
H2N
COOH
BACLOFEN
Th: muscle relaxant
H2N
SO3H
SACLOFEN
Zolpidem (Ambien)
• Non-benzodiazepine sedative-hypnotic
• Acts at benzodiazepine receptor a1 subunit
• Used for short-term treatment of insomnia
• T1/2 = 2 hours
Flumazenil (Romazican)
Benzodiazepine antagonist
Used in management of suspected benzodiazepine overdose
Eliminated by hepatic metabolism after IV administration
Rapid
Onset within 2 min
Clinical effects persist 30 - 60 minutes
Anexate, Lanexat, Mazicon, Romazicon
It was introduced in 1987 by Hoffmann-La Roche under the trade name Anexate.
Flumazenil, an imidazobenzodiazepine derivative, antagonizes the actions
of benzodiazepines on the central nervous system. Flumazenil
competitively inhibits the activity at the benzodiazepine recognition site
on the GABA / benzodiazepine receptor complex
Gerecke, M.; Hunkeler, W.; Kyburz, E.; Mohler, H.; Pieri, L.; Pole, P.; 1982, U.S. Patent 4,316,839.
Discovery of BZD: Evolution of
Psychopharmacology
1.
Prehistoric times: Alcohol and herbs as hypnotic
2.
Bromide (first hypnotic), chloral hydrate, paraldehyde
3.
1903 -1960: Barbiturates era, 50 marketed agents
–
1930: Separation of anticonvulsant from sedative-hypnoticanesthetic
–
1940: Phenytoin
–
1950: Taming agents Chlorpromazine and Meprobamate
Barbiturates unsafe
Discovery of BZD
• 1957 accidental discovery of chlordiazepoxide on the heels
Chlorpromazine
• Wrong structure (ring expansion) and surprisingly low
toxicity with remarkable anxiolytic, sedative &
anticonvulsant
• 1960 Introduction of first BZD to clinic as Librium
(Libre French free; Liber Latin freedom)
• More than 3000 synthesized & evaluated, 35 in market
BZD replaced Barbiturate, 1960 onwards BZD era…..
Sternbach L. The BZD story. J Med Chem. 1979; 22:1-7
Meccanismo d’azione
• Stimolazione del recettore GABA-A
Da parte del GABA
• Aumento della permeabilità della
membrana neuronale al cloro
• Le benzodiazepine agevolano la trasmissione a tutte le sinapsi
GABAergiche del SNC
The Role of Benzodiazepines
• Positive allosteric modulators of the GABAa receptor.
• Bind at a site different from that of GABA.
• Enhances binding of GABA to its site, increasing chloride
conductance.
Evidence of Complexity – 3
Broad Types of Ligands
• Agonists – bind to BZD site on alpha subunit and
increase receptor affinity for GABA resulting in
neuroinhibition. (eg. BZD)
• Inverse Agonists – bind to BZD site on alpha
subunit and decrease receptor affinity for GABA
resulting in neurostimulation.
• Antagonists – have no effect at receptor but
compete with both agonists and inverse agonists
and so inhibit their actions. (eg. flumazenil)
• Recently partial agonists and partial inverse
agonists have also been discovered.
Benzodiazepine- Uso
• Farmacoterapia dell’ansia e di altri disturbi emotivi
• Nell’insonnia
• Nell’epilessia e in altre manifestazioni convulsive
• Impiegati come miorilassanti centrali in preanestesia o
come inducenti in anestesiologia
• Le benzodiazepine o i loro metaboliti possono accumularsi
nell’organismo
Effetti tossici
dopo 5-10 gg
Ansiolitici
• Farmaci impiegati per il controllo diurno degli
stati ansiosi, moderati o gravi
• Le benzodiazepine sono i più usati
• Anche i barbiturici rientrano in questa classe
ma presentano effetti secondari molto più gravi
Induzione enzimatica
Basso indice
terapeutico
Ansiolitici- Benzodiazepine
R
O
N
R2
R1
N
X
Ansiolitici- Benzodiazepine
Impiegato
come
anticonvulsivante
H
NHCH3
O
N
N
H3C
O
N
Cl
OH
N
Cl
N
O
Cl
N
Clordiazepossido
Ossazepam
Diazepam
• Riducono l’ipereccitabilità psicomotoria
• Indicati nel trattamento delle crisi di astinenza degli alcolizzati
• Molte benzodiazepine sono anche miorilassanti(impiegate nelle
Sintesi del nitrazepam e nimetazepam
O
O
NH2
NH
N
O
PhCOCl
ZnCl2
O
O2N
O2N
O2N
H +/
O
O
Cl
NH2
NH
NH2
NH
Cl
O
O
O2N
O2N
+ O2N
O
NH3
O
Cl
O
NH2
O
N
O
H
N
NH
Me2SO4
O
MeOH
O2N
O2N
O2N
N
N
Nitrazepam
Nimetazepam
Relazioni attività-struttura
• Sistema ciclico “classico” delle
benzodiazepine:
5-Fenil-1,4-benzodiazepin-2-one
‘positive allosteric modulator’
•Anxiolytic
•Anti Convulsant
•Sedative hypnotic
‘negative allosteric mod
•Anxiogenic
•Convulsive
Haefely WE (1989) In Allosteric Modulation of Amino Acid Receptors: Therapeutic Implications
pp 47-69, Raven Press, New York.
Relazioni attività-struttura
Presenza di un gruppo elettron – attrattore in posizione 7 attività
Relazioni attività-struttura
H
H
O
N
H
O
N
B
B
N
H
N
H
H
L’anello B delle benzodiazepine può adottare due conformazioni e
per l’affinità al recettore
Lattame
aperto
Metabolismo Clordiazepossido
NH2
NHCH3
N
Cl
O
H
N
N
N
N
Cl
N
Cl
O
O
Clordiazepossido
O
N-desmetilclordiazepossido
Demossepam
O
H
N
O
H
N
OH
N
Cl
Metaboliti
attivi
Cl
Ossazepam
N
Idrossilazioni
anelli aromatici
N-desmetildiazepam
BENZODIAZEPINS
DIAZEPAM (VALIUM)
H3C
N
O
N
Cl
H
N
CNS
O
LIVER
N
Cl
desmethyldiazepam
H
N
H
N
O
O
OH
Cl
N
OXAZEPAM
O
Cl
N
Glucuronic Acid
BENZODIAZEPINS
DIAZEPAM (VALIUM)
H3C
H3C
N
MIDAZOLAM
(DORMICUM)
O
N
Cl
N
N
N
Cl
F
H
N
CNS
O
LIVER
N
Cl
OH-mdz
mdz-glucuro
desmethyldiazepam
H
N
H
N
O
O
OH
Cl
N
OXAZEPAM
O
Cl
N
Glucuronic Acid
BENZODIAZEPINS
DIAZEPAM (VALIUM)
t1/2=32h
H3C
H3C
N
MIDAZOLAM
(DORMICUM)
O
N
Cl
H
N
N
Cl
t1/2=3h !
O
t1/2=50-100h desmethyldiazepam
H
N
H
N
O
Cl
N
t1/2=8h OXAZEPAM
O
O
OH
Cl
N
F
N
Cl
N
N
Glucuronic Acid
t1/2=2h
Flunitrazepam (Rohypnol)
(roofies, rope, Mexican valium, roach-2, R-2)
Illegal in the U.S. (and many other countries)
Date rape and robbery
Effective within 15-20 minutes
Active for 4-6 hours
Induces anterograde amnesia
Also confusion, sedation, dizziness, visual disturbances
AZASPIRODECANDIONI
E’ un nuovo tipo di ansiolitico con modesta componente
sedativa, efficacia paragonabile al diazepam
Attività
•Mitiga l’ansietà senza
causare sedazione o
alterazioni funzionali
•Non favorisce l’abuso, né
dà dipendenza fisica
Pharmacokinetics of Buspirone
Rapidly absorbed
Extensive first-pass metabolism
T1/2 = 2-4 hours
Properties of Buspirone
Advantages
Anxiolytic properties similar to diazepam
Tolerance to therapeutic effects does not develop
No known interactions with other drugs or alcohol
Disadvantages
Requires at least two weeks to achieve
therapeutic effects
Sodium channels
• Main target for many drugs
• Sodium channels are responsible for the
rising phase of the action potential in
excitable cells and membranes
Potassium channels
•
•
•
•
Very diverse group of ion channels
Responsible for resting potential
Influences excitability of neurones
Determine potential width
RETIGABINA
Retigabine (INN) or ezogabine (USAN), codenamed D-23129, is an anticonvulsant being
investigated as a possible treatment for partial epilepsies. As of July 2010, several Phase
III clinical trials are underway for this indication, and retigabine is being reviewed for
approval by the United States Food and Drug Administration (FDA) and the European
Medicines Agency (EMA). The drug is being developed by Valeant Pharmaceuticals and
GlaxoSmithKline, with the proposed trade name Potiga. It was approved by the European
Medicines Agency under the trade name Trobalt in April 2011.
Retigabine works primarily as a potassium channel opener—that is, by activating a certain
family of voltage-gated potassium channels in the brain. This mechanism of action is
unique among antiepileptic drugs, and may hold promise for the treatment of other
neurologic conditions, including migraine and neuropathic pain; a Phase II trial to assess
the safety and efficacy of retigabine for treating postherpetic neuralgia is ongoing.
Actions of Phenytoin on Na+
Channels
Na+
A. Resting State
B. Arrival of Action
Potential causes
depolarization and
channel opens allowing
sodium to flow in.
Na+
Na+
C. Refractory State,
Inactivation
Sustain channel in
this conformation
Il felbamato è un farmaco prodotto dalla Schering-Plough, usato come antiepilettico di
seconda scelta per le epilessie parziali e generalizzate; appartenente alla seconda
generazione di epilettici. Non è raccomandato come prima scelta per i rischi anche mortali di
anemie aplastiche [1] e insufficienze epatiche; il suo uso è suggerito quando, in mancanza di
alternative valide, i potenziali benefici superano i rischi. È indicato anche come terapia
aggiuntiva per il trattamento di bambini (> 4 anni) affetti da Sindrome di Lennox-Gastaut, I
nomi con cui il farmaco è commercializzato nel mondo sono: Felbamyl, Felbatol e Taloxa.
Agisce sul complesso recettore ionoforo per il NMDA,
interagendo specificamente con il sito di riconoscimento
per la glicina che non è sensibile alla stricnina. Ha anche
un effetto sull’influsso del Na+. Studi suggeriscono una
sua duplice azione sia su meccanismi cerebrali eccitatori
sia su quelli inibitori GABA-mediati
Agisce con azione di tipo inibitorio sulle risposte
inibitorie NMDA-evocate e sui potenziali GABA-evocati;
L’azione combinata del felbamamto sulla trasmissione
eccitatoria ed inibitoria, può contribuire a spiegare le
notevoli modalità d’azione del farmaco sui vari modelli
di epilessia.
Fosphenytoin
Fosphenytoin (Cerebyx, Parke-Davis; Prodilantin, Pfizer Holding
France) is a water-soluble phenytoin prodrug used only in hospitals
for the treatment of epileptic seizures.
Phenytoin, in both its acidic and sodium salt forms,
is erratically bioavailable whether it is injected or
taken orally due to its high melting point, weak
acidity, and its being only sparingly soluble in water.
Simply putting patients on other drugs is not always
an option; this was especially true before 1993,
when the number of anticonvulsivant available was
much more limited. One solution was to develop a
prodrug that did not have these drawbacks.
Fosphenytoin was approved by the FDA on August
5, 1996 for use in epilepsy
IMINOSTILBENI: carbamazepina
1960: nevralgia del trigemino
Usi terapeutici
farmaco di prima scelta per:
• crisi parziali
• crisi tonico-cloniche
generalizzate
• non è indicata per le
assenze!
Effetti collaterali
• sonnolenza inferiore a quella
indotta dalla fenitoina
• vertigini, atassia, diplopia
• rash cutanei
• discrasie ematiche (rare)
1974: efficacia antiepilettica
H2
Struttura triciclica. Si
trasforma in un epossido,
metabolita attivo
Meccanismo d’azione
• “fenitoino-simile” di blocco dei
canali Na+ in modo voltaggioe frequenza- dipendente
FDA approves Lamictal®XR™; an extendedrelease once-daily, new generation treatment for
epilepsy
Patented GlaxoSmithKline Extended-Release Technology
Lamictal XR Extended-Release Tablets are enteric-coated and contain a
modified release formulation in the center of the tablet. There is a specially
designed opening in the enteric coating on both sides of the tablet that
utilizes a new technology called DiffCORE™, discovered and developed
by GlaxoSmithKline. This allows a controlled release of the medicine in
the acidic environment of the stomach, leading to a gradual release of
lamotrigine into the bloodstream.
Sintesi delle succinimmidi: Etosuccimide
O
R
COOEt
HCN
+
R1
R
NC
COOEt EtONa/EtOH
R1
CN
R1
R
COOEt
NC
R1
R
H+/
COOH
HOOC
-CO2
CN
COOH
R
R
R1
R1
COOH
R2NH2
O
Etosuccimide
HOOC
N
R2
O
Succinimidi
R = CH3
R1 = C2H5
R2 = H
Il gabapentin è il nome del principio attivo indicato specificamente
nel dolore posterpetico e nell’ EPILESSIA parziale resistente alle
terapie standard.
Viene commercializzato sotto il nome di Neurontin di Pfizer ed altri
nomi ed è un farmaco generico da alcuni anni.
Gabapentin è strutturalmente correlato al neurotrasmettitore GABA (acido gammaaminobutirico) ma il suo meccanismo d'azione differisce da quello di altre sostanze che
interagiscono sulla sinapsi GABA.
A concentrazioni terapeutiche gabapentin non si lega ad altri farmaci noti o a recettori dei
neurotrasmettitori cerebrali, quali benzodiazepina, GABAA, GABAB, glutammato, glicina o
recettori dell´N-metil-d-aspartato (NMDA).
Gabapentin non interagisce con i canali di sodio in vitro, ed in questo si differenzia dalla
fenitoina e dalla carbamazepina.
Gabapentin provoca una leggera riduzione nel rilascio dei neuro-trasmettitori
monoamminici in vitro.
Studi nei ratti dimostrano che gabapentin aumenta la sintesi del GABA in diverse aree
cerebrali.