PARODONTO
Tessuto
di attacco
e
sostegno del dente:
Gengiva mobile e fissa
Legamento parodontale
Osso alveolare
Superfici delle radici dentali
LA VITA MICROBICA
nell’ecosistema ORALE
Van Leeuwenhoek inizia a studiare questa
nicchia ecologica oltre 300 anni fa (1676)
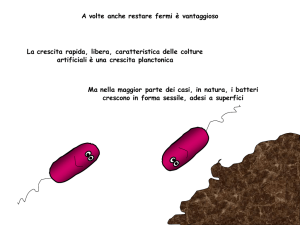
La vita non è organizzata in modo planctonico
bensì in grandi COMUNITA’
POLIMICROBICHE : BIOFILM
Marsh e Bradshow, 1996; Wilson, 1996
BIOFILM
Popolazione batterica MISTA
inclusa in una MATRICE
i cui componenti
ADERISCONO TRA LORO e a
SUPERFICI SUPRA e SOTTOGENGIVALI
Darveau, Tanner e Page, 1997
FORMAZIONE DI UN BIOFILM
Sulla superficie PULITA di un dente SANO in CONDIZIONI NORMALI
• PELLICOLA di glicoproteine salivari e
FLUIDO CREVICOLARE
• RECETTORI per i BATTERI
• PRIMI COLONIZZATORI: Streptococcus gordonii
Actinomyces naeslundii
S. sanguis e N. sicca
• COAGGREGAZIONE: i primi ospiti offrono recettori alle
adesine di ALTRE SPECIE che si inseriscono
Darveau et al., 1997
IL BIOFILM SI ACCRESCE
La popolazione polimicrobica esprime
innovative rispetto alla vita planctonica
caratteristiche
• MINIATURIZZAZIONE cellulare
• FORMAZIONE DI MICROCOLONIE avvolte in una abbondante
matrice adesiva extracellulare
• BASSA VELOCITA’ DI REPLICAZIONE
Darveau et al., 1997
QUORUM SENSING
Fenomeno di comunicazione cellulare:
Quando la popolazione batterica raggiunge una
concentrazione critica parte il segnale per lo
sviluppo del biofilm.
Nel biofilm i batteri continuano a comunicare tra
di loro al fine di controllare l’equilibrio del biofilm
e la produzione di fattori di virulenza.
IL BIOFILM MATURO NORMALE
E’ in grado di escludere:
microorganismi orali (Gram-negativi) più
dannosi
patogeni opportunisti vari (enterici)
attraverso meccanismi di COMPETIZIONE
Darveau et al., 1997
BIOFILM NORMALE
Questo tipo di biofilm è POCO PERCEPITO
dall’ospite
I messaggi CHIMICI emessi dalla
popolazione PREVALENTEMENTE GRAMPOSITIVA sono di BASSO LIVELLO
(tossine, enzimi, ecc.)
L’epitelio NON VIENE DISTRUTTO e lo
SPAZIO A DISPOSIZIONE NON AUMENTA
RISPOSTA DELL’OSPITE AL
BIOFILM PATOLOGICO
• Il biofilm invia POTENTI SEGNALI della propria
presenza (endo ed esotossine non elaborate dalla
popolazione del biofilm normale)
• A partire dai patogeni originano: vescicole di parete
cellulare, lipopolisaccaridi, lipidi, enzimi
• Tali PERSISTENTI STIMOLI ANTIGENE DOTATI DI
TOSSICITA’ MODULANO la risposta di difesa locale
•Salvi et al. 1997
L’ASSE ANTICORPI-NEUTROFILI
• L’INFILTRATO PLASMACELLULARE
caratteristico delle parodontopatie indica lo sforzo di
contenimento basato sulla SINTESI LOCALE di Ab e sull’
INTERVENTO DEI PMN
• Se le difese sono SUFFICIENTI l’infezione è controllata
dal MOMENTANEO DIMINUIRE della CARICA BATTERICA
e dei suoi PRODOTTI
Salvi et al., 1997
L’ASSE Ab – NEUTROFILI E’ SUPERATO
• Il biofilm patogeno resiste e si
ESPANDE
• Batteri e loro prodotti penetrano
nei TESSUTI
Placca
• Si forma sulla superficie dei denti e sulle
protesi
• Svariate comunità batteriche (1-2 x 1011 germi
/gr) incluse in una matrice composta da
polimeri batterici, salivari e da glicoproteine
salivari
• Calcificazione tartaro
Malattia parodontale
Ogni alterazione che va da:
Gengivite lieve
a
Parodontite avanzata, distruttiva con perdita
d’osso, perdita d’attacco e considerevole
mobilità dentale
Malattia parodontale
• Processo INFIAMMATORIO dei tessuti attorno al
dente in risposta alla presenza di BATTERI
• Da gengivite lieve a parodontite distruttiva
50% popolazione adulta GENGIVITE
30% PARODONTITE ( 3 tasche 4mm)
5-15% PARODONTITE AVANZATA (6 mm)
3-4% parodontite giovanile
• Fattori predisponenti
LA MALATTIA PARADONTALE E’ UNA MALATTIA INFETTIVA
CON EZIOLOGIA BATTERICA.
Ne sono prova:
• La gengivite si sviluppa con un aumento dell’ accumulo della
placca;
• Il tessuto infiammatorio nella gengivite ritorna alla normalità
dopo la rimozione della placca;
• Agenti antibatterici prevengono le gengiviti e possono portare
beneficio nei trattamenti della parodontite;
• Animali di laboratorio infettati con batteri orali specifici hanno
sviluppato parodontite;
• Animali da laboratorio mantenuti in un ambiente sterile non
hanno sviluppato parodontite.
EVOLUZIONE VERSO LE
PARODONTOPATIE
• L’ospite presenta FATTORI DI RISCHIO che
FAVORISCONO L’ACQUISIZIONE DI SPECIFICI PATOGENI ORALI
che si AGGIUNGONO e MODIFICANO IL BIOFILM
• PRODOTTI MICROBICI VIRULENTI INDIRIZZANO LE DIFESE
ORGANICHE VERSO UNA RISPOSTA INFIAMMATORIA:
DISTRUZIONE DEI TESSUTI PARODONTALI
Offenbacher, 1996; Tonetti et al., 1997
FATTORI DI RISCHIO
• cattiva igiene orale
• età avanzata (acquisizione di Gram-negativi >45%)
•
•
•
•
•
•
fumo
diabete
deficienze nell’attività dei PMN
HIV
predisposizione genetica
Stato di stress
Salvi et al., 1997
FATTORI DI CONTENZIONE
• I prodotti batterici attivano l’endotelio:
• Attività antimicrobiche nel fluido crevicolare:
LISOZIMA, C’, FACILITATORI DELLA
PERMEABILITA’ VASALE (chinine)
E-SELETTINA, ADESINE INTRACELLULARI
RECLUTANO PMN CIRCOLANTI
• I prodotti batterici ATTIVANO
DIRETTAMENTE MONOCITI e PMN: BASSI
LIVELLI DI MEDIATORI
DELL’INFIAMMAZIONE (IL – 8 ecc.)
Page et al., 1997
PATOLOGIA DA INFIAMMAZIONE
• I mediatori ATTIVANO I FIBROBLASTI che
producono METALLOPROTEINASI con distruzione di connettivo
e osso
• TNF α causa APOPTOSI
• L’infiammazione aumenta l’AFFLUSSO DI
NUTRIENTI
• Il biofilm si espande e le lesioni progrediscono
Salvi et al., 1997
L’ASSE ANTICORPI-NEUTROFILI
L’INFILTRATO PLASMACELLULARE
caratteristico delle parodontopatie indica lo sforzo
di contenimento basato sulla SINTESI LOCALE
DI Ab e sull’INTERVENTO DEI PMN
Se le difese sono SUFFICIENTI l’infezione è
controllata dal MOMENTANEO DIMINUIRE
della CARICA BATTERICA e dei suoi
PRODOTTI
Salvi et al., 1997
L’EQUILIBRIO INSTABILE
L’espansione delle lesioni stimola
grandemente l’asse Ab-NEUTROFILI
che può LIMITARE I DANNI:
OMEOSTASI
FATTORI DI RISCHIO ALTERANO
L’EQUILIBRIO: ESACERBAZIONI
Salvi et al., 1997
L’EQUILIBRIO INSTABILE
La caduta del dente RIMUOVE UN
ECOSISTEMA DIVENUTO
PERICOLOSO evitando possibili
INFEZIONI SISTEMICHE
Darveau et al., 1997
Potenziale meccanismo di azione batterico
nella parodontite
1. Invasione batterica
2. Produzione di esotossine
3. Produzione di endotossine
4. Produzione di enzimi
5. Risposta immunologica dell’ ospite
PARODONTITE
• Placca supragengivale: prima S. sanguis e A. viscosus
poi S. mutans
• Sito poco esposto all’azione detergente della saliva
(dominano i g+)
• espansione della placca nel solco gengivale,
infiammazione >espansione colonizzano i G-:
F. nucleatum, E. corrodens, V. parvula, C. ochracea, B.
gingivalis, B. intermedius, B. melaninogenicus
• Adesione tra batteri meccanismo principale di
virulenza
PARODONTITE
Crescita e penetrazione dei tessuti
Sviluppo dei batteri a limiti insostenibili per le
difese dell’ospite
produzione di grandi quantità di metaboliti
Tossine da G+ e endotossine da G-
Virulenza
Esotossine
Leucotossina (LT)
di
Aggregatibacter (actinobacillus)
actinomycetemcomitans
uccide i PMN e i monociti
Virulenza
Endotossine
LPS
•
•
•
•
•
citotossicità
attivazione del complemento
grado di tossicità dipendente dal microorganismo
distruzione del tessuto
LPS può interferire con la riadesione dei fibroblasti
Virulenza
Enzimi
Collagenasi
Attiva sul tessuto connettivo
fibre collageno.
Jaluronidasi
Ac. jaluronico, mucopolisaccaride che agisce come cemento
intracellulare nell’epitelio gengivale
la distruzione di questo polimero facilita la diffusione nei
tessuti dei microorganismi
Virulenza
Enzimi
• Molti prodotti extracellulari dei batteri hanno
attività enzimatica sui tessuti.
• Il ruolo di questi è incerto a causa di analoghi
prodotti liberati da PMN e macrofagi.
• fosfolipasi, lecitinasi, fosfatasi, proteasi,
neuraminidasi >membrana delle cellule
Virulenza
Effetti sul midollo
• Tessuto dinamico: deposizione e riassorbimento
• Si ha riduzione della massa midollare (squilibrio)
batteri attivano il complemento
Citochine (prostaglandina E secreta da macrofagi),
LPS e petidog. (LTA) attivano: osteoclast activating
factor (OAF): liberazione di enzimi proteolitici e
idrolitici → riassorbimento osso
Virulenza
Metaboliti batterici
H2S e NH4OH
e vari acidi organici
inibiscono in particolare
la crescita dei fibroblasti
PATOGENI BATTERICI SPECIFICI
DELLE PARODONTOPATIE
Usuale popolazione microbica + ALTE CARICHE DI:
• Aggregatibacter (Actinobacillus) actinomycetemcomitans
• Porphyromonas gingivalis
• Tannerella forsythia (Bacteroides forsythus)
Offenbacher, 1996; Salvi et al., 1997
Aggregatibacter
actinomycetemcomitans
•
•
•
•
Bastoncino immobile, Gram-negativo, saccarolitico;
Anaerobio facoltativo;
Cresce in terreni addizionati di zucchero;
Tendenza a colorazione bipolare, si trova a coppie o
a corta catena
• Morfologia delle colonie: stellata.
• Suddivide in 5 sierotipi il B è caratteristico delle
Parodontiti
A. actinomycetemcomitans
Morfologia stellata delle
colonie.
A. actinomycetemcomitans
• Causa enorme risposta anticorpale: attiva linfociti B
e macrofagi;
• Dopo guarigione da parodontite scompare dai
tessuti;
• Fattori di virulenza: fimbrie, emoagglutinina
(adesiva per epiteli e altre specie), LPS, vescicole
ricche di enzimi (citotossici), collagenasi, proteasi,
gingipaina (demolizione delle Ig), leucotossina
(citotossica per PMN), proteina osteolitica, non
attiva E-selettina (resta invisibile ai PMN)
• È in grado di penetrare e sopravvivere nelle cellule
connettivali, epiteliali e nei cheratinociti.
P. gingivalis
• Produce pigmento nero;
• Bastoncino gram- (pleiomorfo) anaerobio non
fermentante;
• Si trova nella placca subgengivale nelle
parodontiti;
• Produce numerosi fattori di virulenza:
– Fimbrie, LPS, endotossine, capsula.
– Collagenasi, tripsina, cheratinasi, emolisina,
fosfatasi alcalina.
– Ammoniaca, indolo, idrogeno solforato
• Patogeno intracellulare facoltativo.
T. forsythia
• Morfologia fusiforme;
• Anaerobi obbligati;
• Crescita lenta su piastra (nel terreno si deve
aggiungere acido N-acetyl muranico);
• Si trova nella placca subgengivale nelle
parodontiti;
• Fattori di virulenza:
– Fimbrie;
– LPS (endotossico);
– Proteine della membrana esterna.
Ishikawa et al., 1997
PERCHE’ QUESTO TRIO?
• Questi patogeni si ritrovano associati, con cariche
maggiori di 106-108 , agli usuali consorzi esistenti nel
biofilm normale, solo in soggetti sintomatici;
• Esprimono FATTORI DI VIRULENZA propri dei batteri
Gram-negativi;
• Inducono alti livelli anticorpali specifici (assenza di Ab
per altri germi);
• La progressione della malattia è arrestata o rallentata
con l’ eliminazione o riduzione di questi batteri.
Ishikawa et al., 1997
I TRE PATOGENI SPECIFICI
• Producono alti livelli di acidi grassi volatili a corta catena di
carbonio fortemente citotossici
[Tonetti, Botta e Schito, 1993]
Possono invadere l’ epitelio gengivale collocandosi in posizione
intracellulare attivando così pacchetti di geni altrimenti non
espressi.
• Questo meccanismo di patogenicità può essere la base di
reinfezioni dopo trattamenti meccanici o chemioterapici
Liberano vesicole (pseudocellule) che contengono enzimi (LT)
[Darveau et al., 1997]
APPROCCI ALLA TERAPIA
Le parodontopatie sono MALATTIE DA INFEZIONE
• Rimozione meccanica della placca sottogengivale
• misure per prevenire la ricorrenza
• controllo dei fattori di rischio modificabili
• corretta igiene orale
• TRATTAMENTO ANTIBIOTICO AGGIUNTIVO
Page et al., 1997
QUALE CLASSE DI FARMACI?
La scelta dell’antibiotico va basata su
CONSIDERAZIONI MICROBIOLOGICHE
FARMACOCINETICHE
TOLLERABILITA’
FARMACOECONOMICHE
SPETTRO ADEGUATO
ANAEROBI + AEROBI
GRAM + e GRAM –
• Spettro INCOMPLETO: AG, Glicopeptidi, Lincosamidi,
(FQ, Rifamicine)
Metronidazolo
• Spettro IDONEO : (Tetracicline), β-lattamici
(cefalosporine, monobattamici, carbapenemici),
Macrolidi
PROBLEMATICHE CON I β-LATTAMICI
• Miniaturizzazione cellulare (PBP)
• Bassa velocità di replicazione (PBP)
• Patogenicità indiretta: forte produzione di
β-LATTAMASI (>50%) da parte dei batteri
ORALI e della PLACCA
• Fase INTRACELLULARE schermata dei 3
principali patogeni
I β-LATTAMICI POSSONO ESSERE EFFICACI
• Nelle INFEZIONI POLIMICROBICHE vi
è SINERGISMO PATOGENETICO
• L’ERADICAZIONE dei patogeni PIU’
SENSIBILI PUO’ frenare l’espansione di
TUTTA LA COMUNITA’ DEL BIOFILM
• MAGGIOR EFFICACIA DELLE
PENICILLINE PROTETTE
Page et al., 1997
VANTAGGI MICROBIOLOGICI DEI MACROLIDI
• Attività INDIPENDENTE dalla velocità di
replicazione cellulare
• Superano la PATOGENICITA’ INDIRETTA
• PENETRANO NELLE CELLULE dove
possono risultare BATTERICIDI (Legionella,
Chlamydia, i 3 patogeni paradontopatici)
• Pronta inibizione delle sintesi di TOSSINE
VANTAGGI MICROBIOLOGICI DEI
MACROLIDI
• DIFFONDONO più facilmente nella
MATRICE del biofilm
• POTENZIANO l’attività dei PMN in cui
penetrano
• Hanno effetto ANTIINFIAMMATORIO
Macrolidi
Includono la quasi totalità dei batteri di interesse
odontostomatologico nel loro spettro di attività sovente
battericida.
Il fenomeno della resistenza a questa classe di molecole non è
diffuso nei patogeni specifici delle parodontopatie.
Diffusione non solo tissutale ma anche intracellulare. In
questo importante compartimento tali farmaci vengono
attivamente concentrati, raggiungendo livelli più alti di quelli
riscontrati nei fluidi circolanti.
Eritromicina, roxitromicina, miokamicina, josamicina,
spiramicina, claritromicina , fluritromicina e azitromicina sono
state largamente usate anche in campo odontoiatrico
Tetracicline
Le tetracicline sono agenti batteriostatici, con
forte affinità per il tessuto osseo nel quale
possono permanere a lungo causando problemi
estetici. La resistenza microbica a queste antiche
molecole è così diffusa da averne limitato
grandemente il consumo in tutte le infezioni
sistemiche