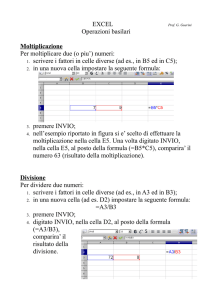
UNIVERSITA’ DEGLI STUDI DI ROMA “LA SAPIENZA”
Facoltà di Ingegneria
Dipartimento di Meccanica ed Aeronautica
Corso di:
MISURE INDUSTRIALI II
del prof. Z. Del Prete
Metodologie di misura
per sistemi a celle a combustibile
Dispense a cura de
l’ing. Pierluigi Schiavetti
Celle a combustibile
Le celle a combustibile (Fuel Cells)
sono sistemi elettrochimici capaci di
convertire l’energia chimica di un
combustibile (in genere idrogeno)
direttamente in energia elettrica,
senza l’intervento intermedio di un
ciclo termico, ottenendo pertanto
rendimenti di conversione più elevati
rispetto a quelli delle macchine
termiche convenzionali.
Corso di MISURE INDUSTRIALI II - AA 2005/2006
2
STORIA DELLE CELLE A COMBUSTIBILE
La prima cella a combustibile fu costruita da Sir William Grove nel 1839 che utilizzò
elettrodi di platino e acido solforico in qualità di elettrolita. In seguito, a partire dal 1890,
William White Jacques utilizzò l’acido fosforico al posto dell’acido solforico. Questi primi
dispositivi erano tuttavia caratterizzati da una bassa densità di corrente (basso
rendimento).
Bacon, dopo il 1930, sostituì l’elettrolita
acido delle prime celle con un elettrolita
alcalino e continuò a sviluppare il sistema
(Cella di Bacon) oggi noto con l’acronimo
AFC (Alcaline Fuel Cells). Le AFC furono
così apprezzate che negli anni ’60 furono
scelte dalla NASA per la missione lunare
APOLLO.
Alla fine degli anni ’50 iniziò l’impiego e lo sviluppo delle PEMFC (Proton Exchange
Membrane Fuel Cell), celle che utilizzano come elettrolita una speciale membrana di
polimeri per lo scambio di protoni. La produzione si sviluppò negli USA e fu utilizzata
dalla NASA per il progetto spaziale GEMINI.
Corso di MISURE INDUSTRIALI II - AA 2005/2006
3
ELETTROLISI DELL’ACQUA
L'acqua viene decomposta nei suoi elementi costituenti, l'idrogeno e l'ossigeno (la presenza del
sale Na2SO4 disciolto serve ad aumentare la conducibilità della soluzione acquosa).
Al polo negativo si ha la riduzione (catodo) dell'acqua con formazione dell'H2 gassoso, mentre
al polo positivo l'ossidazione (anodo) con formazione dell'O2 gassoso.
Anodo (+) : ossidazione
2 H2O →
Catodo (-) : riduzione
4 H2O + 4e- → 4 OH- + 2 H2
Reazione totale del processo:
O2 + 4H+ + 4 e-
2 H2O → O2 (g)
+ 2 H2(g)
Corso di MISURE INDUSTRIALI II - AA 2005/2006
g = gas
4
FUNZIONAMENTO E CLASSIFICAZIONE DELLE FC
AFC
Alkaline Fuel Cell
PEMFC (SPFC)
Proton Exchange Membrane
Fuel Cell
PAFC
Phosphoric Acid Fuel Cell
MCFC
Molten Carbonate Fuel Cell
SOFC
Solid Oxide Fuel Cell
Corso di MISURE INDUSTRIALI II - AA 2005/2006
5
ALCALINE. Efficienza fino al 70%, producono acqua come emissione. Nate sul finire degli anni '30 grazie a
Francis T. Bacon. Nei confronti di altri tipi di celle (ad esempio celle ad acido fosforico), le AFC presentano una
serie di vantaggi:
rendimenti elettrici che possono raggiungere il 65%,
costi non elevati dei componenti costituenti la cella,
tempi di vita lunghi (dimostrate 10.000-15.000 ore) dovuti alla buona compatibilità dei materiali di cella.
La principale limitazione delle AFC è la bassa tolleranza alle impurezze presenti nei gas reagenti.
PEM (Proton Exchange Membrane). Utilizza come elettrolita una membrana plastica. E' molto leggera e lavora a
basse temperature (80°C) con un'efficienza del 40-50%. Può utilizzare, con un reformer, metanolo o benzina. E'
stata inventata dalla General Electric all'inizio degli anni '60 per le Forze Armate americane. In seguito saranno
analizzate più in dettaglio.
ACIDO FOSFORICO. Parte da una efficienza del 40-50% e arriva all'80 con la cogenerzazione. In commercio ce
ne sono da 200 kW. Operano a temperature prossime a 200 °C con un elettrolita costituito da una soluzione
concentrata di acido fosforico. I sistemi che utilizzano questo tipo di celle sono caratterizzati da un'efficienza
elettrica tra il 37 ed il 42% e consentono di disporre di calore ad una temperatura tale da poter essere sfruttato sia
all’interno dell’impianto, che per utenze esterne di cogenerazione. La temperatura di funzionamento della cella è
abbastanza elevata da non richiedere gas di alimentazione estremamente puri, ma non così alta da creare
problemi legati ai materiali.
Corso di MISURE INDUSTRIALI II - AA 2005/2006
6
CARBONATO FUSO. Le celle a carbonati fusi (MCFC, Molten Carbonate Fuel Cell) impiegano un elettrolita
costituito da una soluzione di carbonati alcalini, liquidi alla temperatura di funzionamento della cella (650 °C),
contenuti in una matrice ceramica porosa ed elettrodi a base di nichel (nichel cromo all’anodo, ossido di nichel
litiato al catodo). Rispetto alle celle che operano a bassa temperatura presentano alcuni vantaggi:
cinetiche di reazioni più veloci che eliminano il bisogno di metalli preziosi come catalizzatori;
maggiore flessibilità nell’uso di combustibili, con possibilità di alimentare la cella direttamente con gas naturale o
distillati leggeri senza stadio di riforma esterna del combustibile;
possibilità di cogenerare a temperature d’interesse industriale.
Con esse è possibile, in prospettiva, realizzare impianti con efficienze più elevate (ottenute efficienze > 45%,
possibilità di arrivare al 60-70% in cicli combinati con turbina) di quelle che si registrano con celle a bassa
temperatura. Le alte temperature di funzionamento e l’elevata corrosività dell’elettrolita pongono tuttavia problemi
di stabilità strutturale ai componenti di cella e questi fanno sì che la tecnologia stia incontrando ancora difficoltà ad
affermarsi.
SOFC (Solid Oxide Fuel Cell). Sono considerate le più ricercate tra le pile che usano carburanti basati su
idrocarburi. Infatti risultano semplici, altamente efficienti, tolleranti alle impurità e possono fare il reforming
internamente alla cella. L' elettrolita e' formato da ossido di zirconio stabilizzato con ossido di ittrio; il catodo e'
costituito da manganito di lantanio opportunamente trattato, l'anodo da un cermet a base di nichel-ossido di
zirconio (temperatura media di esercizio: 800-1000 °C). Con una temperatura di funzionamento dell’ordine dei
1000 °C il calore di scarto che le celle ad ossidi solidi mettono a disposizione può essere utilizzato nell’ambito di
cicli in combinazione con turbine a gas. I problemi che restano ancora da risolvere per questa tecnologia sono
essenzialmente legati al degrado dei materiali ed al loro assemblaggio.
Corso di MISURE INDUSTRIALI II - AA 2005/2006
7
PEM: Cella ad elettrolita polimerico
PREGI
Bassa Temperatura di funzionamento
Facilità
minuto)
di
avviamento
(ordine
del
Elevata densità di potenza
Assenza di problemi di corrosione tipici
di altri tipi di celle con elettrolita liquido
Relativa semplicità costruttiva
DIFETTI
anodo :
Scarsa tolleranza alla presenza del CO
nel combustibile
H 2 2 H 2e
catodo :
1 O 2 H 2e H O
2
2 2
difficile integrazione termica fra il sistema
di trattamento del combustibile e lo stack
Corso di MISURE INDUSTRIALI II - AA 2005/2006
8
Come accennato esistono varie tipologie di celle a combustibile, nel caso della trazione
automobilistica il miglior candidato sembra essere quello delle celle ad elettrolita polimerico.
Nella figura sono rappresentati nell’ordine:
1. I piatti bipolari costituiscono gli elementi terminali della cella,
ad essi è possibile collegare il circuito elettrico che utilizzerà la
corrente prodotta dalla cella.
2. La membrana a scambio protonico costituisce l'elettrolita
che permette la migrazione degli ioni.
3. Gli elettrodi rappresentato i siti attivi ove avviene
l'ossidazione dell'idrogeno e la riduzione dell'ossigeno;
l'insieme della membrana e dell'elettrodo viene generalmente
denominato MEA (Membrane Electrode Assembly).
4. Il sistema di guarnizioni assicura la tenuta periferica dei
reagenti e dell'eventuale fluido di refrigerazione.
5. I diffusori dei gas hanno il compito di convogliare i reagenti
in prossimità dei siti attivi, sono costituiti da piccolissimi canali
distribuiti a ridosso dell'elettrodo.
Corso di MISURE INDUSTRIALI II - AA 2005/2006
9
Corso di MISURE INDUSTRIALI II - AA 2005/2006
10
Perché non si permette ai reagenti di
passare direttamente attraverso lo
strato
catalitico?
Perché
è
necessario il substrato elettrodico?
Il substrato, essendo di materiale
poroso, permette l’accesso dei gas
reagenti anche sotto la struttura dei
piatti bipolari. Al contempo esso
fornisce un percorso conduttivo all’area
campita dei piatti bipolari.
I piatti bipolari devono operare un
bilanciamento fra l’alimentazione dei
gas e la conduzione di elettroni. Il
migliore conduttore, un foglio solido
pieno, non permetterebbe nessun
accesso ai gas mentre una struttura
completamente
aperta
non
consentirebbe alla corrente di scorrere.
Corso di MISURE INDUSTRIALI II - AA 2005/2006
11
RICHIAMI DI TERMODINAMICA DELLA CELLA
L’energia disponibile in condizioni di equilibrio (pressione e temperatura costanti) in una
cella è data dalla variazione di energia libera:
G nFErev
dove:
n
F
Erev
H 2 2 H 2e
1 O 2 H 2e H O
2
2 2
numero di elettroni che partecipano alla reazione = 2
costante di Faraday = 96484 C/mol
potenziale reversibile della cella
L’equazione di Nerst consente di determinare il potenziale termodinamico della reazione
completa di ossidoriduzione;
questo potenziale rappresenta la f.e.m. della cella in condizioni di circuito aperto:
p H2 (pO2 )
ΔG
R T
E
ln
2F
2F
p H2O
0
E
Corso di MISURE INDUSTRIALI II - AA 2005/2006
1
2
12
Una cella a combustibile, operante in
condizioni standard, che utilizzi elettrodi ad
idrogeno ed ossigeno a circuito aperto è in
grado di fornire una tensione Erev pari a
1,229V. Quando si ha erogazione di
corrente da parte della cella insorgono
fenomeni di polarizzazione che inducono
sovratensioni
con
conseguente
abbassamento della tensione misurabile agli
elettrodi.
La tensione misurabile assume allora la seguente espressione:
VFC Erev (Vohm Vatt Vcon )
Dove VFC è la tensione ai morsetti della cella e i tre termini mentre Vohm, Vatt, Vcon
riassumono gli effetti di polarizzazione della cella.
Corso di MISURE INDUSTRIALI II - AA 2005/2006
13
Polarizzazioni di cella
Polarizzazione di attivazione
è connessa alla velocità delle reazioni elettrodiche. Nel caso di reazioni elettrochimiche
in cui Vatt è dell’ordine 50-100mV, viene espressa dall’equazione di Tafel:
Vatt
RT
i
ln a b log i
nF i0
RT
log i0
nF
RT
b 2.3
nF
a 2.3
In cui
α = coefficiente di trasferimento di carica
i0 = densità di corrente di scambio
La polarizzazione di attivazione è collegata allo stadio lento della reazione,
contribuiscono a questo tipo di polarizzazione processi che implicano adsorbimento di
reagenti, trasferimento di elettroni verso il doppio strato, desorbimento di prodotti e la
natura della superficie elettronica.
Corso di MISURE INDUSTRIALI II - AA 2005/2006
14
Polarizzazione ohmica
E’ causata dalla resistenza all’avanzamento che incontrano gli ioni nell’attraversare la
membrana e degli elettroni lungo l’elettrodo.
Può essere posta sotto la forma:
Vohm i R
dove R rappresenta la resistenza totale della cella. La perdita più significativa è quella
che si verifica nell’elettrolita e può venire ridotta diminuendo la distanza tra gli elettrodi e
utilizzando elettroliti ad elevata conducibilità ionica.
Polarizzazione di concentrazione
E’ causata da fenomeni di trasporto di massa dei gas reagenti e dei prodotti che
ostacolano le reazioni agli elettrodi: in prossimità di questi, data la loro insufficiente
porosità e la rapidità con cui i reagenti vengono consumati, si generano dei gradienti di
concentrazione che sommati alla difficoltà di diffusione dei gas nell’elettrolita e dei
prodotti da e verso i luoghi di reazione determinano l’insorgere del fenomeno.
Corso di MISURE INDUSTRIALI II - AA 2005/2006
15
La velocità di trasporto di massa può essere descritta dalla prima legge di Fick:
i
nFD
(cb cs )
D
cs
cb
δ
coefficiente di diffusione delle specie reagenti
concentrazione delle specie reagenti nel bulk
concentrazione sulla superficie dell’elettrodo
spessore dello strato di diffusione
Quando l’elettrodo è governato solo da fenomeni di diffusione
si raggiunge una corrente limite iL che è definita come:
Nel caso in cui si assume trascurabile la ηatt, la
polarizzazione di concentrazione è espressa dalla:
Vcon
iL
nFDcb
RT cs RT
i
ln
ln 1
nF cb nF iL
Le polarizzazioni agiscono sempre nel senso di elevare il potenziale dell’elettrodo al
quale decorre la reazione di ossidazione (anodo) e di abbassare il potenziale
dell’elettrodo al quale decorre la reazione di riduzione (catodo). Abbiamo:
VFC Erev Vohm Vatt Vcon
Corso di MISURE INDUSTRIALI II - AA 2005/2006
16
RENDIMENTI DI CELLA
Rendimento termodinamico
Il rendimento energetico di una cella è definito come:
t
Lavoro utile
nH 2 H
In termini di potenza si scrive:
Pe
t
FH 2 H
Pe
nH2
FH2
potenza erogata [W]
numero di moli di idrogeno [mol]
numero di moli al secondo consumate
di idrogeno [mol/s]
entalpia di reazione pari a 284.000 [J/mol]
H
Rendimento di tensione
Nel caso in cui la cella eroga corrente elettrica, la tensione di cella (V) è minore della
tensione che si avrebbe a circuito aperto (Erev). Si definisce rendimento di tensione il
rapporto tra tensione sotto carico e tensione teorica:
V
V
E rev
Corso di MISURE INDUSTRIALI II - AA 2005/2006
17
Fattore di utilizzo del combustibile e rendimento teorico:
N cell I
F
2 Fa
u t
Fr
Fr
Ft
Fa
Ncell
portata di idrogeno teorica [mol/s] (quella che compete alla reazione chimica
associata alla erogazione di corrente da parte della cella)
costante di Faraday = 96484 C/mol = carica elettrica (in Coulomb) associata
ad una
mole di elettroni
numero di celle di cui è costituito lo stack
N cell I
Ft
2F
teorico
N cell I
C
2 96484
mol
VI
VI
kV
N
I
Ft H
cell
H
2 Fa
La costante “2” a denominatore deriva dal
fatto che per ogni mole di idrogeno si
formano due protoni e quindi due elettroni.
Il rendimento teorico di una FC è
direttamente proporzionale alla tensione che
si stabilisce ai sui capi
Corso di MISURE INDUSTRIALI II - AA 2005/2006
18
CELLE AUTO RESPIRANTI (SELF-BREATHING)
La risposta in potenza di una cella a combustibile è limitata dalla portata di aria, dai valori di
pressione dei gas in ingresso e dalla quantità di acqua fornita alla cella stessa. Per eliminare
complicati controlli sul sistema e semplificare al massimo gli schemi impiantistici a volte si sceglie
una cella autoumidificante e autorespirante. Infatti spesso le celle vengono alimentate e controllate
con un compressore regolando la pressione di ossigeno in ingresso ma ciò implica un dispendio
notevole di energia per l’alimentazione. L’autorespirazione dà origine ad un particolare fenomeno
(“oxygen starvation”) che si manifesta quando la pressione parziale di ossigeno scende al di sotto
di un livello critico, in un qualsiasi luogo, all’interno dei canali dell’aria nel catodo. Questo fenomeno
comporta un rapido decremento della tensione di cella, che in casi estremi può anche portare al
danneggiamento della membrana della cella stessa.
Corso di MISURE INDUSTRIALI II - AA 2005/2006
19
CATENA DI MISURA DI UN BANCO PROVA PER UN
SISTEMA DI TRAZIONE A CELLE A COMBUSTIBILE
• Linea Idrogeno
Motore
Torsiometro
Freno
• Parte Elettrica
• Parte Meccanica
Elettronica di controllo
e acquisizione
Modulo
Fieldpoint
Parametri monitorati:
• Tensione e corrente erogate
Termocoppie
• Flusso H2
Aria
• Temperatura stack
Calcolatore
con scheda di
acquisizione
H2 in
• Velocità angolare albero motore
Cella a
combustibile
autorespirante
Ventole
H2
• Coppia torcente
• Potenza assorbita ausiliari
• Rendimenti
Manometro
Regolatore di
pressione
Corso di MISURE INDUSTRIALI II - AA 2005/2006
Flussimetro
20
Cella a Combustibile
Caratteristiche:
Potenza: 150W @ 15V
Reagenti: idrogeno/aria
P idrogeno: 2 psig
T: 58°C
Tipo di cella: PEM
Motore Elettrico
brushless
Encoder
Freno
Torsiometro
Corso di MISURE INDUSTRIALI II - AA 2005/2006
21
Programma di acquisizione in LabView
Set Up
Acquisizione
Monitoraggio
Banco Prova
Parametri Corrente Potenza
Tensione
Potenza
controllo
PID
erogata
erogata Setelettrica
Up FieldMeccanica
erogata
dalla cella dalla cella
Point
Forzanti
Set Up
Canali di
Controllo
Acquisizione
velocità ventole
Rpm
Comando
acceleratore
Misura
di
Set Up Temperatura
coppia
Parametri
cella
Temporali Potenza
richiesta
Grafici della
dagli
Set Up Rendimenti
velocità
angolare
ausiliari
monitorati
Parametri
dell’albero
motore
eSalvataggio
velocità
di set
Portata
di H2
point
Corso di MISURE INDUSTRIALI II - AA 2005/2006
22
Corso di MISURE INDUSTRIALI II - AA 2005/2006
23
Caratterizzazione statica
Motore
Cella a combustibile
25
50
40
Voltage [V]
60
20
180
Experimental Power curve
54.9
motore [%]
70
200
Experimental V-I Plot
Rendimento motore-giri al minuto
52.7
52.8
50.3
48.7
51.9
49.3
160
45.2
48.2
45.5
45.
140
45.5
44.5
15
42.6
42.2
42.0
120
44.8
42.3
41.8
Tmed=46°C
44.5
10
30
100
80
60
20
5
40
10
20
Rpm
0
0
0
1000
2000
3000
4000
• Rendimento elevato ad alti giri
• Penalizzazione nel ciclo urbano
5000
0
0
1
2
3
4
5
6
7
8
Current [A]
9
10
11
12
13
14
• Rendimento abbastanza costante
in ampio range di potenze
• Lieve diminuzione del rendimento
ad elevate potenze
• Tempo di avvio rapido (circa 5 min)
Corso di MISURE INDUSTRIALI II - AA 2005/2006
24
Power [W]
Rendimento del
80
Ciclo urbano standard
Calcolo del rendimento
del sistema
cella + motore elettrico
Ciclo Urbano Standard
Norma UNI-EN 1986-1
2500
velocità albero
Velocità angolare [giri/min]
velocità di setpoint
2000
1500
1000
500
0
0
20
40
60
80
100
120
140
160
180
200
tempo [s]
Corso di MISURE INDUSTRIALI II - AA 2005/2006
25
Risultati sperimentali
Rendimento medio
Rendimento istantaneo
We
F H
W t
W
E
W
H F t H F H F H
i
i
i
nH 2
tot
i
i
i
i
tot
i
Incertezze associate:
W
1
W F
W 2
F
W
F
F H
F H
2
2
2
2
2
2
2
1
W
Wtot
Ftot
Wtot 2 tot Ftot
Ftot H
Ftot H
Wtot
Ftot
dove :
W
tot
i
2
Wi
F
tot
2
2
Fi
i
Corso di MISURE INDUSTRIALI II - AA 2005/2006
26
Potenza meccanica all’albero:
Wmecc C W
Rendimento meccanico istantaneo:
mecc
Wmecc
F H
Rendimento meccanico medio:
mecc
E
nH 2 H
W t W
F t H F H
i mecc
i
i
i
mecc tot
tot
Corso di MISURE INDUSTRIALI II - AA 2005/2006
27
TECNOLOGIE DI STOCCAGGIO IDROGENO
Idrogeno compresso
Il modo più semplice ed economico per accumulare idrogeno a bordo di un veicolo è di utilizzarlo sotto forma di gas compresso a
pressione di 200-250 bar.
La tecnologia risulta tuttavia non proponibile per uso a bordo di auto tradizionali, a causa del peso ed ingombro dei serbatoi
attualmente utilizzati, che rappresentano un limite all'autonomia e capacità di carico del veicolo. Di recente notevoli progressi sono
stati fatti con l'introduzione di serbatoi con liner metallico o termoplastico rinforzati con fibre di carbonio, di vetro ed aramidiche, che
presentano un peso 3-4 volte inferiore a quello dei comuni serbatoi, e che consentono quindi di superare in parte le restrizione
connesse all'uso delle bombole di tipo tradizionale. Questi serbatoi sono in grado di operare a pressioni fino a 350 bar
(potenzialmente anche 700 bar) e consentono quindi di ottenere densità di accumulo di idrogeno adeguate all'uso a bordo di veicoli.
Le caratteristiche di sicurezza sono solitamente molto elevate, grazie alla robustezza dei serbatoi ed all'introduzione di fusibili
antiscoppio in caso di incendio e di valvole di interruzione del circuito in caso di urto.
Per quanto riguarda normative di sicurezza e licenze per usi a bordo di veicoli, le bombole di idrogeno sono soggette a restrizioni
analoghe a quelle adottate nel caso del gas naturale.
Idrogeno liquido
L'idrogeno può essere stoccato a bordo del veicolo in forma liquida ad una temperatura di -253 °C.
Per mantenere queste temperature sono stati messi a punto serbatoi a doppia parete, con
un'intercapedine ove viene fatto il vuoto (serbatoi tipo “dewar”) Questa tecnologia è ormai
consolidata in Germania, dove la BMW la utilizza da oltre 15 anni su auto ad idrogeno alimentate
con motori a combustione interna.
L’accumulo in forma liquida è forse la tecnologia che oggi meglio soddisfa le esigenze
dell’autotrazione, tuttavia anch’essa presenta dei limiti. A sfavore dell’idrogeno liquido giocano la
maggiore complessità del sistema, non solo a bordo del veicolo ma anche a terra, per la
distribuzione ed il rifornimento, ed i maggiori costi ad esso associati. Anche il costo energetico della
liquefazione è considerevole, corrispondendo a circa il 30% del contenuto energetico del
combustibile, contro un valore compreso tra il 4% ed il 7% per l’idrogeno compresso.
Nel quadro delle attività del Progetto H2MUC è stata realizzata, presso l'aeroporto di Monaco di
Baviera, la prima stazione di servizio pubblica in grado di fornire idrogeno liquido.
Corso di MISURE INDUSTRIALI II - AA 2005/2006
28
Idruri metallici
L’idrogeno può legarsi chimicamente con diversi metalli e leghe metalliche, formando idruri. Questi composti sono in grado di
intrappolare idrogeno, a pressioni relativamente basse. L'idrogeno penetra all'interno del reticolo cristallino del metallo, andando ad
occupare i siti interstiziali.
Si raggiungono, a basse pressioni, densità energetiche maggiori di quelle dell’idrogeno compresso e paragonabili (secondo alcune
referenze, anche maggiori) a quelle dell’idrogeno liquido. Il volume di stoccaggio si riduce di 3-4 volte, rendendo possibile l’uso di
questi sistemi nelle autovetture, mentre l’energia specifica dipende anche dal peso specifico del metallo di base. Le percentuali, in
peso, di idrogeno sul peso totale che si raggiungono vanno dal 1% al 12,7% (LiH), per confronto ricordiamo che per le comuni
bombole tale percentuale è di poco superiore all’1%, e quindi tali sistemi di stoccaggio sono potenzialmente molto promettenti.
Un punto debole della tecnologia è rappresentato dal peso di questi sistemi di accumulo, a parità di peso il veicolo presenta
un'autonomia tre volte inferiore a quella ottenibile con idrogeno liquido o idrogeno compresso con serbatoi di tipo avanzato. Sono
invece indubbi i vantaggi in termini di convenienza, compattezza, stabilità dello stoccaggio, sicurezza intrinseca.
La tecnologia degli idruri è allo studio negli Stati Uniti, in Europa ed in Giappone, dove la Toyota ha messo a punto speciali leghe al
titanio, nell’ambito del suo programma di realizzazione di veicoli con celle a combustibile.
Di recente interessanti i risultati sono stati ottenuti dalla Ovonic, che sta sviluppando una lega a base di magnesio, leggera, con
un'elevata capacità di stoccaggio idrogeno (7% in peso, Tdesorb.: 300 °C).
Densità gravimetrica dell'energia:
Percentuale di energia erogata da una cellula o da
una batteria in funzione del suo peso (Wh/kg).
Questo termine è utilizzato indifferentemente al posto
di quella di energia specifica
Corso di MISURE INDUSTRIALI II - AA 2005/2006
29
Metodologie di produzione di H2 a bordo
Reattori catalitici a membrana
volume di accumulo
idrogeno alla cella
alimentazione
gas di coda
membrana
pellets di catalizzatore
Corso di MISURE INDUSTRIALI II - AA 2005/2006
30
Impianto di produzione di idrogeno
Corso di MISURE INDUSTRIALI II - AA 2005/2006
31
Corso di MISURE INDUSTRIALI II - AA 2005/2006
32
Misure di permeazione delle membrane
Legge di Sievert (regime diffusivo)
J Q
Legge lineare (regime “chimico” superficiale)
J K p1 p2
Corso di MISURE INDUSTRIALI II - AA 2005/2006
p1 p2
33
Riferimenti bibliografici
Ronchetti M. Iacobazzi A., Celle a Combustibile, Stato di sviluppo e prospettive della
tecnologia, ENEA,2002
Hoogers G., Fuel cell technology handbook, CRC Press, 2003
Corso di MISURE INDUSTRIALI II - AA 2005/2006
34