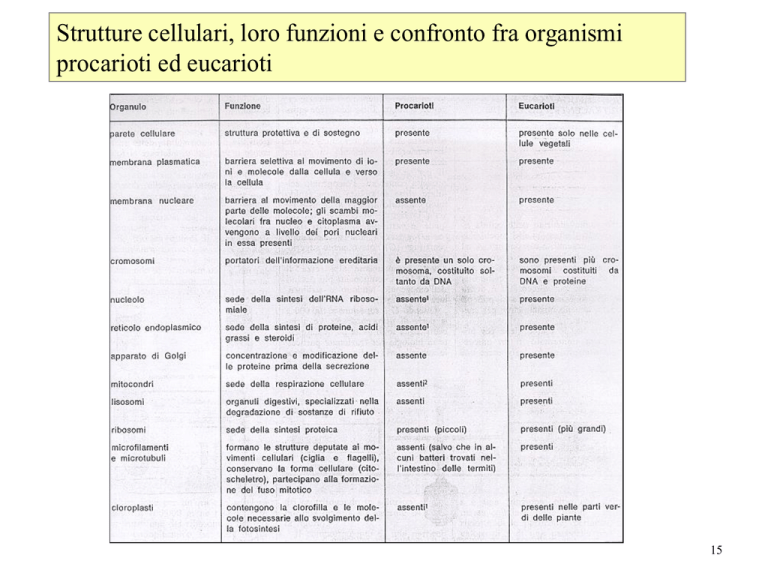
Strutture cellulari, loro funzioni e confronto fra organismi
procarioti ed eucarioti
15
Colture di cellule e di tessuti
animali
• Gli esperimenti biologici si possono
condurre sia su organismi interi che su
organi e tessuti animali isolati. Lavorando
su tessuti e organi gli esperimenti in
genere sono a breve termine, poichè è
necessario mantenere il tessuto il più
possibile in uno stato simile a quello
fisiologico.
Perfusione
• Le colture cellulari durano più a lungo e
permettono una varietà di studi che con i tessuti
non è possibile. In ogni caso sia i tessuti che le
colture si possono utilizzare per diversi scopi
che riguardano:
• -lo studio del differenziamento cellulare (ciclo
cellulare)
• -studi patologici;
• -modelli sperimentali in biochimica, farmacologia,
fisiologia;
• -manipolazione genetica;
• -applicazioni biotecnologiche
Colture primarie e secondarie
• Per colture primarie si intendono quelle colture ottenute
da cellule provenienti direttamente dal tessuto, da
embrioni, da cellule adulte in sospensione o da tumori. In
genere contengono una miscela relativamente
eterogenea di cellule in differenti stati fisiologici. Vi sono
cellule che possono crescere in sospensione o adese ad
un matrice artificiale tipo la plastica ma anche al
collagene.
• Le colture secondarie sono subcoltivazioni di colture
primarie che si rendono necessarie quando le cellule
giungono a confluenza ovvero coprono completamente
la matrice a cui sono adese.
Curva di crescita
•
•
•
-la fase lag
- la fase log
m = 3.3(log Nx - log No) / (tx - to)
– No numero cellule iniziali al tempo to
– Nx numero cellule al tempo tx ;
m è espresso in ore h-1
•
E’ noto che i procarioti crescono con scissione binaria, mentre gli eucarioti
per divisione mitotica. In entrambi i casi la cellula si divide per dare origine
ad altre due cellule. Pertanto, il tempo di raddoppiamento o di
generazione sarà dato da:
•
•
•
g = 0.301 (tx – to) / log Nx – log No
-la fase stazionaria
-la fase di declino
Log numero di cellule vive
stazionaria
declino
log
lag
tempo
Conservazione delle cellule: la
crioconservazione
• Il congelamento in azoto liquido è il metodo
preferito per la maggior parte delle cellule
eucariotiche, in queste condizioni a -196°C
• la vitalità cellulare sia mantenuta per il periodo
durante il quale il campione è conservato in
azoto liquido.
• La velocità con cui il campione viene congelato
è molto importante
• lenta diminuzione della temperatura
• Uso di agenti crioprotettivi (DMSO, PEG)
Conta delle cellule al microscopio
• aspirare il terreno liquido
• lavagio con 5 ml di 1x PBS sterile (Phosphate Buffer Saline :
KH2PO4 0.017M, Na2HPO4 0.05M, NaCl 1.5M);
• trattare le cellule con tripsina (precedentemente riscaldata a 37°C);
• aggiungere 4-5 ml di terreno
• trasferire la sospensione cellulare in un tubo batteriologico;
• 10ml di cellule di questa sospensione con 10 ml di soluzione Trypan
Blue (diluizione 1/2). (Il colorante entra nelle cellule morte che
risulteranno colorate di blu e quindi potranno essere riconosciute ed
escluse dal conteggio)
• 10ml di miscela ed un vetrino reticolato al microscopio ottico
(quadrato grande = 0.1 ml)
• contare le cellule vive (non colorata il blue) presenti in un quadrato.
Per avere una misura statisticamente attendibile è necessario fare
una media tra più quadrati;
• aliquotare le cellule in base al numero di cellule che servono
Cellula morta
•
•
•
•
•
100 cellule media di più quadrati
100 x 10 = 1.000
1.000 x 2 =2.000 (diluizione)
2.000 x 1000 = 2.000.000 cellule
2.000.000 x ml totale delle cellule












