FMI - 2002/2003 - 1
Fisica dei Materiali I
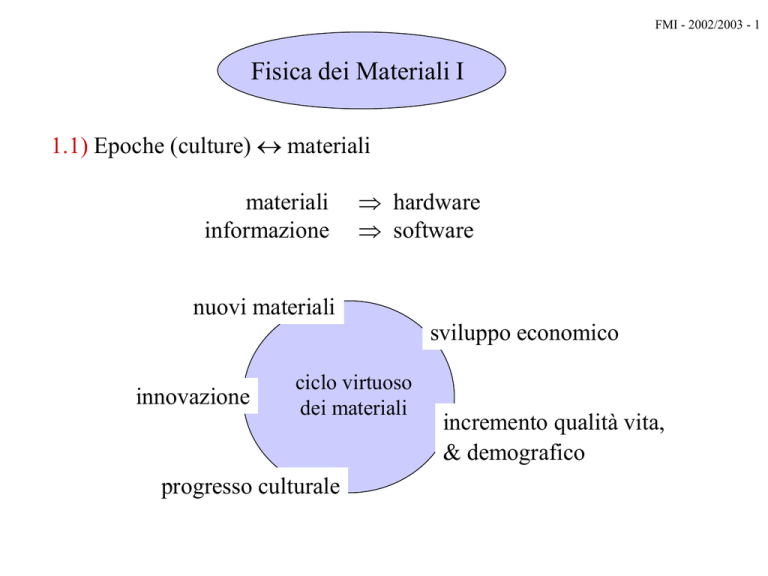
1.1) Epoche (culture) materiali
materiali
informazione
hardware
software
nuovi materiali
sviluppo economico
innovazione
ciclo virtuoso
dei materiali
progresso culturale
incremento qualità vita,
& demografico
FMI - 2002/2003 - 2
Sviluppo delle tecnologie:
- dall’antichità: alterazione materiali naturali (lavorazione meccanica,
fusione, cottura, concia, etc.); proprietà funzioni
- scienza moderna: rivoluzione industriale, chimica, meccanica
quantistica; struttura proprietà performance/funzioni
1.2) Scienza vs. Ingegneria dei Materiali
scienza
performance
valore economico
V.A.
ingegneria
proprietà
processing
struttura
costi
(produzione,
smaltimento)
atomica/
molecolare
Struttura
cristallina
amorfa
nanostrutturata
cluster
mono-, policristallina
mono-, polifasica
composita
elettronica
nanometrica
Meccaniche & tribologiche
Elettriche & magnetiche
Termiche
Ottiche
Chimiche & nucleari
Proprietà
mesoscopica
Performance/funzione
Valore = performance
*durata/obsolescenza
(usura/innovazione)
metalli & leghe
semiconduttori
polimeri & organici
integrati
compositi
biomateriali
ceramici & vetri
FMI - 2002/2003 - 3
Crommie 1995
STRUTTURA ATOMICA & LEGAME INTERATOMICO
Atomo:
mp mn 1.67 · 10-27 kg
me = 9.11 · 10-31 kg
Nucleo = A nucleoni = Z protoni + N neutroni : A = Z + N
Elementi chimici: El Z proprietà chimiche
Isotopi di El: stesso Z, diversi N
A El
con N Z
Masse:
M (AEl) A · amu
Unità:
1 amu 1g / (numero d’Avogadro = 6.023 · 1023)
dove
amu 1/12 M (12C)
1 mole = 6.023 · 1023 atomi (molecole)
1 amu/atomo (molecola) 1 g/mole
FMI - 2002/2003 - 4
Gli elettroni (elementi di meccanica quantistica):
ogni oggetto microscopico = corpuscolo + onda
onda
particella
relazioni
lunghezza d’onda
frequenza
velocità v =
quantità di moto p = mv
energia E = mv2/2
velocità v = dE/dp
p = h / (de Broglie)
E = h (Planck)
E = hv/ = vp
h = 6.63 · 10-34 J s = costante di Planck
L’atomo di idrogeno e gli altri atomi:
e-
se questo è il percorso dell’onda, essa deve raccordarsi su se stessa:
p+
r
2r = n = nh/mv n = intero
(modello di Bohr)
FMI - 2002/2003 - 5
Livelli energetici discreti (spiegano gli spettri atomici!): come?
eguaglia l’attrazione coulombiana alla forza centripeta:
e2/(40 r2) = mv2/r
rn = n2h20/(me2) = n2a0
a0 h20/(me2)
En = - e2/(80 rn) = - Ry /n2
raggio di Bohr (calcolare)
n intero!
Ry me4/(802h2) costante di Rydberg (calcolare)
momento angolare secondo Bohr: L = mvr = mv·nh/(2mv)
n
ma in 3 dimensioni? eq. di Schrödinger:
L l (l 1)
l 0, 1... n 1
Lz ml
ml l , l 1, .... l 1, l
per ogni n si hanno
n2 stati in tutto (provare)
FMI - 2002/2003 - 5
Spin
L’elettrone ha anche un momento angolare intrinseco, detto di spin, con due
soli valori della componente z, su o giù:
3
1
1
S
S
(numero quantico s = /2)
z
2
2
Perciò l’n-esimo livello contiene
2n2 stati diversi, e costituisce una shell
n=1
n=2
n=3
n=4
2 stati
8 stati
18 stati
32 stati
I valori di l denotano le sotto-shell:
l=0
l=1
l=2
l=3
2 stati
6 stati
10 stati
14 stati
shell K
shell L
shell M
shell N . . .
sottoshell
sottoshell
sottoshell
sottoshell
s
p
d
f...
Notazione delle sotto-shell (n,l): 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f, … etc.
Questi “numeri magici” spiegano
la Tavola di Mendeleev …
He:
Ne:
Ar:
Kr:
Xe:
Rn:
2
2 + 8 = 10
2 + 8 + 8 = 18
2 + 8 + 8 + 18 = 36
2 + 8 + 8 +18 +18 = 54
2 + 8 + 8 +18 + 18 +32 = 86
… con le regole di riempimento seguenti:
Z
1) un solo elettrone su ogni stato (n, l, ml , ½): principio di esclusione di Pauli
2) secondo la sequenza 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p . . .:
effetto centrifugo
3) Stot max, Ltot max,
Jtot min (s-shell semivuota) o max (s-shell semipiena) : regole di Hund
Stot = S1 + S2 + S3 +…
Ltot = L1 + L2 + L3 +…
Jtot = Stot + Ltot












