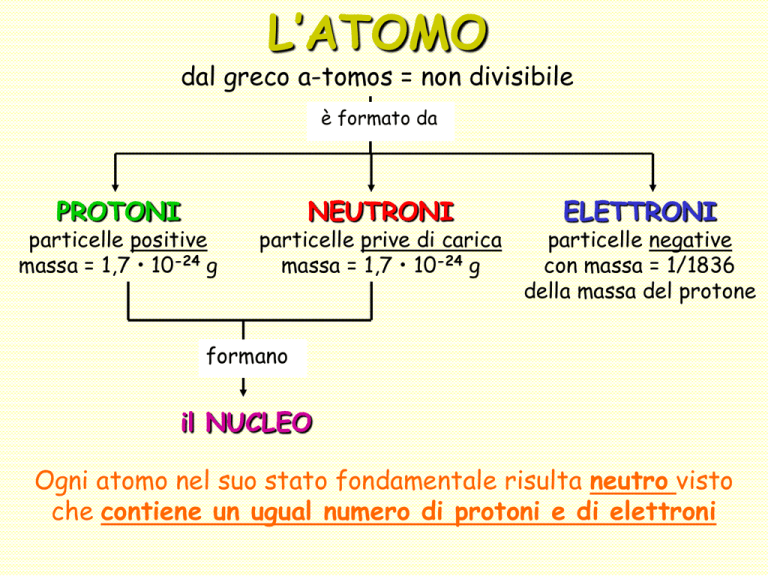
L’ATOMO
dal greco a-tomos = non divisibile
è formato da
PROTONI
particelle positive
massa = 1,7 • 10-24 g
NEUTRONI
particelle prive di carica
massa = 1,7 • 10-24 g
ELETTRONI
particelle negative
con massa = 1/1836
della massa del protone
formano
il NUCLEO
Ogni atomo nel suo stato fondamentale risulta neutro visto
che contiene un ugual numero di protoni e di elettroni
I NUMERI DELL’ATOMO
Z = numero atomico
= n° PROTONI
A = numero di massa
= somma dei PROTONI
+ NEUTRONI
SIMBOLOGIA
Numero di massa A
Numero atomico Z
35
17
Cl
( CLORO)
Quindi l’atomo di Cloro possiede:
17 protoni
17 elettroni
35 – 17 protoni = 18 neutroni
ESERCIZI0
Un atomo possiede:
Z = 12 e A = 26
Quanti elettroni possiede? …………
Quanti neutroni? ……….
LA TAVOLA PERIODICA DEGLI ELEMENTI
ISOTOPI
Sono atomi di uno stesso elemento
chimico che hanno uguale numero atomico
ma diverso numero di massa
quindi
Hanno:
ma:
stesso numero di protoni
diverso numero di neutroni
ESEMPIO
12
Isotopi
C
6
ha 6 protoni
6 neutroni
naturali
del carbonio
14
C
6
ha 6 protoni
8 neutroni
Comportamento degli atomi
Nel corso delle normali reazioni
chimiche gli atomi possono modificare
solo il n° degli elettroni, mentre il n°
dei protoni e dei neutroni rimane fisso
Solo nelle reazioni di fusione nucleare,
che avvengono nelle stelle, si modifica il
n° dei protoni e dei neutroni di un atomo
Dagli atomi alle molecole
Gli atomi, tranne i gas nobili, sono instabili
per cui si uniscono tra loro a formare
molecole per raggiungere la stabilità.
Molecole formate da atomi tutti uguali
formano sostanze elementari dette
elementi
Molecole formate da atomi diversi fra
loro formano sostanze composte dette
composti
ESEMPI
Atomo di ossigeno
O
Atomo di idrogeno
H
Un atomo di ossigeno si lega a due atomi
di idrogeno per formare una sostanza,
l’acqua, che essendo formata da atomi
diversi è un composto
MOLECOLA DI ACQUA
Legame chimico,
ovvero forza che
unisce due atomi
O
H
H
Ciascuno dei tre atomi che forma la
molecola d’acqua ha raggiunto la stabilità
legandosi con gli altri due. Si tratta di un
composto
Molecola di ossigeno
gas dell’aria che respiriamo
Doppio legame
O
O
Ciascuno dei due atomi che forma la
molecola di ossigeno gassoso ha raggiunto la
stabilità legandosi con l’altro. Si tratta di un
elemento
IL LEGAME CHIMICO
GLI ATOMI TENDONO A LEGARSI SPONTANEAMENTE
FRA DI LORO
OGNI QUAL VOLTA QUESTO PROCESSO PERMETTE
LORO DI RAGGIUNGERE UNA CONDIZIONE DI
MAGGIORE STABILITA’ ENERGETICA.
QUESTO PROCESSO
DA’ LUOGO AL LEGAME CHIMICO
Regola dell’ottetto
Gli atomi raggiungono la stabilità con 8
elettroni nel livello energetico più
esterno.
Fanno eccezione Idrogeno ed Elio che
raggiungono la stabilità con soli 2
elettroni nel livello energetico più
esterno
Gli atomi in pratica tendono ad
assumere la configurazione
elettronica dei gas nobili
• Tutti gli atomi quindi interagiscono tra di
loro a formare molecole. L’eccezione sono i
gas nobili, monoatomici
• Teoria di Lewis:
– Gli elettroni esterni, di valenza, sono
quelli implicati nel legame chimico
– Se gli elettroni vengono trasferiti si ha
legame ionico
– Se gli elettroni sono in compartecipazione
si ha legame covalente
Il tipo di legame dipende dalla
differenza di
ETTRONEGATIVITA’
tra gli atomi
ETTRONEGATIVITA’ = CAPACITA’ DI UN
ATOMO DI ATTIRARE UNA COPPIA DI
ELETTRONI DI LEGAME
Il legame ionico si stabilisce per una
differenza di elettronegatività > 1,7
GLI IONI
Uno IONE è un atomo dotato di carica
se
positiva
si chiama CATIONE
si chiama ANIONE
es.
es.
Na
negativa
+
Cl
-
Dall’atomo allo ione
Un atomo diventa uno ione
positivo
se
perde elettroni
perché perde
cariche negative
negativo
se
acquista elettroni
perché acquista
cariche negative
Dall’atomo allo ione negativo
Un atomo inizialmente neutro quando acquista elettroni
diventa carico negativamente perché le cariche negative
degli elettroni superano quelle positive dei protoni
ES.:
17
Cl possiede 17
17
+
-
(protoni)
(elettroni)
se acquista 1 elettrone
passa a 17
+
-
(protoni)
18
(elettroni)
_____________________
tot.
1
-
17
Cl
-
Dall’atomo allo ione positivo
Un atomo inizialmente neutro quando perde elettroni
diventa carico positivamente perché le cariche positive
dei protoni superano quelle negative degli elettroni
ES.:
11
Na possiede 11
11
+
-
(protoni)
(elettroni)
se perde 1 elettrone
passa a 11
+
-
(protoni)
+
Na
10
(elettroni)
_____________________
tot.
1
11
+
Il sodio diventa stabile cedendo il suo elettrone
esterno, il cloro accettando l’elettrone del sodio
L’attrazione elettrostatica tra la carica positiva
del sodio e la carica negativa del cloro
rappresenta il legame ionico
In realtà più ioni sodio e cloro si
legano a formare un reticolo
tridimensionale formando un
composto ionico
ESERCIZI0
Considera la seguente specie chimica:
8O
--
Sapendo che possiede 10 neutroni:
Quanti protoni possiede? ………
Quanti elettroni? …………
Qual è il suo numero di massa? ………












