‘’Non vorrei dare scandalo ricordando qui ‘’La scienza in
cucina e l’arte del mangiar bene ‘’ di Pellegrino Artusi, altro
uomo di cuore puro, che non si nasconde la bocca dietro la
mano: non posa a letterato, ama con passione l’arte della
cucina, spregiata dagli ipocriti e dai dispeptici, intende
insegnarla, lo dichiara, lo fa con semplicità e la chiarezza di
chi conosce a fondo la sua materia ed arriva
spontaneamente all’arte.’’ L’altrui mestiere – Primo Levi
La chimica
in cucina
Giuseppe Valitutti
Università di Urbino
email: [email protected]
Osmazoma e Umami
1.
2.
3.
4.
5.
L’Osmazoma è il cosiddetto principio odoroso dei brodi.
L’Umami è il sapore del glutammato monosodico.
La preparazione del brodo non è così semplice.
La carne contiene più di cento composti sapidi o aromatici.
Il principale sito di stoccaggio degli aromi è il grasso. Le molecole
degli aromi sono solubili nel grasso (Brillat-Savarin).
6. L’aroma, durante la bollitura, si ripartisce fra grasso e acqua
(ripetute estrazioni in corrente di vapore e ripartizioni acquagrasso).
7. L’acqua scioglie una parte dell’osmazona.
8.
Per avere un buon brodo s’inizia con l’acqua fredda e si riscalda lentamente,
affinché l’albumina non si coaguli all’interno della carne, prima di essere estratta;
l’ebollizione deve essere lieve e appena percepibile.
9. La carne adatta per un buon brodo è quella del muscolo di manzo.
Osmazoma e Umami
10. I muscoli sono composti da due proteine essenziali alla contrazione,
l’actina e la miosina racchiuse nelle fibre di collagene.
11. Durante la cottura il collagene passa progressivamente nel brodo e
si trasforma in gelatina.
12. Molte molecole volatili aromatiche sapide non lasciano il brodo ma
reagiscono nella reazione di Maillard e arricchiscono il brodo.
13. La tenerezza, accoppiata con la sapidità, si conservano nella cottura
a bassa temperatura.
14. Nel barbecue texano la carne, posta sulla graticola in un grande
bidone pieno di brace, cuoce per circa due giorni a 70 °C.
Anolini
1. Fondere, in una grande casseruola di terracotta o di
acciaio, 100 g di burro e fare appassire un trito di 1
cipolla, 1 carota, 1 gambo di sedano.
2. Per ½ ora si rosola la carne (1 kg di noce di manzo) nel
trito + 2 chiodi di garofano + pepe macinato.
3. Al termine della rosolatura si versa sulla carne 1
cucchiaio raso di concentrato di pomodoro.
4. Si ricopre la carne con un buon brodo di manzo e si
calcolano le 10 ore di cottura.
5. Si incoperchia il recipiente e si riscalda con fiamma
bassissima. Le ripetute estrazioni vapore-acqua-grasso
arricchiscono il brodo di sostanze aromatiche.
Anolini
6. Dopo ogni ora si gira la carne, si controlla il brodo e si
versa sulla carne 1 cucchiaio di buon barolo.
7. Al termine delle 10 ore, la carne è sfilacciata (si separa dal
sugo, si spreme e si elimina) e il sugo denso si versa caldo
in una zuppiera, contenente 1 scodella grossa di pane
bianco di casa secco e grattugiato, senza la crosta.
8. Al pane ‘’scottato’’ si aggiungono 2 scodelle di ottimo
parmigiano grattugiato fresco + 2 o 3 uova intere, sale,
una grattugiata di noce moscata.
9. Si mescola per avere un impasto consistente, sodo,
omogeneo, che servirà per riempire la sfoglia sottile. Gli
anolini , alla fine, avranno la forma di piccoli agnolotti.
10. Si servono in un ottimo brodo.
Il fondo bruno
1. Dal macellaio si comprano circa 3 kg di ossa bianche (garretto) di
vitello o di vitellone, tagliate in dischi.
2. Le ossa si pongono al forno (180 °C) per la rosolatura; controllare
che il bianco delle ossa abbia assunto una leggera colorazione di
crosta di pane.
3. In questa fase si sviluppa un cattivo odore, che bisogna
sopportare.
4. Il grasso, prodotto dalla tostatura, viene scaricato nel bagno
mentre le ossa sono raccolte in una grossa pentola, contenente 5
litri d’acqua.
5. Nella pentola si versano anche tante verdure e odori: sedano,
porro, cipolle, carote, prezzemolo 2 chiodi di garofano, grani di
pepe, rosmarino, salvia, 1 pomodoro.
6. Si porta a leggera ebollizione e si mantiene la fiamma bassa per
complessive 8 ore.
Il fondo bruno
7. Dopo 8 ore si filtra e si eliminano tutti i materiali solidi. Il liquido si
conserva in frigorifero, in un recipiente adeguato, sino al giorno
dopo.
8. Il grasso solido, che galleggia sulla gelatina scura, viene
accuratamente eliminato.
9. Il brodo rimasto si pone in una pentola e si concentra all’ebollizione,
dopo avervi versato 1 bicchiere di Marsala secco.
10. Si raccoglie, infine, circa 1 litro di fondo bruno (colore crosta di
pane). Il fondo si sala, dopo averlo assaggiato. Il fondo ha un
sapore dolce amaro.
11. Il fondo bruno si conserva in freezer in piccoli recipienti di vetro.
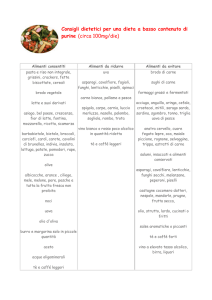
Coefficiente di ripartizione: governa l’equilibrio fra fase acquosa e
grassi.
Metodi per la conservazione dei cibi
ConservaCome funziona
zione
In scatola
I cibi sono sigillati nei contenitori (metallici, vetro, …) e
quindi si riscaldano sopra i 100°C. A quella temperatura,
mantenuta per circa 30 minuti, I batteri muoiono.
Congelamento A basse temperature l’azione enzimatica rallenta e i cibi
a -18 °C
non sono degradati. I microbi non muoiono alle basse
temperature, pertanto le derrate alimentari congelate
devono essere cotte, prima di essere mangiate.
Disidratazione/ La rimozione dell’acqua dai cibi, per esempio al sole
liofilizzazione (pomodori, zucca a rondelle, stoccafisso), disidrata pure i
batteri che muoiono. Le tossine, eventualmente già
presenti, non sono eliminate dalla disidratazione a bassa
temperatura (liofilizzazione).
Conservazione L’aceto abbassa il pH e limita lo sviluppo dei batteri.
sotto aceto o
Analogamente agisce il sale, che disidrata i batteri e ne
sotto sale
provoca la morte.
Marmellate
L’alta concentrazione di zuccheri nelle marmellate disidrata I
batteri che muoiono.
Affumicatura
Il fumo contiene aldeide formica che uccide I batteri. Questo è
il più antico sistema di conservazione delle derrate alimentari.
Conservanti
L’uso dei conservanti viene sconsigliato dalle nuove leggi
sulla chimica sostenibile.
ESTRAZIONE IN CORRENTE DI VAPORE
Il materiale odoroso (15 g) triturato (petali di rosa, anice
stellato, chiodi di garofano, dragoncello, cannella, ecc...), si
unisce al pallone semipieno d’acqua. Si porta all’ebollizione e
si raccoglie il distillato. L’olio profumato si separa dall’acqua
nell’imbuto separatore. L’olio si disidrata su solfato di sodio
anidro.
CH2-CH=CH2
H
C
O CH3
Anetolo
(Anice stellato )
OH
H
CH3O
Estragolo (Dragoncello)
H
O-CH3
CH2-CH=CH2
Eugenolo (chiodi di Garofano)
C
CH3
O
C
CH
CH3
Cuminaldeide (semi Cumino)
H3C
Zafferano
Spiegare la struttura dei terpeni (C10 ), sesquiterpeni (C15 ),
diterpeni (C 20 ) come composti multipli dell’isoprene C5H8 .
Investigazione: l’effetto
dell’enzima sull’urea
• Come si estrae l’ureasi dalla soia
1. I fagioli secchi di soia si pongono a bagno
in acqua per una notte.
2. Si trita finemente la soia nel mixer con
circa 10 mL d’acqua per circa 5 minuti.
3. Si filtra il puré di soia su carta assorbente
della cucina e si raccoglie il filtrato che
contiene l’ureasi (enzima).
Investigazione: l’effetto
dell’enzima sull’urea
1. Versare 2 mL di soluzione, estratta dal cavolo rosso, in ciascuna delle
3 provette.
2. Preparare la soluzione di urea (H2N – CO – NH2) versando 5 grammi
di solido bianco in 20 mL d’acqua. L’urea è un concime che si
compra dal fioraio o dai negozianti che vendono concimi agricoli.
3. Nella provetta 1 e 2 versare anche 2 mL di soluzione di urea (H2N –
CO – NH2). Qual è il colore assunto dal colorante?
4. Versare nella provetta 1 e nella provetta 3 circa 2 mL di estratto di
soia, che contiene l’enzima.
5. Ci sono stati cambiamenti di colore nelle tre provette dopo 3, 6, 9, …
minuti? In quale provetta si avverte un odore di ammoniaca?
H2N – CO – NH2 + H2O → 2 NH3 + CO2
Agli allievi si consegnano le seguenti tre soluzioni:
1. Cloruro di calcio – CaCl2
2. Bicarbonato di sodio – NaHCO3
3. Blu di BromoTimolo – BTB
Gli allievi possono usare anche un cilindro
graduato di 10 mL e dei sacchetti di plastica
trasparenti e sigillati. Essi provano tutte le
combinazioni possibili, mescolando due soluzioni
per volta in ciascun sacchetto, e descrivono le
eventuali reazioni.
Tieni a bagno, per 30 minuti in acqua calda a 50 °C
(non in acqua bollente ! ), le foglie tagliate sottilmente
del cavolo rosso. Filtra il miscuglio. Il filtrato freddo
dell’estrazione, di colore blu, lo usi per valutare
il pH di una soluzione incognita.
1. Si tagliano due strisce di alluminio e si sistemano nella vaschetta del
blister. Le strisce sono fermate sul tavolo con lo scotch.
2. Si collegano le strisce alla batteria da 4,5 Volt e al LED.
3. Il terminale più lungo del LED è collegato al polo positivo (P) della
pila. L’altra ‘’gamba’’ è connessa con una delle due strisce di
alluminio. L’altra striscia è connessa col polo negativo (N) della pila.
1. Rispondi alle seguenti domande, dopo aver investigato.
2. L’acqua distillata conduce la corrente elettrica?
3. L’acqua di rubinetto conduce la corrente elettrica?
4. L’aceto conduce la corrente elettrica?
5. L’ammoniaca di casa conduce la corrente elettrica?
Colori del cavolo rosso
pH 1
pH 13
Che cos’è la Chimica verde?
La
Chimica verde si basa sulla
progettazione di prodotti di
reazione e su processi che
riducano o eliminano l’uso e la
produzione di sostanze
pericolose.
Che cos’è la Chimica verde?
• La Chimica verde è chiamata
anche:
– Chimica sostenibile.
– Chimica progettata per non
essere dannosa.
– Chimica che combatte
l’inquinamento a livello
molecolare.
I 12 principi della Chimica verde
1. Prevenzione
2. Economia degli atomi
3. Sintesi meno pericolose
4. Uso di reagenti più sicuri
5. Uso di solventi più sicuri
6. Risparmio di energia
7. Riutilizzo dei reagenti
8. Riduzione dei derivati
9. Uso di catalizzatori sicuri e recuperabili
10. Eliminazione controllata dei rifiuti
11. Controllo dei rifiuti per prevenire l’inquinamento
12. Prevenzione degli incidenti
Applicazioni delle
tecnologie verdi
•
•
•
•
Prodotti antibatterici
Lavanderia e bucato
Purificazione dell’acqua
Produzioni industriali
Prodotti antibatterici
Agenti
antibatterici sicuri per l’ambiente
Sbiancanti alternativi al cloro
Applicazioni
Bende, suture, indumenti ospedalieri,
medicazione dell’acne, dentifrici, shampoo,
agenti antivirali
magnesium hydroperoxyacetate
H-O-O-Mg-O-O-H
diidroperossido di
HO O Mg OAc
magnesio
dihydroperoxide di
Na2CO3·1,5Hmagnesium
2 O2
percarbonato
HO O Mg O OH
sodio
Pulizia degli indumenti
I
catalizzatori TAML favoriscono la produzione
del perossido di idrogeno sui tessuti e la
disinfezione da estrogeni e contraccettivi
Inibiscono la degradazione dei colori
Utili per lavatrici a basso consumo d’acqua
T
X
X
Cat+
+
Cat
X
X
H
H
H
O
O
H
O
O
O
N
N
O
N
N III
Fe
III
Fe
N
N
N
NO
O
O
O
_
_
Collins, Carnegie Mellon University
Cat+ = Li+, [Me4N]+, [Et4N]+, [PPh4]+
+ = Li +, [Me N]+, [Et N]+, [PPh ]+
Cat
4
4
4
X = Cl,
H, OCH
3
X = Cl, H, OCH3
Pulizia degli indumenti
Prodotti
Le formulazioni per lavanderia incorporano
detergenti a pH neutro, enzimi, tensioattivi,
perossidi, ammorbidenti biodegradabili
Benefici
Eliminano i detergenti con alti valori di pH, gli
sbiancanti a base di cloro, la neutralizazione di
acidi, i tensiottavi non biodegradabili
Pulizia degli indumenti
La
pulizia a secco con diossido di
carbonio liquido (non tossico e non
infiammabile) è da preferire ai
processi correnti che usano il perc
(percloroetilene), un contaminante
dei reflui.
Pulizia degli indumenti
Imminodisuccinato
Biodegradabile,
di sodio
sicuro per l’ambiente,
agente chelante
Sintetizzato con un processo che non
produce rifiuti
Elimina l’uso di HCN
T
O
O
O
O
O
O
O
O
O
NaOH
NH3
NaOH
NH3
O
NaO
ONa
NaO
NaO
ONa
ONa
N
NaO
O
O
NH
H
ONa
O
O
Purificazione dell’acqua
Purificazione
con cloro
Importante per prevenire le malattie
Tossico per la vita acquatica
Per neutralizzare il cloro si usano composti solforati
Vitamina C (acido ascorbico)
Più sicuro, alternativa efficace per la
neutralizzazione
Potenzia il sistema immunitario acquatico
HOCH2
H O
HO
O
HOCH2
H O
HO
H
O
H
HO
OH
HO
OH
Linee guida della Chimica
Organica Verde
• Le investigazioni sulla Chimica Organica Verde
comportano l’uso di reagenti ecocompatibili e sicuri
per la salute degli allievi che li manipolano. Altri
requisiti importanti sono la facile reperibilità e il
basso costo. Fra i solventi consigliati ci sono l’acqua,
il metanolo, l’etanolo e la benzina, per i composti
insolubili nei primi tre solventi. Gli esperimenti
dovrebbero evitare lunghi e noiosi intervalli
temporali e le reazioni ad alta temperatura.
Laboratorio di Chimica
Organica Verde
• Preparazione di esteri profumati
• La preparazione degli esteri profumati, dalla reazione di un acido
carbossilico con un alcol, prevede la sostituzione del pericoloso acido
solforico concentrato con palline di resine acide recuperabili
(catalizzatore). La resina consigliata è l’AMBERLYST 15 (GOOGLE).
• La Procedura generale
• Per la sintesi in scala ridotta si usano 5 millimoli dell’acido carbossilico,
5 millimoli dell’alcol e 100 mg di resina in palline (Amberlyst 15: ci
sono due resine una per l’ambiente acquoso e una per l’ambiente non
acquoso, Aldrich).
• I reagenti e il catalizzatore si pongono in una provetta grande (18 x
180).
• Si riscalda il miscuglio a ricadere su bagno a sabbia per 20 minuti,
come descritto sull’articolo allegato.
Laboratorio di Chimica
Organica Verde
• Si recupera il liquido con contagocce e si secca su solfato di sodio
anidro. L’estere si riconosce dall’odore e con l’IR.
Acido
Alcol
Estere
Resa Odore
carbossilico
CH3COOH
(CH3)2CHCH2CH2OH CH3COOH2CCH2CH(CH3)2
89,2% Banana
CH3COOH
CH3CH2CH2CH2OH
CH3COOH2CCH2CH2CH3
83 %
Mela
CH3COOH
CH3(CH2)7OH
CH3COO(H2C)7CH3
80%
Arancia
HCOOH
(CH3)2CHCH2OH
CH3COOH2CCH(CH3)2
85,6% Lampone
CH3 CH2 COOH (CH3)2CHCH2OH
CH3 CH2 COOH2CCH(CH3)2 88%
Rum
La scuola del nuovo millennio
prevede:
• 1. La comprensione profonda delle grandi idee della Chimica.
• 2. Una Chimica sostenibile (Chimica verde), la difesa dell’ambiente
e della salute.
• 3. Il miglioramento dell’organizzazione dei materiali da studiare.
• 4. Una serie di strategie efficaci per connettere i concetti, dando la
preferenza alla didattica laboratoriale e all’apprendimento in
cooperazione fra studenti, in classe e in laboratorio.
• 5. La risoluzione di problemi reali, che abbiano senso per gli
studenti.
• 6. Di rendere praticabile l’intelligenza connettiva ossia lo
scambio di idee, procedure, prove di valutazione fra
le scuole della rete.
Mini lezioni
Attività
Valutazione formativa
La lezione, di circa 15 –
20 minuti, inizia con la
mappa conc. e alcune
domande
Chiedi, ogni tanto, se gli
allievi comprendono quello
che stai dicendo
Chiedi agli allievi di spiegare
i concetti con altre parole e
di fare i riassunti finali (1
minuto)
Autorizza gli
allievi a
comunicarti i
propri
interrogativi
mediante e-mail
Programma incontri
personali con gli
studenti
Durante la lezione fai
risolvere quiz a scelta
multipla (circa 10 minuti)
e problemi.
Assegna compiti per
casa e controlla i
quaderni e le mappe
concettuali finali.
Dopo una investigazione o
un probl.solv. lascia uno
spazio di riflessione
finale per connettere i
concetti.