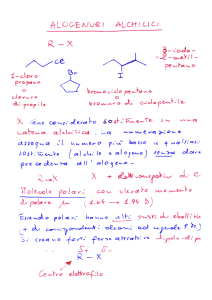
Reazione di eliminazione monomolecolare E1 La reazione di eliminazione monomolecolare E1 è una delle reazioni caratteristiche degli alogenoalcani; essa rientra nella categoria delle beta-­‐eliminazioni che, assieme alle sostituzioni nucleofile, è una reazione molto utile per la sintesi di composti diffusi anche nella vita quotidiana. Gli alogenoalcani, innanzitutto, sono composti contenenti un atomo di alogeno legato covalentemente a un atomo di carbonio ibridato sp3. Nel sistema di nomenclatura corrente questi composti prendono il nome di alogenuri alchilici, il cui simbolo generico è R-­‐X, dove X può essere F,Cl,Br,I. Gli alogenoalcani sono molecole molto versatili in quanto possono essere trasformati in alcoli, eteri, tioli, ammine ed alcheni. Essi infatti sono spesso utilizzati come materiale di partenza per la sintesi di composti utili in medicina, nella chimica degli alimenti e nell’agricoltura; tutto questo grazie alle due reazioni organiche sopra citate : le beta-­‐eliminazioni e le sostituzioni nucleofile. Occorre intanto distinguere le due famiglie di reazioni in quanto ciascuna di esse avviene in maniera specifica e diversa rispetto alle altre (queste differenze riguardano principalmente i tempi in cui la reazione avviene come vedremo a breve); in generale possiamo affermare che: •
•
le reazioni di sostituzione portano, in un reagente, sempre alla sostituzione di un atomo o di un gruppo di atomi da parte di un altro atomo o gruppo di atomi. In questa famiglia di reazioni organiche rientrano i meccanismi di sostituzione SN1 ed SN2; le reazioni di beta-­‐eliminazione portano sempre alla rimozione di un idrogeno e di un atomo o gruppo di atomi dal carbonio adiacente, con conseguente formazione di un doppio legame C-­‐C. A questa famiglia di reazioni organiche appartengono i meccanismi di eliminazione E1 ed E2. Sulla base di una notevole quantità di osservazioni sperimentali raccolte in un periodo di oltre 70 anni, i chimici hanno proposto due meccanismi limite per le sostituzioni nucleofile ( SN1 ed SN2) e due meccanismi limite per le beta-­‐eliminazioni (E1 ed E2). Ciò che distingue ciascun caso limite (oltre al fatto che i primi due sono di sostituzione e gli altri di eliminazione) sono i tempi di rottura e di formazione dei legami, come dicevo sopra. Per quanto richiesto dalla traccia mi soffermerò sul meccanismo di eliminazione monomolecolare E1. Meccanismo E1 In questa reazione organica si considera il caso limite in cui la rottura del legame C-­‐X (carbonio-­‐alogeno) è completa prima che avvenga una reazione con una generica base che strappa un idrogeno, formando un doppio legame C-­‐C. Questo meccanismo è designato E1 perché E sta per eliminazione, mentre 1 sta a indicare che una sola specie (l’alogenuro alchilico) è coinvolta nello stadio che limita la velocità della reazione. La legge cinetica per una reazione E1 si può esprimere come Velocità=k[alogenoalcano] Si può spiegare meglio quanto appena descritto con un esempio, ovvero con la reazione del 2-­‐
bromo-­‐2metilpropano per formare il 2-­‐metilpropene. In questo meccanismo a due stadi, quello che determina la velocità dell’intero processo è la scissione del legame carbonio-­‐alogeno che porta alla formazione di un intermedio carbocationico. Meccanismo di reazione E1 del 2-­‐bromo-­‐2-­‐metilpropano Nella seconda metà della figura si può osservare come questa reazione avvenga in due stadi : nel primo stadio della reazione si ha la rottura del legame tra Bromo e Cloro per formare un intermedio carbocationico. Questo stadio è il determinante della velocità di tutta la reazione, in quanto finchè il legame C-­‐Br non si scinde, non si può passare al secondo stadio in cui una base, in questo caso l’acqua, strappa un protone all’intermedio carbocationico e si ha la conseguente formazione di un doppio legame, quindi di un alchene. Analizzando un altro tipo di beta-­‐eliminazione chiamata deidroalogenazione si possono chiarire ulteriori concetti. In presenza di una base forte, come lo è ad esempio lo ione idrossido, l’alogeno di un alogenuro alchilico e l’idrogeno legato al carbonio adiacente possono essere rimossi dai carboni a cui sono legati per formare un doppio legame C-­‐C (come nel meccanismo di reazione appena descritto): Il carbonio legato all’alogeno viene chiamato carbonio-­‐alfa, mentre il carbonio legato a quest’ultimo è detto carbonio-­‐beta. Poiché i carboni legati a quello alfa possono essere più di uno e non equivalenti tra loro (ovvero possono recare diversi gruppi funzionali), da ciascuna reazione di eliminazione si possono formare due alcheni. Il prodotto principale in questo caso è l’alchene più sostituito e perciò il più stabile. In questi casi si dice che la reazione segue la regola di Zaitsev in onore del chimico che per primo formulò questa generalizzazione.